治疗血管性痴呆的中药复方研究思路与方法
——参麻益智方防治血管性痴呆的开发研究*
周丽娟,刘美霞,刘剑刚,孙成成,李南南,宋博策,畅苏瑞,韦 云,3,石丹丹,李 浩,3
(1.中国中医科学院 北京 100700;2.中国中医科学院西苑医院 北京 100091;3.中国中医科学院老年病研究所 北京 100091)
在形势严峻的全世界人口老龄化大背景下,据报道全世界每年新增990多万痴呆患者,2019年止,世界上已有近5000万痴呆患者,估计2050年将增加至1.52亿人[1]。且据推算,2030 年全球用于痴呆症的费用将达到2.54 万亿美元,2050 年将达到9.12 万亿美元[2],这将给整个社会和患者家庭带来沉重的经济负担和心理负担。而血管性痴呆(vascular dementia,VaD)是全球仅次于阿尔茨海默病(alzheimer disease,AD)的第二大最常见的痴呆[3]。VaD 是一种由大脑血流量减少和神经血管单元(neurovascular unit,NVU)受损导致的进行性神经认知功能障碍的临床综合征,主要症状包括记忆丧失、语言障碍和执行功能障碍,病因繁杂,具体发病机制尚不清楚[4-5],临床上治疗也颇为棘手。
中医认为,VaD 的发病与中风密切相关,气虚血瘀、肝阳上亢是其主要病机之一[6]。中医中药也因其自身独特的优势往往在VaD 等疑难疾病的诊疗过程中有着独到的见解和奇特的疗效,同时,中医中药这独特的优势也对推动中药现代化发展、新药开发以及临床应用方面等有着重要意义[7]。但也存在一些问题,主要是中医中药发挥作用的物质基础并不完全清楚,亦缺乏完备规范的针对中药复方研发的有效性及安全性评价体系,这就限制了其开发及国际化进程[8]。本文以临床治疗VaD 的经验方参麻益智方为研究对象,从临床疗效、药学研究、安全性评价、药效机制四个方面,探讨新药开发的过程,希冀为中药复方的研发提供一些思考,以及可供借鉴的思路与方法。
1 临床疗效是确定治疗血管性痴呆的中药复方是否具有研发价值的根本
中医药愈来愈受到国家重视。近年,国家把发展中医药纳入国家发展战略,《中医药发展战略规划纲要(2016-2030年)》中明确指出,中医药作为我国独特的卫生资源,具有原创优势的科技资源,应着力推进中医药创新,加强中医药科学研究[9]。而确切的疗效是中药及天然植物药研发的基础,是中药新药开发的关键所在,也是中药新药研发的首要评价环节[10]。VaD 由于该疾病的复杂性目前西医治疗十分有限,主要从其进展和行为的管理以及通过改变其危险因素进行预防这两种途径入手[11]。而中医药特点突出,本课题组在长期临证经验基础上总结出来的中药复方参麻益智方防治VaD 临床疗效确切,亟待进一步的研究。
1.1 参麻益智方的临床神经心理学量表评估
中药复方参麻益智方,由人参、天麻、川芎及鬼箭羽组成,具有益气活血化瘀,平肝潜阳的功效,临床应用近20 年,临床疗效显著。在临证经验的基础上,为进一步明确参麻益智方的临床疗效及作用机制,本研究团队进行了针对性的随机对照临床研究。共观察了64 例气虚血瘀、肝阳上亢型轻中度VaD 患者,分为试验组和对照组,试验组服用参麻益智免煎颗粒剂,对照组服用银杏叶片,疗程为3个月[12]。
研究结果显示,在认知功能方面,两种药物均可提高VaD 患者的简易智能状态量表(mini mental state examination,MMSE)和蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)积分,显著降低临床神经功能缺损量表(national institute of health stroke scale,NIHSS)积分,且参麻益智方疗效优于银杏叶组,尤其是在患者延迟回忆、计算力与注意力以及视空间与执行能力等方面。在日常生活能力方面,两组患者日常生活能力量表(activity of daily living scale,ADL)评分均较治疗前提高,但两组之间差异不大。在临床症状方面,两种药物均可改善VaD 患者智能减退、头晕、肢麻、神疲乏力、口唇紫绀等症状,但参麻益智方疗效更为突出(图1)。

图1 参麻益智方对VaD患者认知功能的影响[12]
1.2 参麻益智方的临床机理研究
在作用机制方面,两组患者血清中枢胆碱能系统、氧化应激、炎症反应的指标均有改善,参麻益智方调控胆碱能系统的作用更显著(图2)。此外,研究[6]还表明,参麻益智方可提高VaD 患者的红细胞变形能力、抑制血小板的聚集和黏附性、降低血液黏度,改善患者血液的流变性(图3)。提示参麻益智方能够明显改善VaD 患者的认知功能,其临床作用机制可能涉及提高乙酰胆碱含量,改善机体的细胞代谢能力,降低炎症因子含量等方面。
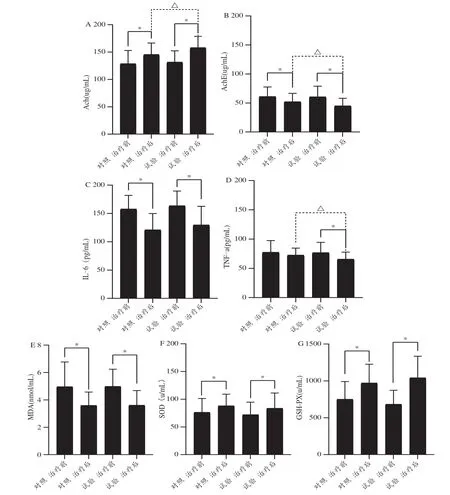
图2 参麻益智方改善VaD患者认知功能的机制[12]

图3 参麻益智方对VaD患者认知功能血液流变性的影响[6]
2 制备工艺稳定、质量可控是治疗血管性痴呆的中药复方研发的前提
中药复方制剂工艺研究应基于“质量源于设计(QbD)”的理念,遵循最大程度保留其原有临床疗效的基本思路,在保证制剂疗效、安全性、质量可控的前提下,一方面尊重传统,另一方面运用现代科学技术,力保明确药物基础,设计出最优工艺路线[13-14]。研究表明,参麻益智方中人参主要活性成分人参皂苷,其具有清除氧化自由基、抗氧化、抗衰老,抗神经元细胞凋亡、神经损伤修复、改善记忆力等作用[15]。天麻主要活性成分天麻素对脑缺血再灌注损伤提供保护,通过减轻神经毒性,具有抗氧化、抗炎、抗凋亡,抑制星形胶质细胞活化等作用[16]。川芎主要活性成分阿魏酸有较强的抗氧化性,可以有效清除羟自由基、超氧自由基等,还有降血脂、神经保护等作用[17]。鬼箭羽的主要化学成分,包括叶含卫矛碱、槲皮素等,具有降血糖、降血脂,抗炎、抗氧化,以及血管保护等作用[18]。
本课题组根据每味中药各自的特点,传统工艺联合现代技术,采用了参麻益智方全方醇提、全方水提及人参、天麻醇提+川芎、鬼箭羽水提三种提取工艺明确了药物有效物质成分,并采用高效液相色谱法对以上三种参麻益智方提取物进行主要有效成分及入脑成分含量的测定,最终确定人参、天麻醇提+川芎、鬼箭羽水提工艺为最佳提取工艺,并获得国家发明专利(ZL 201610565191.5),该制备工艺共明确11种有效成分,分别为人参的有效成分人参皂苷Rg1、Rb1、Re、Rd,天麻的有效成分天麻素、天麻苷元,鬼箭羽的有效成分槲皮素、香草醛,川芎的有效成分阿魏酸、洋川芎内酯I、洋川芎内酯H;其中人参皂苷Rg1、Rb1、Re、天麻素、槲皮素、阿魏酸6种为主要入脑成分(图4)。

图4 参麻益智方提取物主要入脑成分的液相色谱图[6]
同时并对该方进行了四种不同制备方法初步的药效学验证(图5)。1号方全成分入药,较好地保留了中药的全部化学成分,但服用量较大,制剂成型较为困难;2 号方保持了汤剂处方及群药共煎煮的特点,具有汤剂疗效稳定、易于吸收的优点,但人参作为贵细药材,与他药群煎有所浪费;3 号方中人参采用现代提取工艺,虽然提高了人参有效成分的含量,但与传统服法差别较大;4 号方中人参单煎既能溶出最大有效量,又与其他三味药保持了一致的传统水煎工艺。药效学结果显示1 号方的药效略优,但综合考虑各自制备工艺的优劣及临床常用方法,最终确定4 号方即人参加水单煎,天麻等其他三味药加水群煎为最优制备工艺[19]。并采用高效液相色谱法对该制备工艺获得的参麻益智方提取物中有效成分人参皂苷Rg1,人参皂苷Re,人参皂苷Rb1、天麻素、阿魏酸、槲皮素进行了标定(图6)。

图5 参麻益智方的制备工艺研究

图6 参麻益智方主要成分混标的离子流色谱图
3 安全性是治疗血管性痴呆的中药复方研发的必要条件
安全且无明显毒副作用是所有中西药物研发所必须具备的要素,中药复方也不例外。安全性评价主要采用急性毒性试验和长期毒性试验。通过观察动物急性中毒表现,以提供受试药物的急性毒性资料,确定毒作用方式、中毒反应,并为慢性毒性试验的观察指标及剂量分组提供参考。并进一步通过慢性毒性试验来研究重复接触受试药物毒性作用的剂量-反应关系,进而确定未观察到有害效应的水平和观察到有害效应的最低水平,为进行危险度评定和制定人类接触的安全限量提供参考[20]。课题组对参麻益智方进行了急性毒性试验和长期毒性试验,以明确其安全性。
3.1 中药复方参麻益智方的急性毒性试验
按照常规方法对参麻益智方进行小鼠的急性毒性试验[21],预实验中无法测出半数致死量(lethal dose 50,LD50),故进行了最大给药量测定。试验分为对照组和给药组,给药组24 h 内按最大体积及最大药物浓度一次灌胃给药,对照组灌服同体积蒸馏水,每日观察动物状况。结果显示小鼠无明显不良反应及死亡情况,且体质量正常增长,精神状态佳,毛色白而有光泽,二便正常,解剖后大体观察各主要脏器亦未见异常。最终确定参麻益智方对小鼠灌胃的最大给药量为97.6 g 生药/kg,为临床用量的207 倍(临床用量0.47 g生药/kg),可见在常规剂量下服用是安全的。
3.2 中药复方参麻益智方的长期毒性试验
在急性毒性试验证明参麻益智方初步安全性的基础上,进一步进行了参麻益智方对大鼠的长期毒性试验。试验分为四组:对照组(灌服同体积蒸馏水),参麻益智方5.875 g、11.75 g、23.5 g生药/kg(体质量)剂量组(分别为临床用量的12.5、25、50 倍,临床用量为0.47 g 生药/kg/日),连续给药26 周。观察药物对大鼠机体是否产生蓄积性及迟缓性中毒反应,提供毒性反应的靶器官及损害的可逆性,从而为临床的安全用药提供参考,以确保临床用药安全。试验结果表明不同剂量参麻益智方连续灌胃给药26周后,各组大鼠活动及精神状态良好,给药期间大鼠二便正常,毛色白且有光泽,均未出现中毒性死亡。个别剂量组大鼠摄食量及体质量与对照组比较有差异,可能与灌药影响大鼠食欲,进而影响体质量增长有关。血液学、血清生化、心电图等各项检查指标均在生理范围内波动,未见不良反应。解剖大体及镜下观察各组动物脏器均未发现异常改变,亦未见中毒性病理改变,为临床长期安全用药提供了可靠保障。
4 药物作用机制明确为治疗血管性痴呆的中药复方走向国际化提供了可能
中药复方因成分复杂,作用机制不够明确,限制了其与国际接轨或被国际范围内认可,因此在中药复方的研发上要尤其注重明确药物作用机制。动物模型实验有助于明确药效及探讨药物作用机制。但目前尚无一种能够完全模拟人类VaD 病理及行为改变的动物模型,最常见的有2 血管闭塞(2 vessel occlusion,2VO)VaD 模型等血管闭塞模型,微球诱导多发性梗死VaD 模型等多发性梗死和血栓栓塞模型[22]。此外,国内外科研人员还常选用东莨菪碱等抗中枢乙酰胆碱药物制造记忆障碍模型,对记忆影响的机制研究较为明确,结果重现性较好[23]。同时选用不同类型的VaD 动物模型观察复方防治VaD 的药理作用,能够从多个靶点较全面地评价复方防治VaD 的疗效及作用机制。
4.1 基于双侧颈总动脉结扎致VaD 模型的参麻益智方的药效学研究
研究表明,慢性脑低灌注(chronic cerebral hypoperfusion,CCH)与VaD 和AD 的发生和进展有关,且最广泛应用的CCH 和VaD 实验模型是大鼠永久性双侧颈总动脉闭塞,即2VO 模型[24]。采用双侧颈总动脉结扎致2VO 模型可以影响脑血流,诱发以脑组织慢性广泛的低氧、低灌注状态为主要病变特点,慢性脑缺血为主要病理特征的大鼠VaD模型。
4.1.1 参麻益智方对大鼠行为学的影响
水迷宫定位航行实验,模型组逃避潜伏期显著增加,寻台次数均显著减少;参麻益智方三剂量组逃避潜伏期均显著减少,寻台次数均显著增加。盐酸多奈哌齐组表现出相同的作用(图7)。

图7 大鼠水迷宫逃避潜伏期及寻台次数比较
水迷宫空间探索实验,模型组穿越原平台次数、原平台象限游泳时间占总游泳时间百分比均显著减少;参麻益智方三剂量组穿越原平台次数、原平台象限游泳时间占总游泳时间百分比均显著增加。盐酸多奈哌齐组表现出相同的作用(图8)。

图8 大鼠水迷宫穿越原平台次数及目标象限停留时间比较
4.1.2 参麻益智方对大鼠病理形态学的影响
光镜下海马组织显示,假手术组大鼠海马CA1 区神经元排列整齐紧密,细胞内结构完整,细胞膜清晰,胞质丰富,核膜、核仁较明显,未见神经元变性或坏死。模型组大鼠的海马CA1 区神经元排列散乱稀疏,细胞层次和数量明显减少,部分细胞有核固缩现象,可见细胞出现空泡变性,甚至坏死。盐酸多奈哌齐组、参麻益智方三剂量组海马CA1 区神经元排列有一定的改善,细胞数量较模型组有明显增加,细胞结构较为完整,细胞膜大致清晰,偶见细胞空泡变性,少有细胞坏死(图9)。

图9 光镜下观察参麻益智方对大鼠海马CA1区病理形态的影响(HE×100)
电镜下海马组织显示,假手术组大鼠海马线粒体结构基本正常,排列整齐,膜外形基本完整,线粒体嵴密集,没有见到明显的肿胀及空泡形成。模型组大鼠的海马线粒体肿胀明显,膜模糊不清,部分膜发生破裂,线粒体嵴断裂疏松溶解,少数线粒体内可见空泡形成。盐酸多奈哌齐组、参麻益智方三剂量组海马线粒体排列有一定的改善,结构较为完整,线粒体膜大致清晰,稍有肿胀,偶见空泡变性(图10)。

图10 电镜下观察参麻益智方对大鼠海马线粒体超微结构的影响(×20000)
4.1.3 参麻益智方对大鼠脑组织神经递质Ach、AchE含量的影响
模型组Ach 含量显著减少,AchE 含量显著增加;参麻益智方高剂量组Ach 含量显著增加,参麻益智方三剂量组AchE 含量均显著减少。盐酸多奈哌齐组表现出相同的作用(图11)。

图11 各组大鼠脑组织神经递质AchE、Ach含量
4.1.4 参麻益智方对大鼠血清炎症因子IL-1β、TNF-α含量的影响
模型组IL-1β、TNF-α 含量均显著增加;参麻益智方三剂量组IL-1β、TNF-α 含量均显著减少。盐酸多奈哌齐组表现出相同的作用(图12)。

图12 各组大鼠血清炎症因子IL-1β、TNF-α含量
4.1.5 参麻益智方对大鼠血清GSH、GSH-PX、MDA、SOD含量的影响
模型组谷胱甘肽(GSH)、GSH-PX 含量均显著减少,MDA 含量均显著增加;参麻益智方中、高剂量组GSH、SOD 含量均显著增加,参麻益智方高剂量组GSH-PX 含量显著增加,参麻益智方三剂量组MDA 含量均显著减少。盐酸多奈哌齐组GSH、含量显著增加(图13)。

图13 各组大鼠血清GSH、GSH-PX、MDA、SOD含量
综上所述,双侧颈总动脉永久性结扎是致慢性脑缺血较为经典的模型。大鼠施行永久性双侧颈总动脉结扎手术后,出现脑血流量减少,学习和记忆功能障碍,脑内神经元损伤及死亡,突触及树突损伤,以及神经炎症反应等的时程变化,能复制人类VaD 的病理改变和临床症状,为VaD 的病理机制和防治药物研究提供帮助[25]。基于此模型进行的参麻益智方药效学研究发现:给予药物治疗后,参麻益智方组大鼠逃避潜伏期、AchE、IL-1β、TNF-α、MDA 含量均显著减少,寻台次数、穿越原平台次数、原平台象限游泳时间占总游泳时间百分比、Ach、GSH、GSH-PX、SOD 含量均显著增加。说明参麻益智方可以提高模型大鼠的学习记忆功能,改善海马的病理形态,保护神经元,增强胆碱能系统功能,抑制海马CA1 区小胶质细胞和星形胶质细胞的激活和增生,抑制炎症反应,提高机体抗氧化能力[26]。
4.2 基于多发性脑梗死致VaD 模型的参麻益智方的药效学研究
多发性梗死和血栓栓塞模型是VaD 临床上最相关的模型。采用微球栓塞剂或者大鼠自体血栓致多发性脑梗死VaD 模型,使栓子从颈动脉进入脑内广泛不均匀分布,诱发以脑组织中广泛小血管病变为主要病变特点,小缺血灶或微梗死灶和缺血性白质病变为主要病理特征的大鼠VaD模型[27]。
4.2.1 参麻益智方对大鼠行为学的影响
水迷宫定位航行实验,模型组逃避潜伏期显著增加,寻台次数显著减少;参麻益智方三剂量组逃避潜伏期均显著减少,参麻益智方中、高剂量组寻台次数均显著增加。盐酸多奈哌齐组表现出相同的作用(图14)。
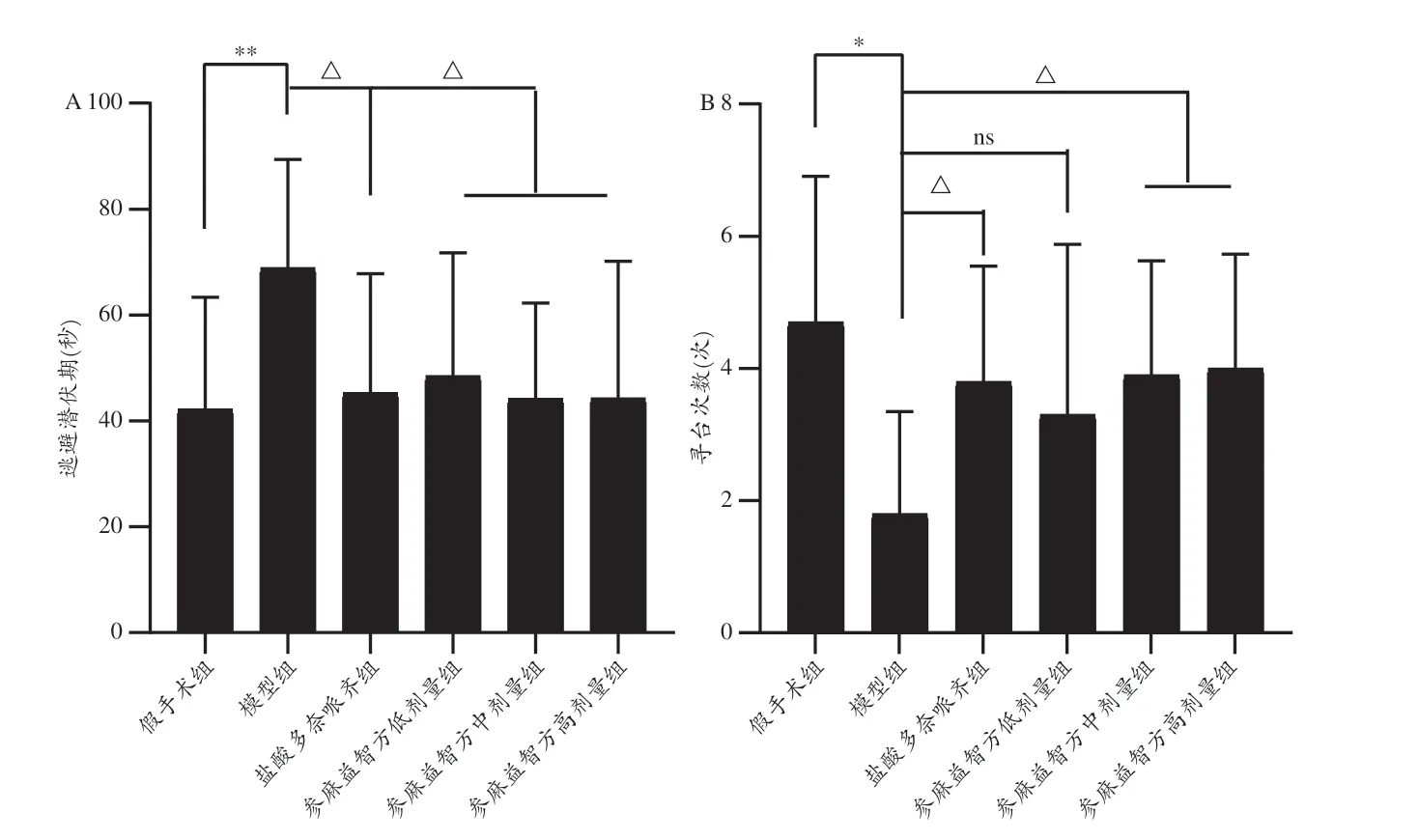
图14 大鼠水迷宫逃避潜伏期及寻台次数比较[32]
水迷宫空间探索实验,模型组穿越原平台次数、原平台象限游泳时间占总游泳时间百分比均显著减少;参麻益智方中、高剂量组穿越原平台次数、原平台象限游泳时间占总游泳时间百分比均显著增加。盐酸多奈哌齐组表现出相同的作用(图15)。

图15 大鼠水迷宫穿越原平台次数及目标象限停留时间比较[32]
4.2.2 参麻益智方对大鼠血清神经递质Ach、AchE 含量的影响
模型组Ach 含量显著减少,AchE 含量显著增加;参麻益智方中、高剂量组Ach 含量均显著增加,AchE含量均显著减少。盐酸多奈哌齐组表现出相同的作用(图16)。

图16 各组大鼠脑组织神经递质AchE、Ach含量
4.2.3 参麻益智方对大鼠血清炎症因子IL-1β、TNF-α含量的影响
模型组IL-1β、TNF-α含量均显著增加;参麻益智方三剂量组IL-1β含量均显著减少,参麻益智方中、高剂量组TNF-α 含量均显著减少。盐酸多奈哌齐组表现出相同的作用(图17)。

图17 各组大鼠血清炎症因子IL-1β、TNF-α含量[32]
4.2.4 参麻益智方对大鼠血清GSH、GSH-PX、MDA、SOD的影响
模型组GSH、GSH-PX、SOD 含量均显著减少,MDA 含量均显著增加;参麻益智方中、高剂量组GSH、GSH-PX 含量均显著增加,MDA 含量均显著减少,参麻益智方三剂量组SOD 含量均显著增加。盐酸多奈哌齐组表现出相同的作用(图18)。

图18 各组大鼠血清GSH、GSH-PX、MDA、SOD含量[32]
脑能量不足或脑局部供能不足是多发性脑梗死导致学习记忆等认知功能低下的关键微环境改变[28]。而脑白质作为大脑皮质处理信息的补充,对人的认知功能亦十分重要,脑白质损伤是VaD 的常见病理表现之一[29-31]。基于此模型进行的参麻益智方药效学研究发现:给予药物治疗后,参麻益智方能够明显减少大鼠逃避潜伏期、AchE、IL-1β、TNF-α、MDA 含量,增加大鼠寻台次数、穿越原平台次数、原平台象限游泳时间占总游泳时间百分比、Ach、GSH、GSH-PX、SOD 含量,说明参麻益智方对多发脑梗死性VaD 模型大鼠的学习记忆能力有改善作用,通过改善大鼠海马病理形态,减轻脑白质损伤,增强胆碱能系统功能,抑制炎症反应,提高机体抗氧化能力,以及对NVU 的各个组成部分包括血脑屏障、神经元和胶质细胞以及细胞间联络通道的神经保护作用[32-34]。
4.3 基于获得性记忆障碍VaD 模型的参麻益智方的药效学研究
学习和记忆是一个极其复杂的生理过程,主要包括记忆获得、记忆巩固和记忆再现三个重要过程,不同的影响因素由于作用途径和靶点不同,所产生的记忆障碍类型也不同[35]。本课题组主要从东莨菪碱、氯丙嗪和乙醇分别诱导的三种经典记忆障碍模型入手,探讨参麻益智方的药效机制。研究表明东莨菪碱主要是通过阻断脑皮层和海马胆碱能系统突触后膜的受体,进而改变受体蛋白的构型,造成记忆损伤[36]。而氯丙嗪主要是通过阻断多巴胺受体、5-羟色胺受体、α-肾上腺素受体、M-型乙酰胆碱受体,进而特异性阻滞第一级记忆向第二级记忆转移的过程,造成记忆获得障碍[37-38]。而乙醇主要是一方面通过抑制中枢神经,产生细胞毒性反应,另一方面通过使脂质过氧化,造成活性氧大量累积氧化应激效应,最终损害胆碱能神经系统[39]。
本课题组研究结果显示,与东莨菪碱模型组比较,盐酸多奈哌齐组、参麻益智方中、高剂量组小鼠潜伏期显著延长,参麻益智方三剂量组小鼠错误次数显著减少(图19);与氯丙嗪模型组比较,参麻益智方中、高剂量组小鼠潜伏期显著延长,参麻益智方高剂量组错误次数显著减少,盐酸多奈哌齐组表现出相同的作用(图20);与乙醇模型组比较,参麻益智方中、高剂量组潜伏期显著延长,盐酸多奈哌齐组、参麻益智方中、高剂量组错误次数显著减少(图21)。表明参麻益智方对东莨菪碱、氯丙嗪和乙醇致记忆障碍模型小鼠学习记忆功能具有改善作用,其机制可能与保护胆碱能系统,提高中枢神经兴奋性,改善神经递质活性,以及保护中枢神经系统,抑制中枢神经系统的毒性作用有关。
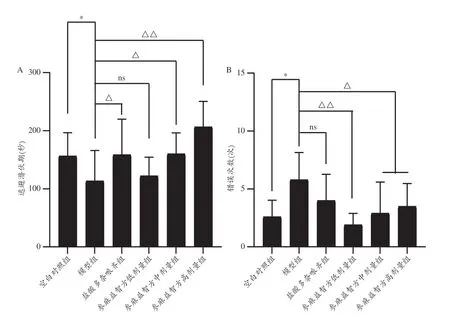
图19 小鼠跳台逃避潜伏期及错误次数比较(东莨菪碱模型)
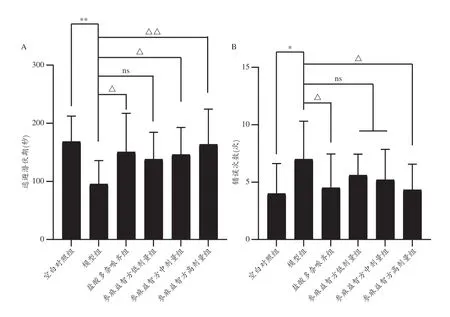
图20 小鼠跳台逃避潜伏期及错误次数比较(氯丙嗪模型)

图21 小鼠跳台逃避潜伏期及错误次数比较(乙醇模型)
5 讨论
VaD 的发病率随着年龄的增长而不断增加,导致全球老年人口中痴呆症日益加剧[40]。针对VaD这一老年重大疑难慢性疾病,本研究团队首先提出“气虚血瘀,肝阳上亢”为VaD 的主要中医病因病机理论,基于这一理论基础,结合多年的临证实践,确定由“人参、天麻、鬼箭羽、川芎”组成的中药复方参麻益智方,体现了中医药特色和优势。在临床研究证实其疗效的基础上,进一步从药学、毒理学及药效学等方面对其进行探讨和研究,参麻益智方目前已获得了北京市医疗机构应用传统工艺配制中药制剂备案(京药制备字Z20200005000),并在国家科技重大新药创制项目的支持下,参麻益智颗粒正在开展进一步新药的研发。
中药复方的药学研究是药品质量可控的保证,也是安全性和有效性实验的前提,主要包括药材提取、制备、质量控制研究等[41]。本研究团队按照药典及相应规范,结合现代科学技术,进行了提取制备工艺的筛选及优化,并明确参麻益智方的主要有效成分,最终确定其最佳提取工艺,为治疗VaD 的中药复方的药学研究模式提供借鉴。药物安全关乎全人类的健康与生存,药物安全性评价是保证药物安全的第一道关口[42]。按照现代毒理学实验要求,选用常规经典的急性毒性实验和长期毒性实验,探索参麻益智方对小鼠的急性毒性作用及大鼠的长期毒性作用,为参麻益智方的安全性评价提供了科学依据。
中药复方的药效机制研究是中药复方研发中至关重要的一环,也是目前中药复方研究中难度较大的一环,需要不断丰富和发展符合中医药临床特点的实验方法学体系来揭示中药复方功能主治和证的现代科学内涵。VaD 是一组复杂的症状群,涵盖了脑血管疾病致痴呆症的一系列临床和神经病理表现,病因及病理机制不明,进展困难[43]。然而目前尚无与之完全匹配相吻合的动物模型,本研究团队综合不同模型的特点,选用了多种VaD 动物模型,从多个角度较为全面的评价了中药复方治疗VaD 的疗效及作用机制。但仍然存在诸多不足,药效学设计方案仍不够完善,未能从脑微血管方面进行机制探讨,也未从脑组织直观检测炎症因子、氧化应激水平及更多机制评价指标,并且也未建立中医证型动物模型等等,应在今后的研究中予以补足。
中药复方是中医药文化的精髓,是中医临床用药的主要形式,是中药新药研发的主要类别,是中医药传承创新的重要载体[44]。中医药现代化创新的来源是中医药理论和临床实践及现代科学技术发现和应用,将传统的中医药理论和现代科学体系,技术的结合、整合、融合,可以上升到新的发展高度[45]。本研究团队遵循源于临床-证于实验-回归临床的研发路径,虽然研究方案仍有待进一步改进,但是基本思路尚清,一方面为课题组今后开展的研究提供了重要支撑及基本研究方案,同时另一方面也为中药复方新药的研发提供一些参考。

