外源脯氨酸缓解玉米幼苗盐胁迫的效应
陈奋奇,方 鹏,白明兴,姬祥卓,庄泽龙,彭云玲
(1. 甘肃农业大学农学院, 甘肃 兰州 730070;2. 甘肃省干旱生境作物学重点实验室, 甘肃 兰州 730070;3. 甘肃省作物遗传改良与种质创新重点实验室, 甘肃 兰州 730070)
土壤盐碱化严重制约了全球农业生产与发展,全球约20%耕地和33%灌溉农田受到土壤盐分的影响[1]。同时,农业生产中的不合理灌溉和过度施肥导致土壤盐碱化逐年加剧,对农业生产造成的影响也逐年加重[2]。植物在高盐环境中会受到渗透和离子双重胁迫而营养失衡,同时产生活性氧损害自身的生理和代谢活动,进而影响正常生长,造成农业生产的巨大损失[3-4]。因此,如何利用好盐渍化土地,减少盐碱土对农作物的伤害,增加农民的收入,已成为全球农业生产的重要任务之一。
脯氨酸(proline, Pro)是重要的渗透调节保护剂之一,分子量小,水溶性大,对细胞无毒害作用,其在缓解植物遭受的逆境胁迫中发挥着重要的作用[5-6]。在逆境环境下,植物通过合成大量的Pro来调节渗透平衡,稳定原生质胶体和组织代谢,以缓解植物因胁迫引起的损伤,从而提高植物的抗逆性[7]。外源Pro的施用也会增加植物对逆境的抵御能力和适应性,尤其对盐胁迫具有较好的缓解效果,如王玮等[8]采用水培法研究外源Pro对盐胁迫下萝卜(Raphanus sativus)幼苗生长及生理生化的影响,结果表明施加外源Pro可通过提高抗氧化酶的活性和有机渗透调节物质的含量有效缓解盐胁迫对萝卜幼苗生长的抑制作用,从而增强萝卜植株对盐胁迫的抗性和适应能力。陈晓云等[9]也通过不同浓度外源Pro处理100 mmol·L-1NaCl胁迫下的荞麦(Fagopyrum esculentum)幼苗,结果表明20~30 mmol·L-1Pro是缓解荞麦盐胁迫的最佳浓度,该浓度处理时,盐胁迫下的荞麦叶片质膜透性和丙二醛(malondialdehyde, MDA)含量显著降低,超氧化物歧化酶(superoxide dismutase, SOD)活性和净光合速率显著增加。因此,说明外源Pro可诱导植物体内产生抵抗盐胁迫的能力,提高植物对盐胁迫的耐受性。
玉米(Zea mays)是世界上最重要的农业经济作物之一,其既可作为粮食、饲料,又可作为生物能源,但其是一种非耐盐性作物[10-11]。李文阳等[12]通过不同的盐浓度处理不同玉米品种,发现盐胁迫下玉米苗期的株高和地上部鲜重显著下降,且下降速度与盐浓度成正比。此外,盐胁迫还会导致玉米幼苗长势弱小,气孔导度低,光合效率差,严重影响其后期的生长发育和产量[13]。所以,提高玉米在苗期的耐盐性对其后期的生长发育及产量具有极其重要的意义,而关于外源Pro对盐胁迫下不同耐盐性玉米自交系幼苗生长缓解效应的研究鲜见报道。因此,本研究以玉米耐盐自交系8723和盐敏感自交系P138为试材,在盐胁迫下添加外源Pro,从生长参数、生理特性和离子稳态三方面研究外源Pro对盐胁迫下耐盐性不同玉米自交系在苗期的影响,旨在探索利用外源Pro来缓解盐胁迫对作物的毒害,为农业生产中使用化学调控手段提高作物对盐胁迫的耐受性提供理论依据。
1 材料与方法
1.1 试验材料
供试材料来自甘肃农业大学玉米课题组前期筛选出的耐盐玉米自交系8723 (来源于引进玉米自交系8723)和盐敏感玉米自交系P138 (来源于美国杂交种P78599的后代材料)。
1.2 试验设计与处理
1.2.1 试验设计
试验设4个处理,分别为CK:蒸馏水;Pro:250 μmol·L-1Pro;N:180 mmol·L-1NaCl;NP:180 mmol·L-1NaCl + 250 μmol·L-1Pro。每 个 处 理3次 生 物 学 重复。以上处理浓度均为甘肃农业大学玉米课题组实验室前期筛选所得的最佳处理浓度[14]。
1.2.2 幼苗生长试验
1.3 指标测定与方法
1.3.1 生长参数测定
分别从各处理中取长势健康且整体一致的幼苗5株,用直尺分别测定株高与最长根长度,并分别称量地上部与地下部鲜重。
1.3.2 生理指标测定
相对含水量(relative water content)与相对电导率(relative conductivity)的测定参照彭云玲等[15];SOD活性、过氧化物酶(peroxidase, POD)活性、过氧化氢酶(catalase, CAT)活性测定参照Zhang和Kirkham[16];根系活力(root activity)测定参照白宝璋等[17]。游离脯氨酸含量测定采用茚三酮显色法[18],可溶性糖含量(soluble sugar content)测定采用蒽酮硫酸比色法测定[19];MDA含量测定采用硫代巴比妥酸显色法[20]。各指标3次重复。
1.3.3 离子含量测定
将各植株从营养钵中取出冲洗干净,将根、茎、叶分离,于105 ℃烘箱中杀青30 min后置于80 ℃烘箱中48 h烘干至恒重,然后粉碎过0.25 mm筛,离子含量采用H2SO4-H2O2法在Topwave微波消解仪(Analytik Jena,德国)中进行消化。分别准确称取0.5 g根、茎、叶于微波消解罐中,加入浓硫酸5 mL和30%过氧化氢2 mL,按微波消解仪的操作流程进行消解。消解结束,等消解罐冷却后将消解液转移至50 mL容量瓶中,用去离子水定容至刻度混匀备用。K、Ca、Na标准溶液购自国家有色金属及电子材料分析测试中心。利用TAS-990 Super原子吸收分光光度计(北京普析通用仪器有限责任公司)采用火焰原子吸收法(FL-AAS)测定各个离子的含量。
1.4 统计与分析
使用SPSS 19.0软件处理数据,采用Duncan法进行差异显著性分析,结果用平均值 ± 标准误表示,采用Excel 2016作图。
2 结果与分析
2.1 外源Pro对玉米生长参数的影响
盐胁迫及外源Pro处理下,两耐盐性不同玉米自交系的生长情况存在差异(图1)。与CK相比,盐胁迫下P138与8723的苗长、根长、地上部鲜重、地下部鲜重均降低,且P138的这些指标均达到显著变化(P< 0.05),分别降低了39.81%、39.36%、44.22%和46.27%;而8723仅根长与地下鲜重显著降低,分别降低了17.55%和27.98%。与CK相比,Pro处理下两自交系的苗长、根长、地上部鲜重、地下部鲜重均无显著差异(P> 0.05);而与盐处理相比,NP处理下,P138的苗长、根长、地上部鲜重、地下部鲜重均显著升高,分别增加了38.06%、28.75%、43.90%和41.67%;而8723仅根长与地下鲜重显著升高,分别增加了15.32%和42.34%。以上结果说明外源Pro对盐敏感自交系P138的缓解效果比耐盐自交系8723明显。
152 程序性死亡配体 1 在索拉非尼耐药肝癌细胞中的表达和功能 孙非凡,李 东,李 华,王 涛,刘 煜,张 涛
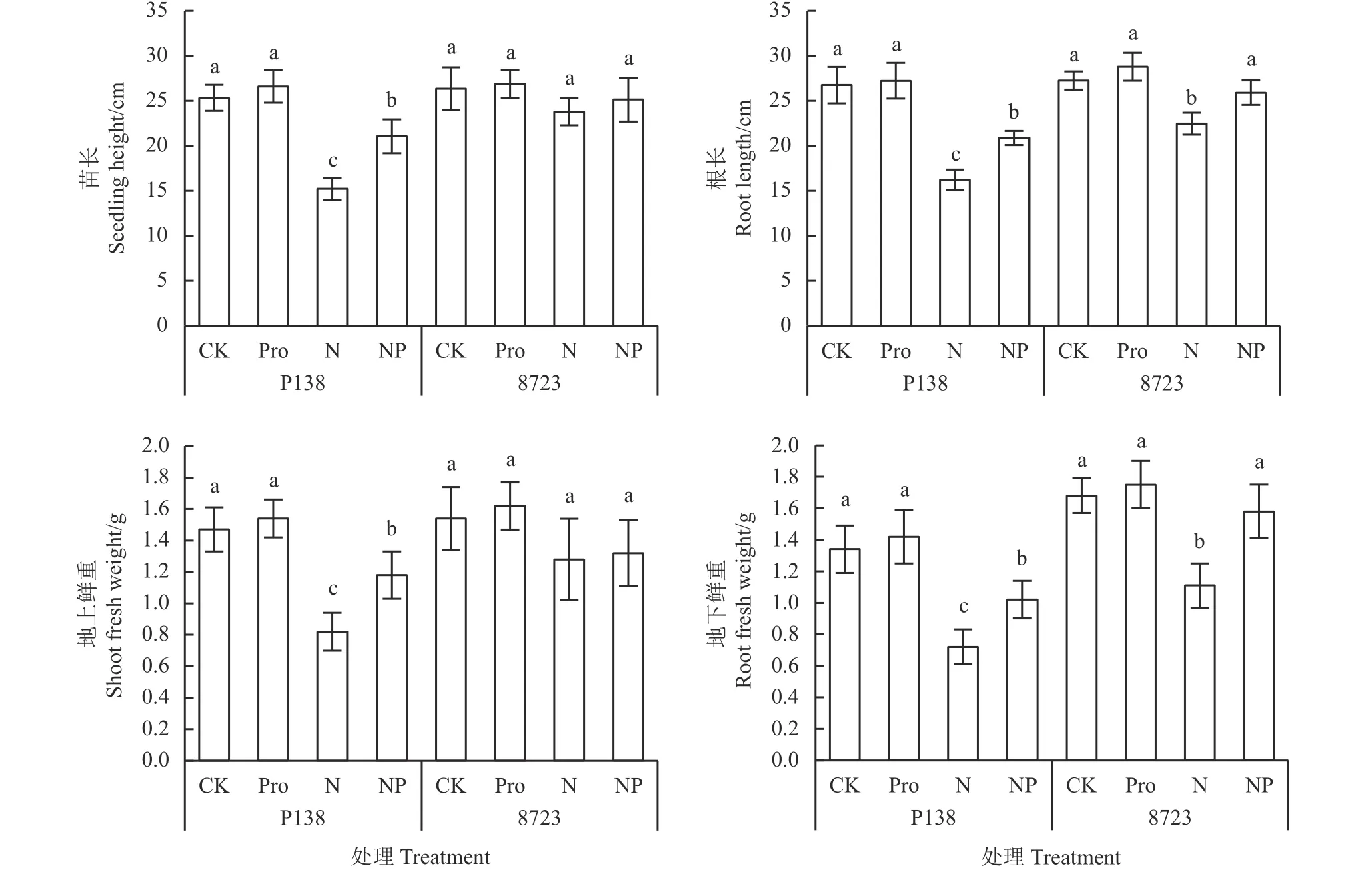
图1 盐胁迫及外源Pro对玉米幼苗表型的影响Figure 1 Effects of salt stress and exogenous Pro on maize seedling phenotype
2.2 外源Pro对玉米幼苗生理特性的影响
盐胁迫及外源Pro处理下,P138与8723在生理特性方面也存在差异(图2)。两自交系在不同处理下,相对含水量与根系活力均呈现先降后升趋势,而其他生理指标均呈现出先升后降趋势。8723的相对含水量与根系活力在各处理下均未表现出显著差异(P> 0.05),而P138在盐胁迫下较CK分别下降了29.35%和53.34%。两自交系的Pro含量、SOD及POD活性在盐胁迫下显著升高(P< 0.05),P138分别是CK的1.97、2.59和1.71倍,8723分别是CK的2.04、2.57和1.62倍,两自交系在Pro含量、SOD及POD活性的上升幅度比较相近。盐胁迫下相对电导率、MDA含量、CAT活性及可溶性糖含量在P138中也显著升高,分别是CK的3.04、2.07、2.46和2.61倍,除相对电导率外,其余3个指标在8723中也显著升高。此外,与CK相比,Pro处理下,两自交系的各生理特性指标均未发生明显差异;而与盐处理相比,NP处理下相对含水量与根系活力在两自交系中均表现出升高趋势,且在P138中均显著性升高,分别升高了19.97%和40.86%;而Pro含量、MDA含量、SOD活性、POD活性、CAT活性及可溶性糖含量在两自交系中均表现出降低趋势,并且在P138中均显著降低,分别降低了29.22%、31.48%、29.32%、17.48%、27.43%和38.72%;而8723仅Pro含量、SOD活性及POD活性显著降低,分别为11.66%、17.04%和10.17%。
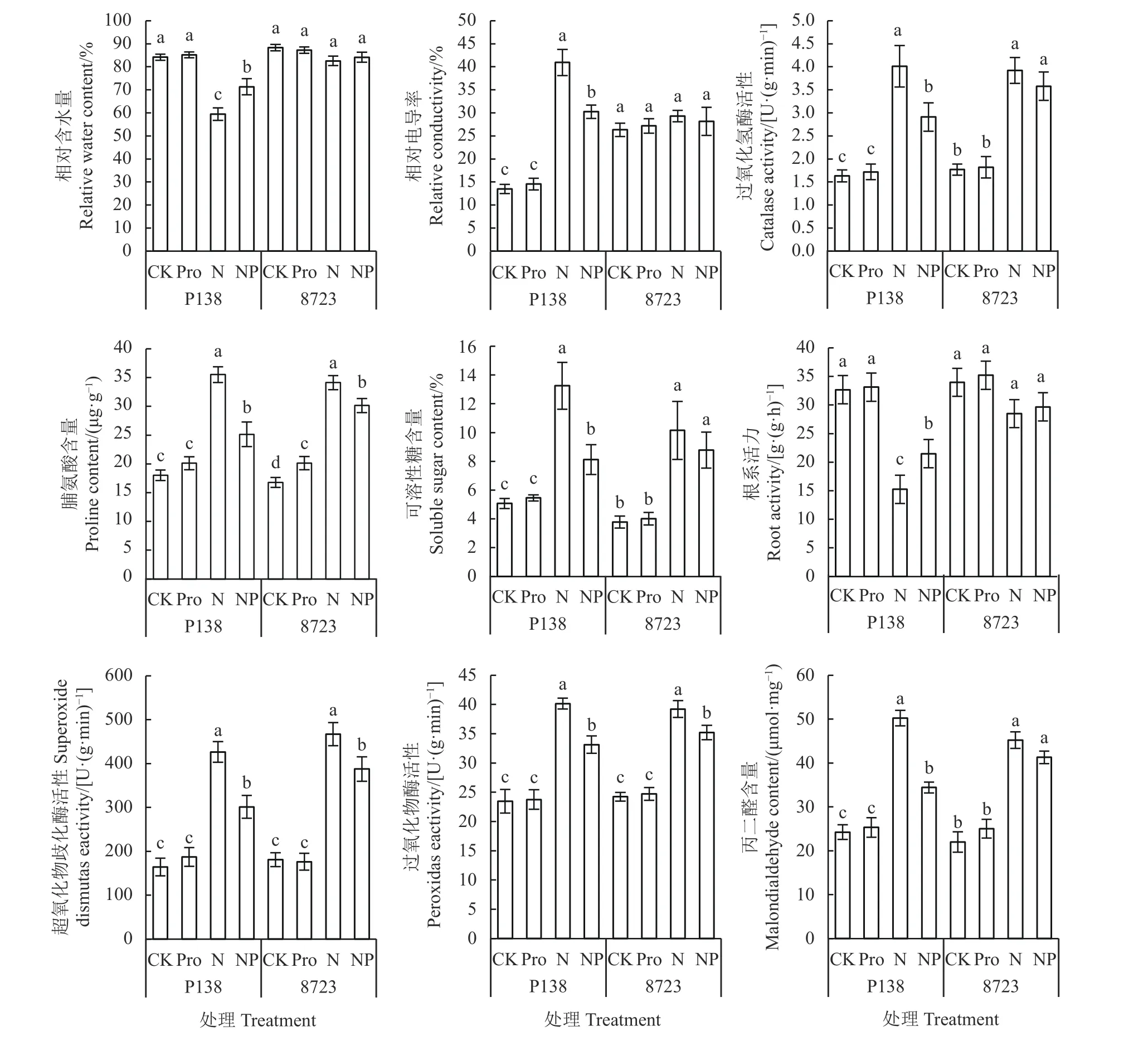
图2 外源Pro对玉米幼苗生理特性的影响Figure 2 Effect of exogenous Pro on physiological characteristics of maize seedlings
2.3 不同处理玉米幼苗期离子含量的变化
2.3.1 不同处理玉米幼苗期的Na+含量
在盐胁迫及外源Pro处理下两玉米自交系根、茎、叶中Na+含量表现存在差异(图3)。与CK相比,盐胁迫下两自交系根、茎、叶中Na+含量均显著升高(P< 0.05),且在P138中分别升高了6.79、4.65和5.58倍,8723分别升高了7.58、6.53和5.74倍。此外,与CK相比,Pro处理下,两自交系的根、茎、叶中Na+含量均未发生明显差异(P> 0.05);而与盐处理相比,NP处理下,P138的根、茎、叶中Na+含量均显著降低,分别降低了41.83%、34.83%和24.66%,而8723仅在根和叶中Na+含量显著降低,分别降低了34.24%和15.14%;NP处理下P138各部位Na+含量变幅大于8723。
2.3.2 不同处理玉米幼苗期的K+含量
与CK相比,盐胁迫下两自交系根、茎、叶中K+含量均显著降低(P< 0.05) (图3),P138分别降低了28.12%、58.83%和56.70%,8723分 别 降 低 了31.27%、35.32%和36.91%,P138茎和叶中K+含量相比8723降低幅度更大。此外,与CK相比,Pro处理下两自交系的根、茎、叶中K+含量均未发生明显差异(P> 0.05);而与盐处理相比,NP处理下两自交系根、茎、叶中K+含量均显著升高,P138分别升高了15.82%、47.10%和70.80%,8723分别升高了23.56%、18.70%和25.53%;P138茎与叶中K+含量升高幅度大于8723。

图3 不同处理下玉米幼苗中Na+、 K+、Ca2+ 含量的变化Figure 3 Changes in Na+, K+, and Ca2+ levels in maize seedlings under different treatments
2.3.3 不同处理玉米幼苗期的Ca2+含量
盐胁迫下两自交系根、茎、叶中的Ca2+含量较CK处理均显著下降(P< 0.05) (图3),P138分别降低了61.76%、52.13%和53.32%,8723分 别 降 低 了50.79%、38.67%和37.79%,P138各部位Ca2+含量相比8723降低幅度更大。此外,与CK相比,Pro处理下,两自交系的根、茎、叶中Ca2+含量均未发生明显差异(P> 0.05);而与盐处理相比,NP处理下两自交系根、茎、叶中的Ca2+含量均显著升高,P138分别升高了120.37%、51.78%和68.95%,8723分别升高了55.86%、20.60%和28.72%,说明P138各部位Ca2+含量升高幅度明显大于8723。
2.3.4 不同处理玉米幼苗中的Na+、K+、Ca2+比值
在盐胁迫下,8723和P138各个部位的K+/Na+和Ca2+/Na+较CK均 显 著 下 降(P< 0.05) (表1)。与CK相比,Pro处理下两自交系的根、茎、叶中K+/Na+和Ca2+/Na+均未发生明显变化(P> 0.05);而与盐处理相比,NP处理下两自交系各部位Ca2+/Na+均显著升高,且盐敏感自交系P138根与茎中K+/Na+比值均显著升高,分别升高了99.31%和130.00%,耐盐自交系8723根与叶中K+/Na+比值均显著升高,分别升高了88.79%和46.82%。
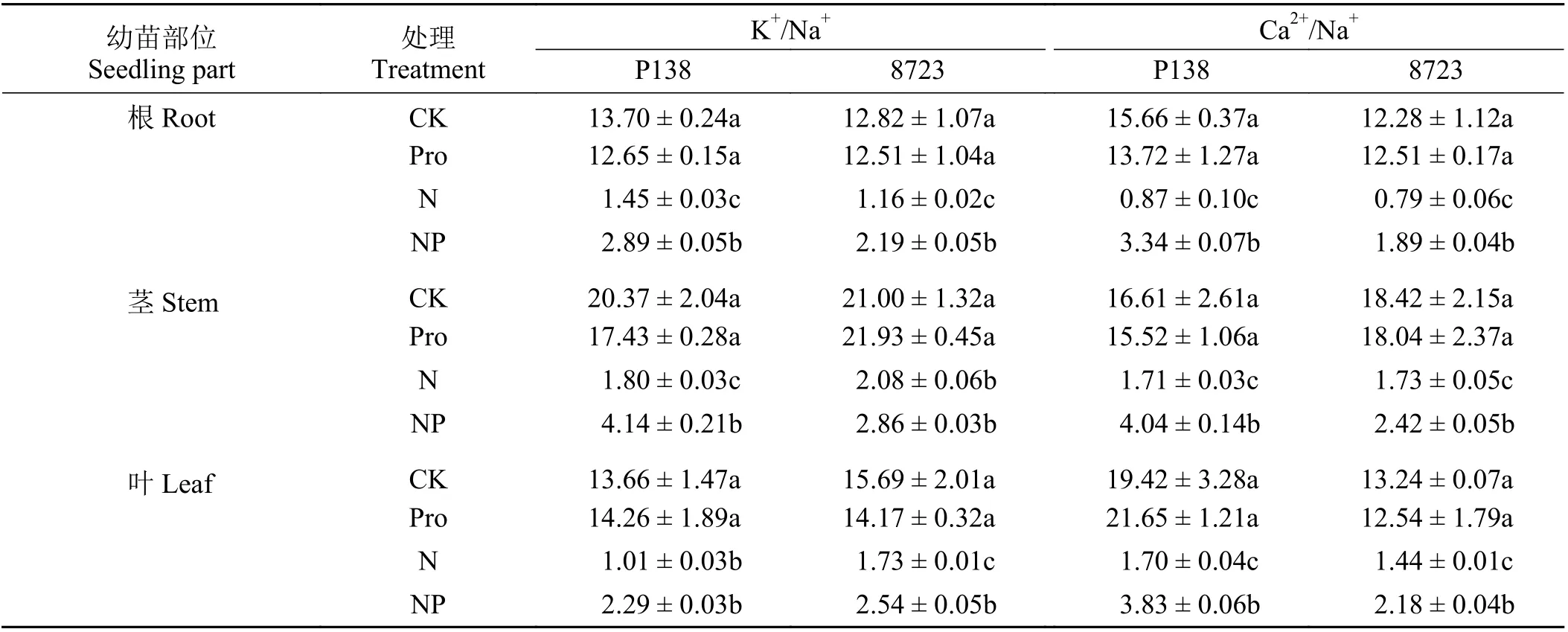
表1 不同处理下米幼苗K+/Na+和Ca2+/Na+的变化Table 1 Changes in K+/Na+ and Ca2+/Na+ in maize seedlings under different treatments
3 讨论与结论
根系是植物最早感受到盐胁迫的器官,且其生长会因胁迫而受到抑制,植物处于幼苗期时,表现得尤为明显[21]。本研究发现,耐盐玉米自交系8723与盐敏感玉米自交系P138在盐胁迫下,根长和地下鲜重相较于清水对照均显著降低,且P138的降低幅度更大,这表明P138对盐胁迫表现出了更强烈的反应。苗长可以较好地反映玉米在幼苗期地上部生长状况的好坏。在盐胁迫下,两自交系中仅P138的苗长与地上鲜重相比于对照组均显著降低。在NP处理下,两个自交系的苗长、根长、地上鲜重及地下鲜重均有所升高,且P138的这些指标均显著升高。因此,说明外源Pro可以缓解盐胁迫对玉米幼苗的伤害作用,且对盐敏感自交系的缓解效果更明显,这与沙汉景等[22]在水稻(Oryza sativa)中的研究结果一致。
相对含水量高低能够反映植物抵御盐胁迫引起的生理干旱水平[11]。根系活力也是一种评价植物抵御盐胁迫的重要指标[23]。相对电导率能够反映盐胁迫对植物细胞膜的损伤程度,其值较低时表明植物细胞膜因盐胁迫引起的损伤越低,抵抗盐胁迫的能力越强[15,24-25]。此外,盐胁迫会破坏植物细胞内活性氧(ROS)代谢系统的平衡,导致活性氧含量的累积。而这些活性氧因膜脂的过氧化或脱脂作用,使得细胞膜受到损伤和破坏,从而增大细胞膜透性,引起MDA含量的升高[26-27]。SOD是清除活性氧的关键酶,其能够催化O2-或者HO2-歧化成O2和H2O2,而POD与CAT主要负责清除细胞内的H2O2[21]。在本研究中,盐胁迫下,P138的相对电导率、MDA含量、CAT活性、SOD活性、POD活性及可溶性糖含量均显著升高,而相对含水量与根系活力均显著降低;除相对电导率外,8723中其他指标也显著升高,而相对含水量与根系活力无显著变化。因此,说明玉米幼苗因盐胁迫导致活性氧的积聚与清除系统的平衡破坏,使得抗氧化物酶SOD、CAT以及POD活性显著提高。在外源Pro的作用下,盐敏感玉米自交系P138的相对电导率、MDA含量、CAT活性、SOD活性、POD活性及可溶性糖含量较盐胁迫处理均显著降低,而8723中仅Pro含量、SOD活性及POD活性显著降低。这表明外源Pro通过提高玉米幼苗体内3种抗氧化酶的活性,提高对活性氧的清除能力,进而降低活性氧对其细胞膜的过氧化作用,从而有效缓解盐害作用,这一缓解效果在P138中表现更为突出。Pro具有清除活性氧,降低细胞渗透势,维持细胞膜正常功能的作用,故此其不仅是重要的渗透调节物质,而且也是关键的抗氧化物质[28]。本研究中,两个玉米自交系的Pro含量在盐胁迫下均显著升高,这与在石竹(Dianthus chinensis)中的研究结果[29]相一致。当施用外源Pro后,两个自交系中Pro含量相比盐胁迫均显著降低,而P138降低更为明显,这可能是由于外源Pro的补偿,使得内源Pro含量降低,提高了玉米幼苗的耐盐性。
盐胁迫对植物的生长抑制主要在于两方面,一方面是由于活性氧的积聚而造成的过氧化伤害,另一方面则是离子胁迫引起的植物体内营养离子平衡的紊乱,两个过程相互促进,进而影响植物正常的生理代谢过程[30-31]。在盐胁迫下,植物细胞内Na+的增多会明显抑制K+选择性吸收的能力[32]。同时,高浓度的Na+会交换出细胞中的Ca2+,引起植物体内Ca2+含量的降低,破坏细胞内离子平衡,进而造成营养离子代谢失调[21]。本研究发现,在盐胁迫下,两玉米自交系根、茎和叶中Na+含量均显著升高,但K+与Ca2+含量在两自交系的根、茎和叶中均显著降低。K+/Na+和Ca2+/Na+比值是衡量细胞内离子稳态和伤害程度的重要指标[33]。本研究发现两玉米自交系的K+/Na+和Ca2+/Na+比值在盐胁迫下均显著降低。当盐胁迫与外源Pro交互处理后,两自交系根、茎和叶Na+含量较盐胁迫处理均显著降低,而K+和Ca2+含量均显著提高,且K+/Na+和Ca2+/Na+比值大部分显著升高,这与Sobahan等[34]在水稻和李广鲁等[35]在冰叶日中花(Mesembryanthemum crystallinum)中的研究结果相一致。因此,这说明外源Pro很可能是通过某些生理机制来提高玉米幼苗细胞内K+和Ca2+含量,降低Na+含量,进而有效提高了玉米幼苗的耐盐性。
此外,研究发现,在25 mmol·L-1NaCl胁迫下,外源Pro增加了盐敏感水稻的叶绿素、脯氨酸和抗坏血酸含量、K+/Na+比值及抗氧化酶活性,但这些数据在耐盐水稻中基本没有受到影响[36]。并且,沙汉景等[22]利用外源Pro缓解盐胁迫下水稻的研究中也发现,外源Pro对盐敏感品种的调控作用大于耐盐品种。在本研究中,外源Pro对盐胁迫下盐敏感玉米自交系幼苗各生长参数及相关生理指标的缓解程度也大于耐盐自交系。因此,说明外源Pro对盐敏感品种具有更好地缓解效应。据此推测实际生产中,若要通过使用外源Pro提高玉米幼苗的耐盐性,应该首先考虑所选玉米自交系本身的耐盐特性。当使用对象是盐敏感自交系时,会取得更好的效果。
综上所述,添加外源Pro能够有效缓解盐胁迫下玉米幼苗的生长抑制,其作用过程主要体现在两个方面,一方面通过提高SOD、POD以及CAT等抗氧化物酶的活性以及玉米体内游离Pro含量,进而降低甚至清除其体内活性氧的积聚,从而减少丙二醛含量并稳定细胞膜结构,以此提高玉米幼苗的耐盐性和对盐环境的适应性。另一方面外源Pro可通过提高玉米细胞内K+和Ca2+含量,减少Na+的毒害作用,进而增强细胞体内离子平衡能力,维持原有细胞的营养离子平衡稳态,从而提高玉米幼苗对盐胁迫的耐性。总之,在180 mmol·L-1的NaCl胁迫下,施加外源250 μmol·L-1的Pro可以有效缓解两个玉米自交系受到盐胁迫的伤害,尤其对盐敏感自交系的缓解效果更明显。但是关于外源Pro与玉米内源Pro含量的关系,以及对活性氧代谢、离子平衡调节的分子机理有待于进一步研究证明。

