磁共振灌注成像对胶质瘤复发与放射治疗后反应的诊断价值
彭丹丹,王立莎(通信作者),李 光,张 贤,郭振华
(襄阳市第一人民医院西院区放射科 湖北 襄阳 441000)
神经胶质瘤是颅脑常见原发性肿瘤,约占所有颅脑肿瘤的35%~60%,具有特殊的侵袭性生长特点,手术及术后放疗是主要治疗方法。但手术常难以完全切除,容易造成肿瘤组织残留或复发,虽然术后放疗能抑制残留肿瘤病灶的生长,但也容易发生放射性脑损伤[1]。这是由于放疗可破坏血脑屏障和白质脱髓鞘,导致放射性脑损伤的发生。由于神经胶质瘤复发和放射性脑损伤在发生时间、临床表现上相似,且在常规MR图像上缺乏特征性表现,导致鉴别诊断效果不佳,临床无法获得有力的诊断证据[2]。磁共振灌注成像(perfusion-weighted imaging,PWI)是一种新型MRI技术,能够反映组织水分子扩散程度,对脑组织病理、生理和代谢变化的评估效果较好,可形成灌注成像产生时间-信号强度变化的曲线,计算多种灌注相关参数指标,能定量描述病灶区域微血管结构与功能,提高对胶质瘤复发与放射性脑损伤的鉴别诊断效果[3-4]。本研究进一步分析PWI对胶质瘤复发与放射治疗后反应的诊断价值,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2018年1月—2020年12月在我院经手术切除治疗的46例神经胶质瘤术后患者的临床资料。男29例,女17例,年龄18~75岁,平均(47.8±11.2)岁;所有患者WHO分为Ⅱ~Ⅲ级,均行手术切除治疗,术后接受常规放疗,放射剂量40~70 Gy,术后3个月行常规MR检查和PWI,观察是否存在病灶异常强化,评估有无肿瘤复发或放射性脑损伤。
1.2 MR诊断标准
放射性脑损伤:MR强化病灶无变化或逐渐缩小,病灶占位效应及周围水肿逐渐减轻。胶质瘤复发:连续≥2次MR强化灶呈进行性增大,有病灶占位效应[5]。
1.3 方法
采用东芝1.5T全身双梯度磁共振成像仪(Toshiba,Japan),头颅八通道线圈,检查序列为横轴位T1WI、T2WI、FLAIR、DWI、PWI;具 体 参 数:T1WI序 列中,TR/TE=1 957 ms/25 ms,层厚5 mm,间距1.5 mm,FOV为24×18 cm,矩阵320×256;T2WI序列中,层厚和间距同T1WI,TR/TE=7 400 ms/114 ms,FOV为24×24 cm,矩阵320×320;DWI序列采用平面回波成像,TR/TE=7 000 ms/80 ms,b值取0、1 000 s/mm2;PWI序列中,TR/TE=1 600 ms/23 ms,层厚5 mm,间隔1 mm,FOV为24×24 mm[6]。将所有数据传入后处理工作站,获得脑血容量图、脑血流量图、平均通过时间图,测定强化最明显处的相对脑血容量(cerebral blood volume,rCBV)、相对脑血流量(cerebral blood flow,rCBF)、相对平均通过时间(mean transit time,rMTT)。
1.4 观察指标
分析胶质瘤复发与放射性损伤的MR图像特征,统计常规MR和PWI的诊断准确率;比较胶质瘤复发及放射性脑损伤的MPI形态学指标,包括强化形态和最大强化宽度;记录胶质瘤复发及放射性脑损伤病灶强化区域的rCBV、rCBF、rMTT值;计算PWI鉴别诊断胶质瘤复发及放射性脑损伤的敏感度、特异度和准确率。
1.5 统计学方法
采用SPSS 21.0统计软件进行数据处理。正态分布的计量资料采用均数±标准差(± s)表示,组间比较采用t检验;计数资料用频数(n)和百分比(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般结果
46例患者均行术后放疗,行追踪复查,明确病理类型;其中,胶质瘤复发31例、放射性脑损伤15例。
2.2 常规MR检查结果及PWI检查结果
胶质瘤复发与放射性损伤均在T1图像上呈稍低信号,T2图像上以高信号为主,病灶呈混杂信号,均有不同程度占位效应,病灶周边伴长T2信号,病灶中心呈等或略低信号。增强T1WI上,胶质瘤复发病灶多呈结节状、斑片状强化,放射性坏死病灶多呈“柳絮”状、“奶酪”状强化。常规MR的诊断准确率为36.96%(17/46),PWI的诊断准确率为84.78%(39/46),差异有统计学意义(P<0.05)。
2.3 胶质瘤复发及放射性脑损伤的MPI形态学比较
肿瘤复发组的结节样强化形态、最大强化宽度≥5 mm的比例高于放射性脑损伤组,差异有统计学意义(P<0.05),见表1。
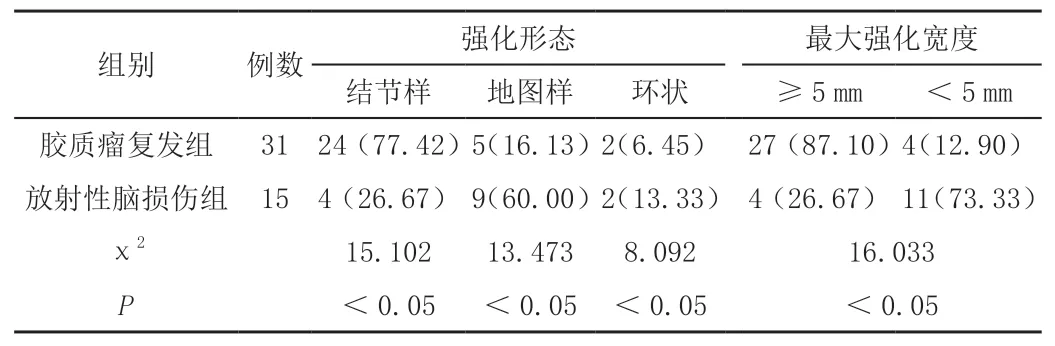
表1 胶质瘤复发及放射性脑损伤的MPI形态学比较[n(%)]
2.4 胶质瘤复发及放射性脑损伤的rCBV、rCBF及rMTT值比较
肿瘤复发组的rCBV、rCBF显著高于放射性脑损伤组(P<0.05),但两组rMTT相当,差异无统计学意义(P>0.05),见表2。
表2 胶质瘤复发及放射性脑损伤的rCBV、rCBF及rMTT值比较(± s)
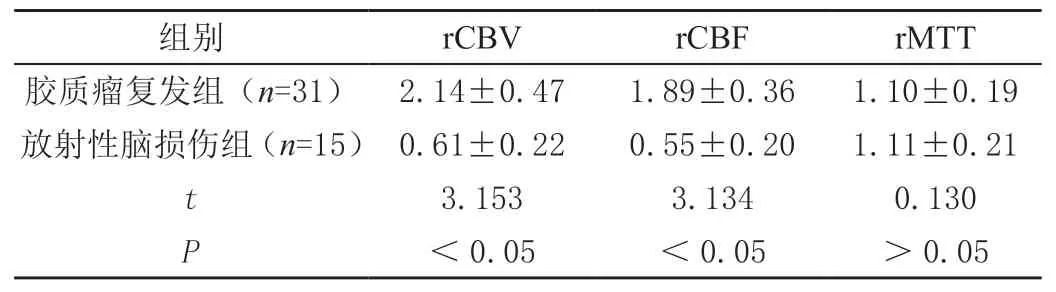
表2 胶质瘤复发及放射性脑损伤的rCBV、rCBF及rMTT值比较(± s)
?
2.5 PWI鉴别诊断胶质瘤复发及放射性脑损伤的敏感度、特异度和准确率
PWI诊断敏感度为87.10%(27/31)、特异度为80.00%(12/15)、准确率为84.78%(39/46),见表3。
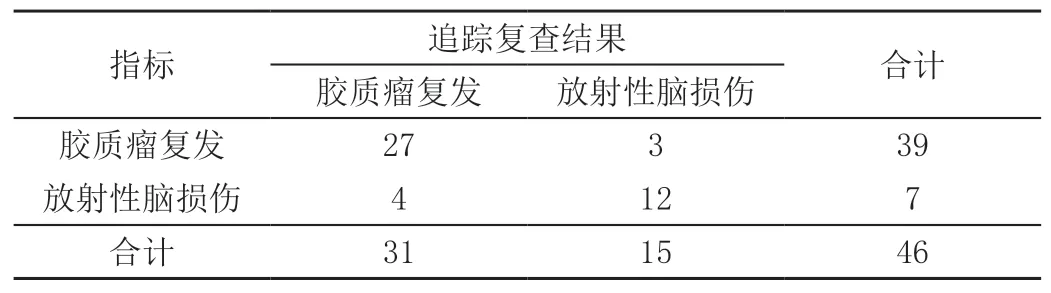
表3 PWI鉴别诊断肿瘤复发及放射性脑损伤的结果 单位:例
3 讨论
目前,脑胶质瘤术后复发及放射性脑损伤的鉴别诊断是影像学上的一大难题。常规MR检查对胶质瘤复发和放射性脑损伤的鉴别诊断效果有限。由于胶质瘤复发及放射性脑损伤在MR上均表现为不同程度的占位效应,病灶周围出现水肿,且强化后均可出现强化征象[7]。同时,两者在临床表现上也较为相似,均有颅内压增高引起的恶心呕吐、嗜睡等症状,伴随局部神经功能损害症状[8]。这些均给临床鉴别诊断及治疗方案的选择带来一定困难。
放射性脑损伤在T1WI序列上多呈稍低或低信号,若伴出血,则以低信号为的主混杂信号,伴有不同程度占位效应。增强扫描病灶多呈不规则强化,强化程度与肿瘤分化、血脑屏障破坏程度密切相关[9]。胶质瘤复发的强化多呈结节样,若出现胼胝体侵犯,呈现跨中线的新发强化灶,以次可确认为肿瘤进展。放射性损伤由于血脑屏障的破坏也可出现局部组织强化,导致异常强化的放射性损伤病灶与胶质瘤复发的常规MR图像相似,缺乏特异度[10]。
PWI利用MR图像后处理技术,可反映组织微血管分布与血流灌注情况,通过生成灌注成像产生时间-信号强度变化的曲线,计算rCBV、rCBF、rMTT,从而定量描述目标区域内微血管结构与功能[11]。同时,通过计算rCBV、rCBF、rMTT能评估脑血流动力学情况,分析局部脑组织的灌注,提供血流动力学的半定量参数[12]。其中,CBV是鉴别放射性坏死与胶质瘤复发的主要参数。由于放射性坏死一般缺乏新生血管,病理表现为血管内皮细胞、血管壁等坏死或血管壁玻璃样变,血管管腔狭窄,导致CBV值下降,而胶质瘤复发有大量新生血管,血流灌注增加,导致CBV值升高[13-14]。因此,通过CBV值可鉴别诊断胶质瘤复发和放射性坏死。
临床研究显示,胶质瘤的病理分级与rCBV、rCBF等反映肿瘤血管增殖程度的灌注指标存在明显关联[15]。复发胶质瘤与原发胶质瘤一样,也存在肿瘤新生血管,这些肿瘤新生血管不成熟,缺乏平滑肌层,基底膜不完整,渗透性更高[16]。通过rCBV、rCBF可捕捉到这种高增殖和高渗透状态的血管,在图像上表现出高灌注性。而放射性脑损伤为脑组织坏死、血管内皮细胞坏死及血管壁纤维素样坏死、神经纤维髓鞘脱失等,病灶内缺乏新生血管,rCBV、rCBF呈明显降低,在灌注图像上呈低灌注[17]。
本研究结果显示,常规MR的诊断准确率为36.96%(17/46),PWI的诊断准确率为84.78%(39/46),差异有统计学意义(P<0.05);肿瘤复发组的结节样强化形态、最大强化宽度≥5 mm的比例高于放射性脑损伤组,差异有统计学意义(P<0.05);肿瘤复发组的rCBV、rCBF高于放射性脑损伤组,差异有统计学意义(P<0.05),但两组rMTT相当,差异无统计学意义(P>0.05);PWI鉴别诊断胶质瘤复发及放射性脑损伤的敏感度为87.10%(27/31)、特异度为80.00%(12/15)、准确率为84.78%(39/46)。充分证明PWI对胶质瘤复发与放射性损伤的鉴别诊断有重要价值,rCBV、rCBF能准确反映脑血流灌注状态,为临床鉴别诊断提供有力依据,能提高诊断率,且诊断的敏感度、特异度和准确率均较高。值得注意的是,胶质瘤复发病灶的rCBV、rCBF可存在与放射性脑损伤部分重叠的现象,可能由于两者均可破坏血脑屏障,引发漏血,对比剂通过此处时局部磁场不均匀,影响CBV、CBF的测量。也有可能患者存在胶质瘤复发与放射性脑损伤并存的情况[18]。在今后的研究中,可进一步结合MR波谱成像或PET核素显像等增强对两者的鉴别诊断效果。
综上所述,PWI对胶质瘤复发与放射治疗后反应的诊断价值确切,诊断的敏感度、特异度及准确率高,鉴别诊断效果好,值得推广使用。

