内镜黏膜下剥离术在合并进展期头颈部癌的早期食管癌及癌前病变中的初步探索*
张真铭,包郁,赵锐,周凌霄,刘武松,陈曦,胡尚志,李生平,王苒霖
610041 成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 内镜中心
头颈部癌(head and neck cancer,HNC)是常见的恶性肿瘤之一,在我国男性中HNC的发病率位列所有恶性肿瘤的第 6 位,死亡率为第 7 位[1-2]。HNC可伴发同时性或异时性多原发癌,伴发部位主要位于食管,不仅影响临床治疗策略的制定,而且明显影响患者的预后[3]。临床工作中,HNC通常以晚期病变为主,主要采取以放化疗为主的综合性治疗方案,早期食管癌及癌前病变的治疗则主要采用内镜下病变切除术,最常采用的内镜技术为内镜黏膜下剥离术(endoscopic submucosal dissection,ESD),具有创伤小、恢复快、生活质量高、远期疗效确切及复发率低等优势[4-5]。然而,对于早期食管癌及癌前病变合并HNC这种特殊情况,临床治疗则较为棘手,缺乏标准的治疗方案,临床技术也有待进一步提高。本研究通过回顾性分析2017年11月至2019年10月于四川省肿瘤医院内镜中心接受ESD治疗的19例早期食管癌或癌前病变合并HNC患者的临床资料,并将同期实施的35例ESD治疗的单纯早期食管癌及癌前病变患者的临床资料与之比较,旨在探讨ESD治疗早期食管癌及癌前病变合并HNC的可行性、安全性及临床应用价值。
1 对象与方法
1.1 研究对象
本研究选取2017年11月至2019年10月间四川省肿瘤医院内镜中心实施的ESD手术患者为研究对象。本研究两组患者的食管黏膜病变均采用相同的纳入与排除标准。纳入标准:1)食管黏膜重度异型增生;2)病变局限在上皮层或黏膜固有层;3)病变浸润黏膜肌层或黏膜下浅层,未发现淋巴结转移的临床证据;4)无严重的合并症或重要脏器功能不全,可耐受内镜手术。排除标准:1)食管黏膜病变浸润至黏膜下深层;2)食管黏膜病变明确发生淋巴结转移;3)一般情况差,无法耐受内镜手术;4)患方放弃治疗。根据纳入及排除标准最终筛选出早期食管癌或癌前病变合并进展期HNC患者19例(ESD 1组),ESD 1组尚需满足HNC病理诊断明确,排除HNC临床治疗效果差者;单纯早期食管癌或癌前病变的患者35例(ESD 2组),ESD 2组尚需排除合并其它恶性肿瘤患者。
1.2 诊治方法
1.2.1 食管病变的诊断 内镜检查使用日本奥林巴斯公司EVIS LUCERA 260系统和EVIS LUCERA ELITE 290内镜系统,H-260Z或H-290Z放大内镜。检查时依次对咽喉、食管、胃及十二指肠进行观察,采用白光及窄带成像(narrow band imaging,NBI)模式进行仔细观察,并喷洒1.25%碘溶液约5 mL进行食管黏膜染色观察,最后对异常区域进行活检,以获取病理诊断[6]。
1.2.2 HNC的诊断 HNC患者的内镜检查使用日本奥林巴斯公司EVIS LUCERA 260内镜系统,BF-1T260内镜。检查时依次对口腔、鼻腔、鼻咽、口咽、下咽和喉进行观察,用白光模式及NBI模式进行仔细观察,并对异常的病变部位进行活检,以获取病理诊断[7]。
1.2.3 食管病变合并HNC的治疗模式 对于食管黏膜病变,根据白光内镜、电子染色内镜、放大胃镜、色素内镜、超声内镜及增强CT等评估食管黏膜病变,符合内镜下切除术适应症的患者行食管ESD手术。麻醉方式采用气管插管全身麻醉[8]。ESD手术流程如下:碘染色后距病灶边缘约5 mm进行电凝标记。于病灶边缘标记点外侧进行多点黏膜下注射,将病灶充分抬起。于标记点外侧缘约5 mm切开黏膜,行黏膜下剥离,一次性完整剥离整个病变。对术后创面上可见的断端及粗大裸露血管进行电凝烧灼,预防术后出血。
因食管黏膜病变合并HNC的特殊性,故本研究采用多学科(multidisciplinary team,MDT)诊治模式[9],MDT团队由内镜科、影像科、病理科、头颈外科、胸外科、肿瘤内科及放疗科等学科的专家组成,MDT团队讨论决定两处病变的具体治疗方案及治疗顺序。通常临床治疗策略以分期更晚的HNC为主线进行治疗,兼顾食管黏膜病变的内镜精细评估结果。对于食管ESD术后的非治愈性切除病例,追加治疗方式仍由MDT团队制定,治疗方式包括根治性放化疗或根治性外科手术,并征求患者的治疗意愿。
MDT团队制定的食管黏膜病变合并HNC患者的治疗顺序选择有两种方案:方案一,先行HNC治疗,治疗方式包括:根治性放化疗、外科手术联合放化疗及根治性外科手术,再行食管ESD治疗;方案二,先行食管ESD治疗,再行HNC治疗,治疗方式主要为根治性放化疗,如食管ESD术后出现非治愈性切除,则与HNC一同放化疗,方案兼顾HNC的具体分期、淋巴结转移情况以及食管ESD非治愈性切除等因素。对照组的单纯食管黏膜病变病例则直接行食管ESD治疗。
1.3 ESD术后随访
1.3.1 内镜随访 ESD术后3个月、6个月、12个月各随访1次上消化道内镜,若无残留复发,此后每年复查1次,合并HNC患者尚需复查鼻咽喉镜。
1.3.2 影像学随访 ESD术后病理结果显示为癌前病变患者,可不常规行影像学检查;术后病理结果显示为鳞癌患者,对于治愈性切除每年复查一次颈部、胸部及上腹部增强CT,对于非治愈性切除则两年内每半年复查一次CT,两年后每年复查一次;必要时可行头颈部核磁共振及正电子发射计算机断层显像检查,筛查转移灶。
1.4 统计方法
采用SPSS 26.0统计学软件进行统计处理。计量资料以平均值±标准差来表示,并先经方差齐性检验,方差齐者采用t检验;计数资料以率来表示,采用χ2检验。所有统计结果均以P<0.05为差异具有统计学意义。
2 结 果
2.1 两组患者ESD术前基本资料
ESD 1组与ESD 2组在性别(P=0.535)、年龄(P=0.390)、食管病变部位(P=0.690)、食管病变长度(P=0.664)、食管病变环周面积(P=0.649)、食管病变放大胃镜分型(P=0.907)及食管病变术前病理类型(P=0.971)等方面基本构成一致,差异均无统计学意义(表1)。
ESD 1组病例进展期HNC包括下咽癌14例,口咽癌3例,口腔癌3例,喉癌1例(包括多重癌患者)。ESD 1组19例病例中17例先行HNC治疗,2例先行食管ESD治疗。17例病例的治疗方式包括:根治性放化疗12例、外科手术联合放化疗2例及根治性外科手术3例(表2)。

表1 两组患者基本临床资料比较
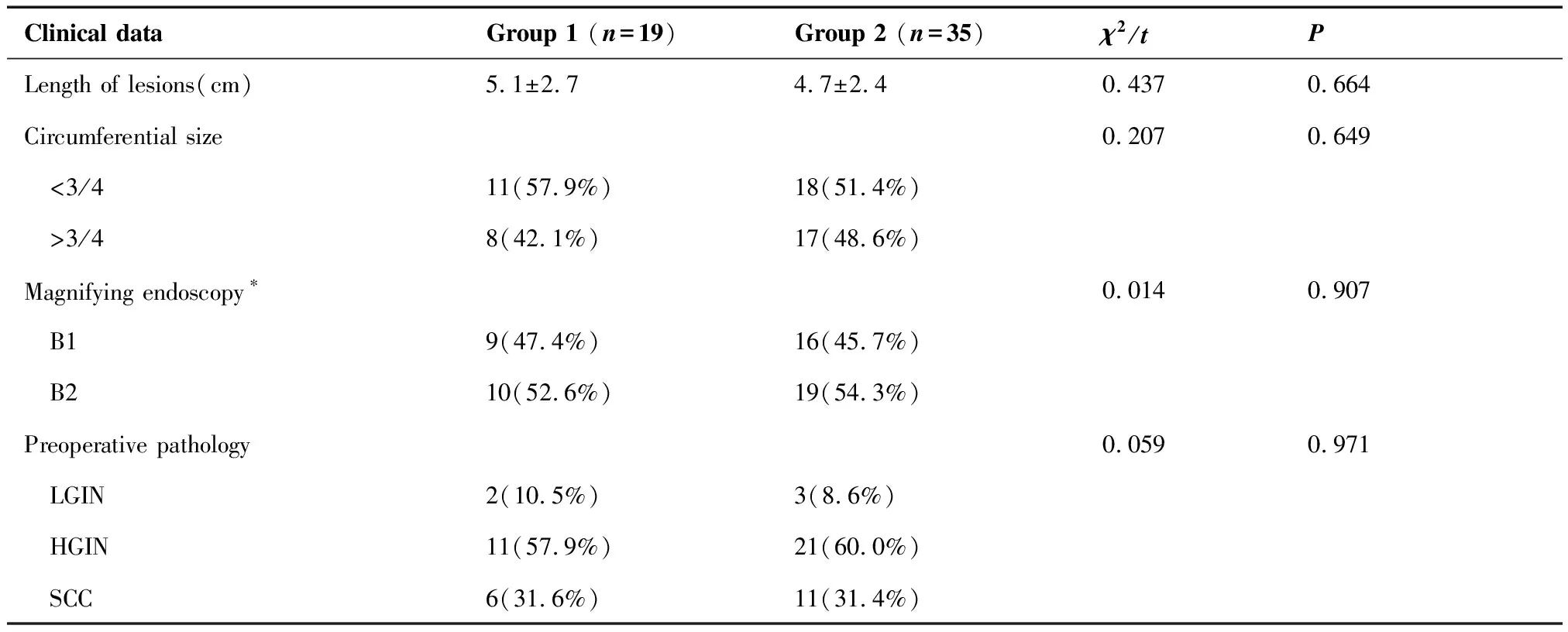
Clinical dataGroup 1 (n=19)Group 2 (n=35)χ2/tPLength of lesions(cm)5.1±2.74.7±2.40.4370.664Circumferential size0.2070.649 <3/411(57.9%)18(51.4%) >3/48(42.1%)17(48.6%)Magnifying endoscopy∗0.0140.907 B19(47.4%)16(45.7%) B210(52.6%)19(54.3%)Preoperative pathology 0.0590.971 LGIN2(10.5%)3(8.6%) HGIN11(57.9%)21(60.0%) SCC6(31.6%)11(31.4%)

表2 ESD 1组HNC的临床治疗方式
2.2 两组患者ESD术后围手术期结果
两组患者均顺利完成食管ESD手术,均无麻醉意外、大出血及食管穿孔发生。ESD 1组与ESD 2组在食管固有肌层损伤率[15.8%(3/19)vs14.3%(5/35),P=0.882]、ESD手术时间[(71.4±39.4)minvs(67.8±32.3)min,P=0.718]、ESD术后住院时间[(4.8±2.1)dvs(4.4±1.7)d,P=0.465]、ESD术后并发症发生率[15.8%(3/19)vs11.4%(4/35),P=0.975]、食管病变病理类型(P=0.958)、食管病变侵犯深度(P=0.964)及食管病变治愈性切除率[73.7%(14/19)vs80.0%(28/35),P=0.849]等方面的差异均无统计学意义(表3)。
ESD 1组19例病例中17例先行进展期HNC治疗,再行食管ESD治疗,术后获得治愈性切除13例,非治愈性切除 4例,ESD病理结果表现为垂直切缘阳性、低分化、脉管浸润阳性及黏膜下浸润深度≥200 μm,4例非治愈性切除病例HNC确诊时间至ESD手术时间1~16月。19例病例中2例先行食管ESD治疗,再行HNC治疗,术后获得治愈性切除1例,非治愈性切除1例,ESD病理结果显示为垂直切缘阳性,本例非治愈性切除病例HNC确诊时间至ESD手术时间1月。本组19例病例术后病理证实低级别上皮内瘤变2例,高级别上皮内瘤变7例,鳞癌10例(表3、4)。
ESD 2组直接行ESD治疗,术后获得治愈性切除31例,非治愈性切除4例,ESD病理结果表现为垂直切缘阳性、脉管浸润阳性及黏膜下浸润深度≥200 μm。本组35例病例术后病理证实低级别上皮内瘤变3例,高级别上皮内瘤变14例,鳞癌18例(表3)。

表3 两组患者围手术期临床资料比较
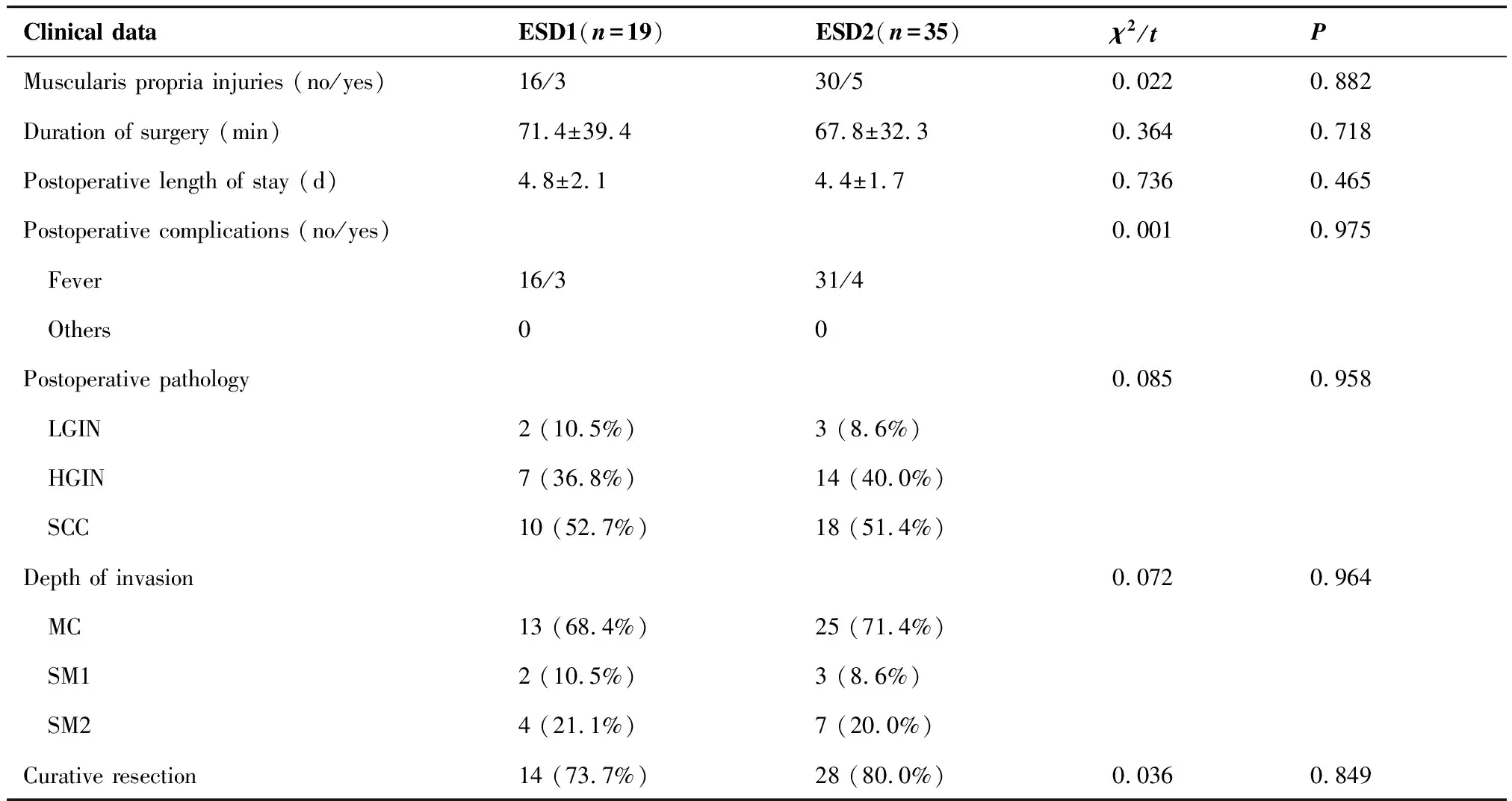
Clinical dataESD1(n=19)ESD2(n=35)χ2/tPMuscularis propria injuries (no/yes)16/330/50.0220.882Duration of surgery (min)71.4±39.467.8±32.30.3640.718Postoperative length of stay (d)4.8±2.14.4±1.70.7360.465Postoperative complications (no/yes)0.0010.975 Fever16/331/4 Others00Postoperative pathology0.0850.958 LGIN2 (10.5%)3 (8.6%) HGIN7 (36.8%)14 (40.0%) SCC10 (52.7%)18 (51.4%)Depth of invasion 0.0720.964 MC13 (68.4%)25 (71.4%) SM12 (10.5%)3 (8.6%) SM24 (21.1%)7 (20.0%)Curative resection14 (73.7%)28 (80.0%)0.0360.849

表4 ESD 1组食管黏膜病变临床治疗情况
2.3 两组患者ESD术后随访结果
两组患者随访两年,ESD 1组随访期内9例死亡,包括5例死于下咽癌复发,1例死于喉癌复发,1例死于口腔癌复发,1例死于进展期颈段食管癌放化疗后复发,1例死于肺部感染。ESD 1组患者1年存活率73.7%(14/19),2年存活率52.6%(10/19)。ESD 2组随访期内1例死于食管癌ESD术后复发,全身多处转移。ESD 2组患者1年存活率100.0%(35/35),2年存活率97.1%(34/35)。
3 讨 论
HNC是常见的恶性肿瘤之一,可伴发同时性第二原发癌,其中下咽癌伴发第二原发癌的风险最高,部位主要位于食管,本研究19例食管黏膜病变合并HNC,其中14例为下咽癌,与文献报道一致[10-11]。因此,对于HNC患者,临床医师应该增强多原发癌意识,安排患者及时行上消化道内镜检查,减少食管病变的漏诊率。对于进展期的食管癌上消化道内镜筛查时不易漏诊,而对于早期食管癌及癌前病变因普通白光内镜下常无特征性表现,容易造成漏诊。目前,电子染色内镜及色素内镜是临床常用的可明显提高早期食管癌检出率的技术。NBI已广泛应用于临床,其对早期食管癌的诊断价值已得到公认[12]。利用NBI结合放大内镜尚可观察食管上皮乳头内毛细血管袢和黏膜微细结构,有助于确定病变的性质及浸润深度,已成为早期食管癌内镜精查的重要手段[13]。此外,因正常鳞状上皮细胞内富含糖原,遇碘可变成深棕色,而早期食管癌及癌前病变细胞内糖原含量减少,甚至消失,呈现不同程度的不染色区或淡染区,从而可显示病变的部位及范围。因此,指南推荐白光内镜检查联合卢戈液染色内镜或NBI作为食管癌及癌前病变的筛查方法,可明显提高早期食管癌及癌前病变的检出率[14-15]。
食管病变合并HNC的临床处理较为棘手,没有统一的标准方案。临床治疗中通常以分期更晚的肿瘤为主线治疗,即一期先临床治疗HNC,二期再治疗食管病变[3]。本研究19例合并病例有17例一期先行HNC治疗,二期行食管内镜下治疗,ESD术后病理结果显示非治愈性切除4例,非治愈性切除病例HNC确诊时间至ESD手术时间最长者达16月,食管病变确诊及ESD手术的延误是造成非治愈性内镜切除的重要原因。临床实践中,HNC治疗周期往往较长,而食管黏膜病变内镜下微创手术治疗恢复迅速,故对于经内镜精细评估及病理活检证实处在相对适应症的食管黏膜病变,可由MDT团队讨论,在临床情况允许及预估远期生存结果良好的情况下先行内镜手术,二期行HNC治疗,此种方案的优点在于一方面可避免食管黏膜病变在HNC治疗期间继续进展,失去内镜下根治的机会,另一方面,即使内镜术后的食管黏膜病变病理显示为非治愈性切除,需要后续追加治疗,也可在制定HNC治疗计划时予以充分考虑,对HNC及食管病变进行同步治疗。对于经内镜精细评估及病理活检证实处在绝对适应症的食管黏膜病变,则可先行HNC的综合治疗,待头颈部肿瘤完全消退后再由MDT团队讨论二期行食管ESD治疗,重点评估HNC的手术获益、远期生存结果及食管ESD的治疗价值。本研究19例食管黏膜病变合并HNC,2例一期接受ESD治疗,二期行头颈部恶性肿瘤治疗,术后病理结果显示治愈性切除1例,非治愈性切除1例,造成非治愈性ESD的原因在于HNC及食管黏膜病变确诊太晚,而不在于HNC治疗所造成的时间延误。因此,在临床工作中,可组建MDT团队,发挥多学科的资源优势,为患者制定最适合的整体治疗策略,以期最大幅度延长患者的生存期,提高生活质量[16]。同时,MDT团队还应根据最新临床证据及临床疗效,及时修正更新诊治策略,不断丰富治疗经验。本研究ESD 1组19例病例中17例一期先行HNC治疗,二期行ESD手术治疗,术后病理结果显示非治愈性切除4例,这与早期MDT团队治疗经验不足有关。
本研究ESD 1组有2例病例先行食管ESD治疗,分别为1例下咽癌和1例下咽癌合并口咽癌患者,此种情况麻醉时应选择支气管镜或可视喉镜引导下气管插管,同时,内镜插入时亦需要仔细辨别食管入口,避免直接触碰咽喉部肿瘤导致术中出血,影响手术视野。此外,ESD 1组有17例病例一期先行HNC治疗,HNC的主要治疗手段包括放疗、化疗及外科手术,经外科手术或放化疗后导致口腔及咽喉解剖结构发生变化,不可避免会对食管ESD手术造成一定的困难。本组3例口腔癌患者,2例因口腔癌手术、放化疗造成张口受限,影响麻醉的实施及内镜操作,1例患者使用了开口器,扩大张口直径,并行支气管镜引导下气管插管,顺利经口置入了气管插管及内镜,另外1例患者使用儿童型气管插管经鼻腔行气管插管,减少了气管插管及内镜同时经口操作的相互干扰。本组2例患者行下咽癌外科手术,导致下咽解剖结构部分发生改变,1例因喉癌行全喉切除手术,导致喉部解剖结构消失,影响镜下食管入口的辨认及内镜插入,此种情况应仔细了解外科手术方式,内镜下仔细观察咽喉解剖情况,循腔进镜,避免黏膜损伤。本组10例患者行下咽癌放化疗治疗,造成下咽部黏膜不同程度的瘢痕样改变,影响内镜的插入及操作,其中2例患者发生食管入口狭窄,常规治疗型内镜无法插入,ESD术前先行食管扩张术,最终顺利插入内镜手术。本研究ESD 1组患者均顺利完成手术,无麻醉意外,无术中大出血、穿孔等并发症发生,且与对照组比较在手术时间、固有肌层损伤率、术后住院时间及术后并发症发生率方面的差异均无统计学意义,表明早期食管癌及癌前病变合并HNC行ESD在技术上安全可行,可取得与常规食管ESD手术相似的围手术期结果。
有研究表明进展期HNC出现食管第二原发癌的远期生存要明显差于未出现食管第二原发癌者,并且伴有早期食管癌的生存时间要明显好于伴有进展期食管癌患者[17]。对于早期食管癌及癌前病变合并进展期HNC的治疗,HNC通常需要采用综合性治疗,食管黏膜病变则可单纯行内镜下切除治疗[18-19]。早期食管癌通常经内镜下微创手术治疗即可根治,且具有创伤小、恢复快及生活质量高等优势,5年生存率可超过95%[20]。本研究ESD 1组患者随访期内死亡9例,其中7例死于HNC治疗后复发,1例死于进展期食管癌治疗后复发,1例死于肺部感染,无早期食管癌ESD手术相关性死亡病例发生,可见ESD治疗此类患者的远期治疗效果主要取决于HNC的恶性程度及远期治疗效果,而不取决于食管黏膜病变。此外,ESD 1组患者1年生存率73.7%,2年生存率52.6%,近半数患者死于ESD术后2年内,术后生存结果欠佳,而ESD 2组1年生存率100.0%,2年生存率97.1%,术后生存结果明显优于ESD 1组,故ESD对于食管黏膜病变合并HNC患者的内镜治疗价值仍需要进一步的研究,或许ESD应用于选择性的HNC患者可能远期生存效果较好,对于如何合理的筛选合并HNC的早期食管黏膜病变行内镜下治疗亦需要进一步的研究。
综上,早期食管癌及癌前病变伴发HNC的风险较高,临床工作中应该予以重视,避免延误诊断。对于HNC患者,推荐行上消化道内镜检查,利于早期发现食管黏膜病变,对后续治疗具有重要意义。食管黏膜病变合并HNC行ESD在技术上安全可行,但术后生存结果欠理想,需要进一步研究其应用价值,在临床工作中也需要慎重选择此类患者行ESD手术治疗。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

