中性粒细胞通过分泌ATX激活整合素β3促进肺癌细胞转移*
张英楠,姚圣城,郭雯雯,史凌云,吴小进
221000 江苏 徐州,徐州市第一人民医院 肿瘤中心放疗科(张英楠、郭雯雯、史凌云、吴小进);221000 江苏 徐州,徐州医科大学附属医院 骨科(姚圣城)
我国肺癌发生率和死亡率居高不下,已成为恶性肿瘤之首,是我国重大的公共卫生问题和巨大的社会负担。肺癌也已超越肝癌成为死亡率最高的恶性肿瘤[1]。肺癌的治疗手段不断进步,从手术治疗、化疗、放疗、免疫治疗到多种疗法联合应用[2],虽然取得一定的成效,但总体效果仍不令人满意。因此,从根本上探明肺癌的发病机理具有十分重要的理论和现实意义。
导致肺癌患者死亡的多数原因是癌细胞远处器官转移,例如脑转移、骨转移等。由各种细胞和非细胞因素组成的肿瘤微环境在癌症转移中起着重要作用[3-4]。在肺癌组织中有大量的炎症细胞浸润,如中性粒细胞、巨噬细胞等[5]。中性粒细胞是多形核细胞,约占白细胞总数的50%~70%,是机体固有免疫的重要组成部分。作为参与炎症反应的重要细胞,近年来肿瘤相关中性粒细胞在肿瘤发生发展中的作用被研究者广泛关注[6]。在癌症微环境中,中性粒细胞可以通过产生抗肿瘤因子,如NO、H2O2和TSP-1来抑制肿瘤的发展[7-9],但更多的报道是中性粒细胞作为肿瘤的帮凶,通过调节肿瘤的生存和迁移、免疫反应和血管生成来促进癌症的发展和转移[10-14]。中性粒细胞促进肺癌转移的作用机理尚不清楚,进一步研究揭示中性粒细胞促进肺癌转移的分子机制具有重要的临床意义。
自分泌运动因子(autotaxin,ATX)又称外核苷酸焦磷酸酶/磷酸二酯酶家族成员2(ectonucleotide pyrophosphatase/phosphodiesterase family member 2,ENPP2),具有磷脂酶D (phospholipases D,PLD)活性,能够催化溶血磷脂酰胆碱(lysophosphatidylcholine,LPC)向溶血磷脂酸(lysophosphatidic acid,LPA)的转化。LPA通过细胞膜上的LPA受体激活细胞内的G蛋白及其下游信号通路,从而促进淋巴细胞的迁移[15]和多种肿瘤细胞的运动[16-18]。迄今为止的大多数研究都集中在针对ATX-LPA受体轴来治疗各种炎症相关疾病,但最近的研究指出,ATX不仅有磷脂酶的作用,还作为免疫细胞的一种外分泌的功能蛋白,以自分泌或旁分泌方式直接与靶细胞表面的整合素相互作用来调节其他细胞的功能[19]。肺癌组织中有大量中性粒细胞浸润,同时中性粒细胞作为ATX的主要来源之一,是否调控肺癌细胞的转移仍不清楚。
本研究发现肺癌细胞促进中性粒细胞ATX的合成与分泌,进一步中性粒细胞来源的ATX与肺癌细胞整合素β3相结合从而激活下游SRC信号通路,增强了肺癌细胞的侵袭与迁移能力,本研究初步探讨了中性粒细胞促进肺癌转移的新机制,并尝试为肺癌临床治疗提供了新靶点及策略。
1 材料和方法
1.1 材料
中性粒细胞由HL-60细胞系(购买自ATCC公司)加含有1.3% 二甲基亚砜的完全培养基诱导5~7天分化形成[20];A549和H1299肺癌细胞系购买自ATCC公司、液氮冷冻保存;Transwell小室购买自美国Corning公司;ATX一抗、整合素β3一抗、Protein A/G beads购买自美国Santa cruz公司;SRC一抗、p-SRC一抗、β-Actin一抗购买自美国CST公司;ATX ELISA试剂盒购买自Cloud-Clone公司;DMEM培养基、1640培养基购自Gibco公司;胎牛血清购自Thermo公司。
1.2 Transwell实验
侵袭实验:提前在超净台中将Transwell小室底层均匀铺上Matrigel胶(用培养基稀释终浓度为0.8 mg/mL),放入培养箱5 h;胰酶消化肺癌细胞,PBS清洗2遍,细胞计数后用无血清培养基重悬细胞(1×105/mL);中性粒细胞制备同前,PBS清洗2遍,细胞计数后用无血清培养基重悬细胞(1×107/mL);24孔板底部加入600 μL中性粒细胞悬液,预铺Matrigel胶的小室加入100 μL肺癌细胞悬液,小室放入24孔板,放入培养箱中培养;12 h后,用镊子小心取出小室,吸净上室液体,移到加入600 μL甲醇的孔中,室温固定30 min,下室中性粒细胞悬液2 000 rpm离心10 min,上清及细胞放-80℃冰箱备用;小心取出小室,吸净上室液体,移到加入500 μL结晶紫的孔中,室温染色20 min;取出小室,吸净上室液体,用湿棉签小心擦去上室底部膜表面上的细胞,用室温PBS清洗数次;Transwell小室底面朝上,自然晾干后于显微镜下拍照;显微镜下取5个随机视野拍照,ImageJ软件计数,统计结果。迁移实验步骤同侵袭实验,但是小室不铺Matrigel胶。
1.3 Western blot实验
收集活化后中性粒细胞或共培养后肺癌细胞,用含有蛋白酶抑制剂(1%)及苯甲基磺酰氟(1%)的RIPA裂解液冰上裂解30 min,提取总蛋白,测蛋白浓度,浓度一致后加入Loading buffer;SDS-PAGE凝胶电泳;转膜后一抗4℃孵育过夜;次日孵育二抗;化学发光法显色;ImageJ软件灰度分析。
1.4 免疫共沉淀(Co-Immunoprecipitation,CO-IP)实验
共培养后收集肺癌细胞A549和H1299,RIPA冰上裂解30 min提取总蛋白;各组取出50 μL作为In-put组;余下部分分别加入等量整合素β3抗体,同源Normal IgG;4℃慢摇8 h;加入30 μL Protein A/G agarose beads,颠倒混匀,4℃慢摇过夜;1 000 g,4 ℃,离心5 min,弃上清,加入1×RIPA裂解液1 mL,重复以上步骤,洗涤4~5次;加入50 μL 2×SDS-PAGE Loading buffer蛋白上样液,100℃加热10 min,进行Western Blot实验,一抗孵育整合素β3和ATX。
1.5 ATX浓度测定
收集上述共培养活化上清,利用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)测定ATX浓度,具体方法参照试剂盒说明书提供的检测步骤。
1.6 统计学分析
数据使用GraphPad Prism 7.0统计软件处理,计量资料以均数±标准误表示,两组间比较采用独立样本t检验;P<0.05认为差异有统计学意义。
2 结 果
2.1 中性粒细胞促进肺癌细胞侵袭与迁移
为了验证中性粒细胞是否促进肺癌细胞转移,我们利用Transwell实验检测肺癌细胞的侵袭(小室预铺Matrigel胶过夜)与迁移能力,肺癌细胞A549或H1299接种于Transwell上室,中性粒细胞接种于下室,对照组不接种中性粒细胞,12 h后对穿过的肺癌细胞进行固定染色并计数,图1A结果显示,在侵袭实验中共培养组A549通过小室的细胞数为(117.4±4.0)个,对照未培养组通过的细胞数为(83.6±5.2)个;迁移试验中共培养组A549通过小室的细胞数为(123.0±9.2)个,对照未培养组通过的细胞数为(88.0±9.7)个;图1B结果显示,在侵袭实验中共培养组H1299通过小室的细胞数为(145.8±21.8)个,对照未共培养组通过的细胞数为(81.8±6.9)个,迁移试验中共培养组A549通过小室的细胞数为(265.0±13.4)个,对照未共培养组通过的细胞数为(142.6±8.8)个,结果有统计学意义(均P<0.05)。以上结果说明中性粒细胞显著增强肺癌细胞侵袭与迁移的能力。
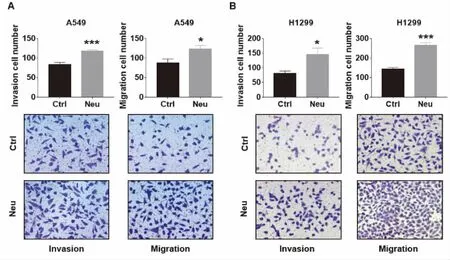
图1 中性粒细胞促进肺癌细胞侵袭与迁移
2.2 肺癌细胞促进中性粒细胞ATX合成与分泌
进一步,为了探究中性粒细胞促进肺癌细胞侵袭与迁移能力的原因,我们在6孔板中将肺癌细胞与中性粒细胞共培养4 h,离心收集活化的中性粒细胞与上清。Western blot结果显示,肺癌细胞激活中性粒细胞后,中性粒细胞ATX表达显著升高(图2)。因为ATX可以作为分泌蛋白在胞外发挥生物学效应,所以我们利用ELISA检测后发现,共培养后ATX的水平显著升高(图2C和2D)。以上结果表明肺癌细胞激活中性粒细胞可以使中性粒细胞ATX产生和分泌增加。

图2 肺癌促进中性粒细胞ATX合成与分泌
2.3 中性粒细胞通过ATX促进肺癌细胞侵袭与迁移
中性粒细胞是否通过分泌的ATX促进肺癌细胞侵袭与迁移呢?进一步,我们首先用ATX特异性抑制剂HA130孵育中性粒细胞,Western blot验证抑制效率(图3A),然后再进行Transwell试验。图3B结果显示,在侵袭实验中HA130组A549通过小室的细胞数为(68.4±5.1)个,对照组通过的细胞数为(135.8±6.4)个;在迁移试验中HA130组A549通过小室的细胞数为(118.6±4.0)个,对照组通过的细胞数为(170.8±6.4)个;图3C结果显示,在侵袭实验中HA130组H1299通过小室的细胞数为(42.0±2.4)个,对照组通过的细胞数为(66.6±7.0)个,在迁移试验中HA130组H1299通过小室的细胞数为(64.6±6.4)个,对照组通过的细胞数为(85.6±4.5)个,结果有统计学意义(均P<0.01)。以上结果说明中性粒细胞通过ATX的分泌促进肺癌细胞侵袭与迁移。
2.4 ATX与整合素β3结合激活肺癌细胞SRC通路
已有研究报道,ATX的N端SMB结构域可与血小板和中国仓鼠卵巢细胞(Chinese hamster ovary cell,CHO)的整合素αIIbβ3相结合进而激活下游信号通路增强靶细胞的迁移能力[21],而肺癌细胞表面整合素β3的活化在肺癌的转移过程中发挥重要的调控作用[22]。因此,我们推测中性粒细胞分泌的ATX可以与肺癌细胞表面整合素β3结合,CO-IP实验结果显示,肺癌细胞A549或H1299在与中性粒细胞共培养后,整合素β3与ATX发生蛋白与蛋白相互结合,而未培养对照组则没有结合(图4A)。进一步,图4B和图4C结果显示,肺癌细胞A549或H1299在与中性粒细胞共培养后整合素下游信号SRC磷酸化增强。以上结果表明中性粒细胞分泌的ATX与肺癌细胞整合素β3相互结合激活下游SRC信号通路。

图3 中性粒细胞通过ATX促进肺癌细胞侵袭与迁移

图4 ATX与整合素β3结合激活肺癌细胞SRC通路
综上,肺癌细胞激活中性粒细胞促进中性粒细胞ATX分泌,ATX与肺癌细胞整合素相互结合激活下游SRC信号通路,进而促进增强肺癌细胞的侵袭与迁移能力。
3 讨 论
除了传统的手术、放化疗等治疗方式外,目前新兴的靶向及免疫治疗也为肺癌治疗提供了新的手段,但是肺癌患者的总体治疗效果仍不尽人意,其中导致肺癌患者治疗失败及死亡的主要原因仍是肺癌细胞的远处转移[23]。揭示肺癌细胞转移的分子机理具有重要的理论意义及现实意义。本研究首次发现中性粒细胞通过分泌ATX与肺癌细胞整合素β3结合进而激活下游SRC信号,增强肺癌细胞的侵袭与迁移能力,ATX抑制剂HA130能够有效反转中性粒细胞促进的肺癌细胞侵袭与迁移,或可为肺癌患者临床抗转移治疗提供了新的靶点及策略。
肿瘤逐渐被人们认为是一种慢性炎症性疾病,中性粒细胞作为固有免疫的一线细胞,一些研究已经表明肿瘤微环境浸润的中性粒细胞促进癌细胞增殖、迁移和侵袭。肿瘤浸润中性粒细胞活化后通过分泌IL-8、IL-17、Arginase I等抑制机体免疫反应促进肿瘤进展[24-25],同时还可以分泌基质金属蛋白酶MMP-9、MMP-13等促进癌细胞外基质降解从而促进癌细胞转移[26-27]。研究发现,中性粒细胞可以早于肿瘤细胞在肺部聚集,形成早期转移灶,靶向敲除中性粒细胞可以减少肿瘤肺转移[28]。在肺癌移植瘤模型中,高中性粒细胞浸润释放过多的G-CSF从而引起前动力蛋白2(Bv8)增多,促进中性粒细胞活化并且促进血管生成,抑制Bv8的表达能够减少中性粒细胞肿瘤浸润,进而降低肺癌血管生成和增殖能力[29]。但是肿瘤浸润中性粒细胞是否会直接增强肺癌细胞的运动能力尚缺乏报道,我们的研究证明肺癌细胞可以直接激活中性粒细胞,并且活化的中性粒细胞可以分泌ATX促进肺癌细胞侵袭与迁移,ATX抑制剂HA130可以显著反转中性粒细胞的促肺癌转移能力(图1)。进一步机制研究发现ATX可以与肺癌细胞整合素β3结合,导致整合素下游SRC磷酸化的增加(图4),进而直接增强肺癌细胞的运动能力,最终导致肺癌的远处转移。
研究表明ATX不仅有磷脂酶的作用,还作为分泌蛋白,以自分泌或旁分泌方式直接与靶细胞表面的整合素相互作用来调节其他细胞的生物功能[19]。与报道一致的是,我们研究发现肺癌细胞的确可以促进中性粒细胞的ATX蛋白合成与分泌(图2)。但是ATX是通过怎样的途径调控肺癌细胞转移的呢?ATX蛋白N端SMB结构域可与血小板和CHO细胞的整合素αIIbβ3相结合进而激活下游信号通路增强靶细胞的迁移能力[21],同时整合素β3参与肺癌细胞运动调控[22]。CO-IP实验证实ATX可以直接与整合素β3结合,说明肿瘤浸润中性粒细胞来源的ATX通过自分泌或旁分泌的调控肺癌细胞转移。这一机制对进一步阐明中性粒细胞促进肺癌转移的分子机制具有一定意义。
肿瘤患者自身免疫能力较差,常伴随感染等风险,因此完全靶向消除中性粒细胞可能对患者本身的免疫功能造成一定负面影响[30],这一问题不容忽视且需要进一步研究,因此基于文献报道和我们的研究结果,可以考虑靶向肿瘤特异性中性粒细胞ATX基因的肺癌治疗策略,减弱中性粒细胞对肺癌细胞转移的促进作用,从而达到减弱中性粒细胞促进肺癌进展的治疗目的。
综上所述,中性粒细胞通过ATX调控整合素β3促进肺癌细胞发生转移,ATX抑制剂HA130显著减弱中性粒细胞对肺癌细胞转移的促进作用。为进一步研究中性粒细胞与肺癌之间的关系及ATX的功能具有一定的指导意义。靶向中性粒细胞ATX基因可能为肺癌患者临床治疗提供新的思路。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

