机器人辅助后腹腔入路肾部分切除术治疗cT1a期完全内生型肾肿瘤的有效性和安全性研究
高学林,郑万祥,苏醒,马帅军,张龙龙,王福利,杨晓剑,袁建林
710032 西安, 空军军医大学附属西京医院 泌尿外科
肾细胞癌(renal cell carcinoma,RCC)是泌尿系统常见恶性肿瘤,占全身恶性肿瘤总数的2.2%,死亡率占1.8%[1]。随着健康意识提高,越来越多的无症状肾肿瘤通过B超或/和CT检查发现,临床诊断为局限性肾肿瘤。2019年,《中国泌尿外科和男科疾病诊断治疗指南》指出外生型cT1a期肾肿瘤手术治疗建议行保留肾单位手术(nephron sparing surgery,NSS)[2]。现在,cT1a期外生型肾肿瘤行后腹腔镜下肾部分切除术已成为主流术式[3],但对于cT1a期完全内生型肾肿瘤,因无肿瘤组织突出肾表面,无法确定肿瘤位置,腹腔镜下NSS困难,曾以腹腔镜下根治性肾切除术,或开放触摸和/或B超辅助下行肾部分切除术为主。近年来,随着机器人手术系统这一新技术的出现,渐有微创切除完全内生型肾肿瘤报道,使完全内生型肾肿瘤达到精准切除,同时最大限度地保留肾单位,增加了患者的长期获益。目前,关于机器人技术联合腔内B超治疗完全内生型肾肿瘤的报道较少。因此,笔者回顾性分析了本科室23例联合腔内B超机器人辅助后腹腔入路肾部分切除术治疗的cT1a期完全内生型肾肿瘤患者的临床资料,并以同期的cT1a期外生型肾肿瘤经机器人辅助后腹腔入路肾部分切除术治疗的40例患者作为对照组,若机器人辅助后腹腔入路治疗cT1a期完全内生型肾肿瘤的安全性和有效性不亚于近标准术式的机器人辅助后腹腔入路治疗cT1a期外生型肾肿瘤,则表明机器人辅助后腹腔入路肾部分切除术治疗完全内生型肾肿瘤安全可行。
1 资料与方法
1.1 一般资料
收集2016年4月至2019年4月空军军医大学附属西京医院泌尿外科收治的23例联合腔内B超机器人辅助后腹腔入路肾部分切除术治疗的cT1a期完全内生型肾肿瘤患者的一般资料,同期机器人辅助后腹腔入路肾部分切除术治疗cT1a期外生型肾肿瘤40例患者作对照组。
1.2 纳入和排除标准
纳入标准:1)CT提示肾肿瘤大小≤4 cm;2)单发、单侧肿瘤,无远处转移。排除标准:1)CT提示肾肿瘤大小>4 cm;2)多发、双侧肿瘤;3)肾盂、肾窦肿瘤;4)有心脑肺、凝血障碍等全身疾病,无法耐受手术者。
1.3 手术方法
术前所有患者均完善术前检查,泌尿系CT平扫+增强+肾动脉血管成像、肾动态检查,临床诊断为肾肿瘤,分期cT1a。向患者和/或家属告知病情,签署手术知情同意书。两组手术操作均由同一个医师完成,避免因不同医师手术熟练程度不同而导致的结果差异。
全麻满意后,患者取健侧折刀位(右侧为例)。完全内生型组行联合腔内B超机器人辅助后腹腔入路肾部分切除术:于髂脊上约3 cm做12 mm Trocar镜头孔、腋后线12肋缘下2 cm做机器人1臂专用8 mm Trocar孔,腋前线肋缘下2 cm做机器人2臂专用8 mm Trocar孔,于髂前上棘外上8 cm做12 mm 辅助Trocar孔。注入无菌CO2,维持腹膜后压力为13 mmHg,将达芬奇机械操作臂套无菌操作套后移入手术区,将镜头、单极剪、双极电凝与相应的机械臂连接。助手通过辅助孔置入辅助器械协助手术。解剖出肾动脉待用。审阅CT片(图1)了解完全内生型肿瘤在肾表面投影区,充分游离肾脏后,自辅助孔置入腔内B超探头于投影区(图2、3),定位肿瘤位置、大小、距肾表面皮质最薄距离、距肾集合系统距离、有无滋养血管,可操作超声探头摆动或术中翻转肾脏协助精确定位。设计好切除途径后无损伤肾蒂钳阻断肾动脉,锐性+钝性切除肾肿瘤(图4~6),用2-0鱼骨线连续缝合肾实质止血,腔隙较大者,可填塞止血材料或行切缘锁边缝合[4]。若肾集合系统破损,用3-0可吸收线缝合集合系统。松开肾蒂钳,记录热缺血时间。取出肿瘤,留置引流管。外生型肿瘤组行机器人辅助后腹腔入路肾部分切除术,打孔位置及手术操作基本同前,省去术中超声定位步骤。
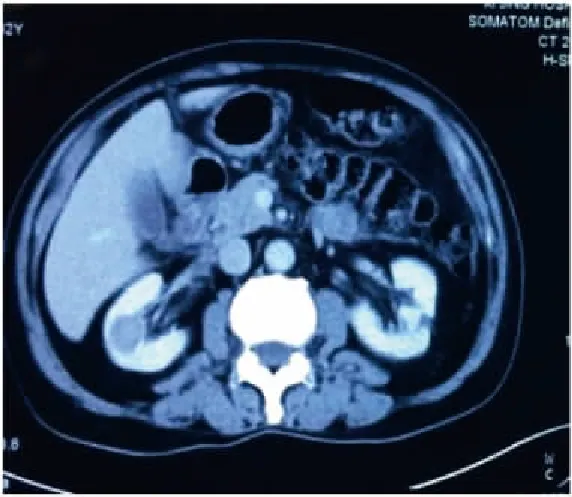
图1 术前内生型肾肿瘤CT片
1.4 观察指标
包括中山评分、手术时间、术中出血量、热缺血时间(指从肾动脉阻断到开放时间)、中转肾切例数(指术中中转腹腔镜肾根治性切除患者例数)、切缘阳性率、估算肾小球滤过率(estimation of glomerular filtration rate,eGFR)、术后引流管带管时间、术后住院天数、术后出血例数(指术后出血需外科干预例数)及术后漏尿例数。

图2 术中腔内B超定位内生型肾肿瘤
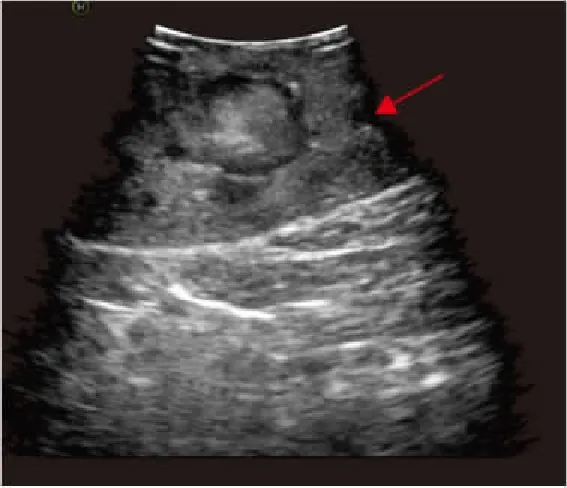
图3 内生型肾肿瘤术中B超图像
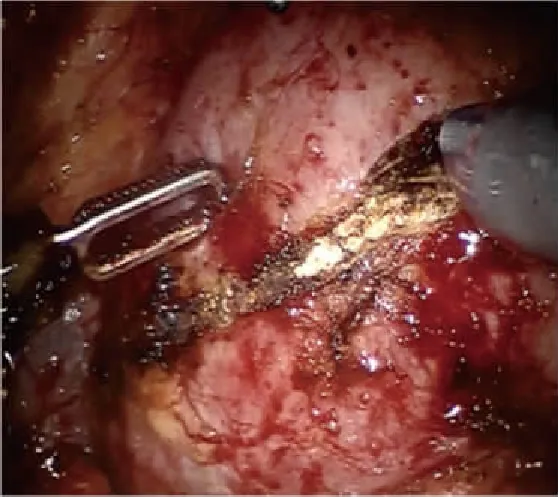
图4 切开内生型肾肿瘤肾实质表面
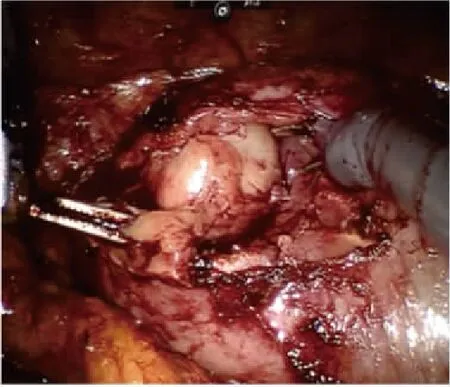
图5 显露内生型肾肿瘤
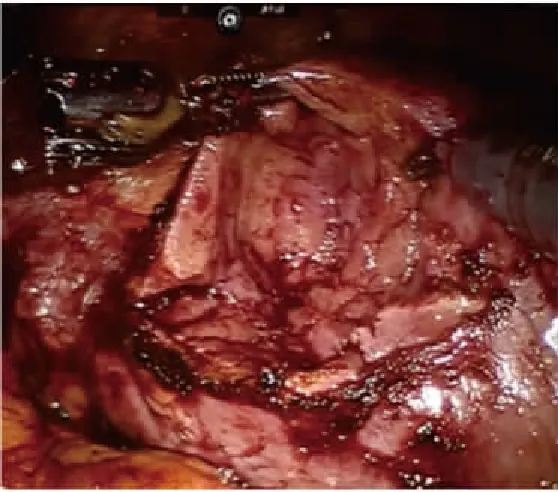
图6 内生型肾肿瘤切除术后创面
1.5 随访
患者门诊随访,复查项目为血尿常规、肾功能离子、泌尿系B超,3月复查一次B超,6月复查一次胸部和泌尿系CT平扫和增强。
1.6 统计方法
用SPSS 21.0软件分析,符合正态分布的定量资料用均数±标准差表示(热缺血时间、术后eGFR),不符合正态分布的定量资料用中位数(范围)表示(中山评分、手术时间、术中出血量、伤口引流管带管时间和术后住院天数),定性资料用例数和百分比(%)表示,定量资料的组间比较采用Mann-Whitney U检验(中山评分、手术时间、术中出血量、伤口引流管带管时间和术后住院天数)或t检验(热缺血时间、术后eGFR),定性资料的组间比较采用χ2检验或Fisher精确概率法,以α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者一般资料比较
两组患者一般情况见表1,入组患者年龄、性别、肿瘤发生侧别以及肿瘤大小的差异均无统计学意义(均P>0.05)。

表1 两组患者一般资料比较
2.2 两组患者观察指标对比
从表2可知,两组患者中山评分(Z=313.00,P=0.024)、手术时间(Z=182.00,P<0.001)和热缺血时间(t=5.04,P<0.001)的差异均有统计学意义;术中出血量、切缘阳性率、术后eGFR、伤口引流管带管时间、术后住院时间及术后漏尿发生率等差异无统计学意义(均P>0.05);完全内生型组有1例因出血多中转根治性肾切除,而完全外生型组无中转例数,但两组发生率差异无统计学意义(P=0.365)。两组患者术中均无手术副损伤、瘤体破裂及残留等情况发生。

表2 两组患者手术及术后情况对比
2.3 随访情况
两组患者中位随访9个月(6~12个月)后,无因创面出血需二次外科干预如介入或肾切除,行CT检查创面局部和远处均无复发和转移,复查肾功能,内生型组术后eGFR同术前基本持平。
3 讨 论
根治性肾切除术是局限性肾肿瘤公认可能治愈的手段[2]。但术后健侧肾高灌注、高压力、高滤过的血流动力学改变可能损伤肾小球,导致部分患者出现肾功能损伤,影响其生活和生存质量[5]。随着技术进步,局限性肾肿瘤的手术方式已由经典的根治性肾切除术逐渐转变为保留肾单位的肾部分切除术,对cT1a期肾肿瘤行NSS,循证医学已证明两种术式预后无明显差异[6]。虽然肾肿瘤行肾部分切除术后切缘阳性可能与术后肿瘤进展相关,但不等同预后不良[7]。因此保留肾单位的肾部分切除术有利于患者远期生活质量[8-9],并可降低肾功能损伤等不良事件的发生。肾部分切除术的核心技术为:1)完整的肿瘤切除;2)精细的创面缝合重建。其中良好的缝合可有效减少术后并发症,如出血和漏尿等。而机器人手术系统具有3D手术视野、灵活的机械臂,有利于术者精细操作,提高肿瘤解剖性切除和精准缝合,增加了NSS成功几率,并缩短了泌尿外科医生的学习周期[10]。本研究中两组患者均成功切除肾肿瘤,术后病理切缘均为阴性。创面缝合后,术后无出血和漏尿需手术干预患者,尤其是完全内生型组。反映了机器人手术切除和缝合的有效性,大大提高了手术的安全性。
完全内生型肾肿瘤能否成功行腹腔镜下NSS,必须满足以下条件:1)术中精准定位肿瘤;2)术中精准切除肿瘤组织;3)缝合重建切除后深大的组织创面。其中术中精确定位是完全内生型肾肿瘤能否精确切除的关键。本科室使用过CT/MRI三维成像、CT导航技术和腔内B超技术等定位方法[11-12],各有利弊。CT/MRI三维成像定位与个人阅片能力和手术经验有关,在实际应用指导手术操作中可能与肿瘤确切位置有偏差,导致选择切口距肿瘤表面垂直距离远或术中肿瘤破裂等,增加副损伤或并发症。CT导航技术是术前患者CT影像学图像信息经计算机专业软件处理后形成的虚拟患肾及肿瘤解剖图像,术中将虚拟患肾与实体患肾相叠加,通过虚拟肾肿瘤位置定位实体肾肿瘤位置,但缺点为价格昂贵、术中实体肾脏位置改变后虚拟图像不可实时变更,不利于术中操作。就定位实用性、性价比及精确度而言,腔内B超是首选[13]。术中将腔内超声探头与肾脏表面接触,可清晰地识别肿瘤位置、肿瘤大小、肿瘤距肾表面和集合系统距离、有无较粗血管分支。另外,超声探头可灵活、多角度、多方位显像测量,并且术中不受调节翻转肾脏位置的影响,可从肾脏不同位置协助定位,为完整切除肿瘤提供参数依据,从而设计肿瘤切除路径,减少出血,缩短热缺血时间,降低切缘阳性率,最大程度地保留肾单位。本研究中通过eGFR来准确的反映肾功能,虽然健康肾会影响eGFR数据,但两组患者均有健康肾,故可排除健康肾所引起的偏倚。完全内生型组患者术后的eGFR数据与近标准术式完全外生型组患者术后eGFR相比,差异无统计学意义(χ2=0.12,P=0.900),说明联合腔内B超的机器人辅助腹腔镜下肾肿瘤部分切除术在保留完全内生型肾肿瘤患者肾单位方面是有效可行的,既完整切除肿瘤,又能最大限度保护肾组织。其中B超准确定位起到关键作用。
中山评分是我国首个肾癌手术相关评分,用于评估NSS的难度和术后并发症,由肿瘤肾内直径、位置和深度三个参数组成,术前审阅泌尿系CT,根据赋值标准赋予三个参数不同分值,相加总和,分值越高手术难度和并发症越多,简单易行[14]。完全内生型肾肿瘤位于肾实质内,肾内直径就是肾肿瘤直径,且位置较深,因此中山评分中肿瘤肾内直径、肿瘤深度两项参数显著高于外生型肾肿瘤。本研究中,两组患者的中山评分差异有统计学意义(P=0.024),反映了完全内生型肿瘤的切除难度高于外生型肿瘤。因为完全内生型肾肿瘤无肿瘤组织突出肾脏表面,腔镜下难以辨别肿瘤位置。并且肾肿瘤位置深,术中创面大、出血多、缝合困难,增大了手术难度,延长了热缺血时间,同时可能增加副损伤和切肾率。本研究中,两组患者的手术时间和热缺血时间差异有统计学意义(均P<0.001),也说明了上述问题。陈暮霖等[15]提出NSS的根本原则是使患者最大获益,术前需充分评估完全内生型肿瘤是否可行NSS,除考虑临床分期外,对于术中可能的肿瘤破裂、残留、或副损伤较大的高风险患者,不建议强行NSS。而完全内生型肾肿瘤腹腔镜下缝合重建受术者经验、镜下视野和器械限制,增加操作难度,延长热缺血时间,一度是腹腔镜下NSS的禁区。
直到先进的机器人辅助腹腔镜技术应用于泌尿系手术,2001年,Guillonneau等[16]首次应用机器人手术系统行肾切除术,2016年,高宇等[17]提出机器人辅助腹腔镜手术适应症可扩展至内生型肾肿瘤治疗。Abdeld等[18]认为机器人辅助腹腔镜下肾部分切除术(robot-assisted retroperitoneal laparoscopic partial nephrectomy,RA-RLPN)治疗完全内生型肾肿瘤安全可行。过菲等[19]称RA-RLPN是治疗内生型肾肿瘤安全可行的微创手术方式。蒋国松和王正等[20-21]称RA-RLPN处理内生型肾肿瘤的近期疗效确切。鉴于上述报道,本科室尝试开展RA-RLPN联合术中腔内B超治疗完全内生型肾肿瘤。其入路方式有腹腔和后腹腔两种方法,各有利弊[22-23]。经腹入路优点为空间大,但缺点为不利于肾动脉显露,术后易发生肠粘连,并且创面渗血和渗尿会流入腹腔,增加腹腔感染率,延长住院时间。而后腹腔入路优点为肾动脉易显露,不干扰腹腔,尽早进食加速了患者术后恢复,缺点为空间小。本科室病例均为后腹腔入路,23例完全内生型肾肿瘤行机器人辅助腹腔镜下NSS成功22例,1例因术中出血行肾切除,表示内生型手术难度和风险系数较外生型高,但肾部分切除成功患者术后肿瘤完整,切缘均为阴性,无出血、漏尿等相关手术并发症,表明该术式安全可行。术后短期随访无局部和远处转移,eGFR基本持平,保留肾功能有效。虽然病例数较少,但也提供了相关经验,为以后更好的开展此类手术奠定基础。
总之,随着机器人手术系统和腔内B超等医工技术的发展,以及腹腔镜手术临床经验的累积。术中使用腔内B超可精准定位完全内生型肾肿瘤,指导机器人手术系统解剖性切除肿瘤,而术后深大的创面,灵活的机械臂可精密缝合。虽然我中心病例数少,结果有一定局限性,但结果显示术中联合腔内B超RA-RLPN治疗完全内生型cT1a期肾肿瘤的安全性和有效性与cT1a外生型肾肿瘤相当,至少为完全内生型肾肿瘤保留肾单位治疗提供了一种新方法。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

