犬细小病毒黑龙江流行株的分离鉴定及其VP2 基因的遗传进化分析
高 艳,张 峣,都兴洋,蒋烈戈,涂亚斌,张兴山,韩 雪,高宏雷1,*
(1.中国农业科学院哈尔滨兽医研究所,黑龙江 哈尔滨 150069;2.哈尔滨维科生物技术有限公司,黑龙江 哈尔滨 150069;3.广东省黄埔海关技术中心,广东 东莞 523000;4.新疆兵团第九师畜牧科学研究所,新疆 额敏 834601;5.哈尔滨市宠兴动物医院,黑龙江 哈尔滨 150001)
犬细小病毒(Canine parvovirus,CPV)是一种能引起犬急性出血性肠炎和非化脓性心肌炎为主要特征的高度传染性和致死性病原,也是2 月龄~6 月龄幼犬消化道疾病的主要病原之一[1]。该病毒于1978年首次从澳大利亚患肠炎的病犬中分离到[2],之后其在世界范围内被陆续报道。CPV 通常与犬瘟热病毒、犬腺病毒及犬冠状病毒混合感染,严重危害我国养犬业及宠物行业的健康发展。CPV 所致疫病一年四季均可发生,以发病急、病程短、传染性强为主要特征[3]。
CPV 属于细小病毒科细小病毒属,病毒粒子无囊膜,呈二十面体结构,直径为20 nm~24 nm,基因组全长约为5 kb[4],包含两个主要的开放式阅读框(ORF),分别编码结构蛋白(VP1、VP2)和非结构蛋白(NS1、NS2),其中VP2 是最丰富的结构蛋白,占病毒衣壳的90%,也是决定病毒抗原性和病毒与宿主相互作用的主要蛋白[5]。VP2 蛋白氨基酸位点的变化对细小病毒的宿主范围有重要影响[6-7]。在该病毒的进化过程中,由于关键氨基酸位点的突变,CPV-2 逐渐分化出CPV-2a、CPV-2b、CPV-2c 亚型[8-9]。
为了研究当前黑龙江省CPV 流行株的变异情况,本研究从经CPV 胶体金试纸鉴定为CPV 阳性的病犬粪便中分离出8 株CPV,对其进行了血凝性和基因分型等鉴定,对8 株分离病毒的VP2 基因做了测序及遗传进化分析,并对其中4 株病毒做了犬的回归试验和2 株强毒株的鉴定试验,以期为该地区的犬细小病毒病的防制提供数据支持。
1 材料与方法
1.1 病料样品、病毒株及细胞系有临床腹泻症状病犬的10 份粪便样品,分别来自黑龙江省哈尔滨市、双城市、鹤岗市和大庆市动物医院的患病犬,经胶体金试纸条检测呈CPV 阳性;CPV YNR 株和猫肾细胞(F81)均由本实验室保存。
1.2 实验动物及主要试剂1 月龄~3 月龄杂交幼犬(经检测CPV 中和抗体效价≤1∶2),购自哈尔滨医科大学实验动物医学部。胎牛血清(FBS)、DMEM 培养基、胰蛋白酶均购自Gibco 公司;东洋纺高保真Taq酶;限制性内切酶及DNA 提取试剂盒均购自TaKaRa 公司。
1.3 引物的设计与合成根据GenBank 登录的CPV全基因组(KR002805.1)VP2 基因保守序列,利用Premier 6.0 软件设计2 对引物,其中一对引物用于扩增CPV VP2 全基因,预期扩增片段长度为2 000 bp,引物序列为V1:5′-CATCCATCAACATCAAGACCAA C-3′/V2:5-TGTATACCATATAACAAACCTTC-3′;另一对引物P1/P2 用于分离CPV 的PCR 鉴定及病毒的分型鉴定,预期扩增片段长度为297 bp,引物序列为P1:5′-CAGGAAGATATCCAGAAGGA-3′/P2:5′-GGTGCTAGTTGATATGTAATAAACA-3′,引物均由哈尔滨睿博兴科生物公司合成。
1.4 病毒的分离和培养取1 g~2 g 粪便样品,用600 μL无菌PBS 溶解稀释,再加3 倍体积的无菌PBS混匀,经1 000 r/min 离心8 min,上清用0.22 μm 无菌滤器过滤除菌并3 倍稀释后,按照10%比例接种F81 细胞悬液,同时设正常细胞对照,置37 ℃、5% CO2培养,逐日观察细胞病变(CPE)情况,盲传5 代,如果出现CPE 则收获细胞培养物均置-80 ℃保存,如传到第5 代仍无CPE 则将样品视为阴性。
1.5 分离病毒的鉴定
1.5.1 分离病毒的TCID50及HA 效价的测定 取粪便样品的第5代细胞与上清的混合培养物,10倍倍比稀释后,接种96 孔板中的F81 细胞悬液,置37 ℃、5%CO2培养,逐日观察CPE,按Reed-Muench法计算分离病毒的TCID50;同时采用微量血凝试验鉴定分离病毒的血凝性[10]。
1.5.2 分离病毒血清型的PCR 鉴定 将第5 代F81细胞培养物反复冻融3 次,提取样品中的总DNA,利用引物P1/P2 经PCR 鉴定。设本实验室保存的CPV YNR株为阳性对照,细胞培养液样品为阴性对照。PCR产物由哈尔滨睿博兴科生物公司测序,分析aa426 和aa440 的氨基酸类型,以确定病毒的基因分型。
1.5.3 分离病毒VP2基因的遗传进化分析 分别以分离病毒提取的总DNA 为模板,利用引物V1/V2 通过PCR 扩增VP2 基因,PCR 扩增条件为:95 ℃30 s;95 ℃30 s;52 ℃30 s,72 ℃30 s,共35 个循环;72 ℃10 min,PCR 产物由哈尔滨睿博兴科生物公司测序。测序结果拼接后利用MEGAX64 软件与Gen-Bank 已登录的CPV 参考株进行比对分析。
1.6 分离病毒的动物回归试验选取14 只未免疫CPV 疫苗的1 月龄~3 月龄杂交幼犬,利用病毒中和试验方法检测幼犬的CPV 母源抗体[11],当幼犬体内CPV 的中和抗体效价≤1∶2 即可用于后续试验。将14只幼犬分为1~4 组,3 只/组和对照组(2 只)。选取致细胞产生严重CPE 的1 株分离病毒和血凝效价较高的3 株分离病毒,1~4 组幼犬分别经口服该4 株CPV 的第5 代细胞培养物、同时经大腿内侧肌肉分3点注射病毒,使病毒的感染剂量达104.5TCID50/犬;对照组2 只幼犬采用相同的方式口服和注射相同剂量的细胞培养液。对照犬和实验犬隔离饲养,每天观察各犬的临床症状、测量体温。于感染后第7 d采肛门拭子,拭子经常规处理后提取上清液中的病毒总DNA 并作为模板,利用引物P1/P2 经PCR 检测犬的排毒情况;根据发病犬临床症状的严重程度确定剖杀各组犬的时间,取其心、肝脏、脾脏、肺脏、肠淋巴结及十二指肠和空肠病料样品,研磨、离心处理后取上清提取各脏器样品的总DNA 并作为模板,利用P1/P2 引物经PCR 检测CPV 在各脏器的分布情况。设本实验室保存的CPV 为阳性对照,细胞培养液为阴性对照。
1.7 分离病毒的强毒鉴定试验按照1.6 的方法监测幼犬体内CPV 的母源抗体,当其体内CPV 的中和抗体效价≤1∶2 即可用于后续试验。将8 只幼犬分为实验A 组(3 只)、实验B 组(3 只)和对照组(2 只),选择动物回归试验中致犬临床症状较典型的2 号犬(感染CX-3 株CPV)和5 号犬(感染CX-5 株CPV)的组织病料样品进行强毒鉴定试验:分别将2 号犬和5 号犬的十二指肠和空肠病料样品研磨混合后离心取上清液,5 mL/犬经口服方式分别感染A 组和B 组犬,对照2 只犬采用相同的方式口服细胞培养液,5 mL/犬。将对照犬和实验犬隔离饲养,每天观察各犬的临床症状、测量体温。并于感染后第7 d 采肛门拭子,采用1.6 的PCR 方法检测犬的排毒情况及CPV 在各组犬各脏器的分布情况。
2 结 果
2.1 病毒的分离和培养10 份病料样品接种F81 细胞后,有两份病料样品接种后的细胞均不贴壁且均破碎死亡,另外8 份病料样品分别在传到第2~5 代时,细胞出现不同程度的CPE,多数细胞在接种后72 h 左右开始出现肿胀、圆缩、凝聚成团,并呈拉网状等(图1),符合CPV 病变特征,初步表明分离到8 株CPV,分别命名为CPV-CX-1(简写为CX-1,其余病毒名称同样简写)~CX-3、CX-5~CX-8、CX-10。

图1 CPV分离株在F81细胞中产生的CPEFig.1 Cytopathic effect induced by canine parvovirus isolates in F81 cells
2.2 CPV 的TCID50及HA 效价的测定结果分别取分离病毒的第5 代培养物, 10 倍倍比稀释后接种细胞,按Reed-Muench 法计算TCID50,结果显示不同分离株在F81 细胞中的增殖也不相同,其中CX-5、CX-10 效价均可达到105.67TCID50/mL(表1);采用微量血凝试验,在96 孔V型板上测定分离的8 株CPV的血凝效价,结果只有CX-1、CX-5、CX-7、CX-10 有不同程度的血凝性(表1)。表明分离到的CPV在F81 细胞中的增殖能力存在差异,其中CX-5、CX-10 在F81 细胞中的增殖能力更强,且8 株分离病毒的血凝性也不一致。
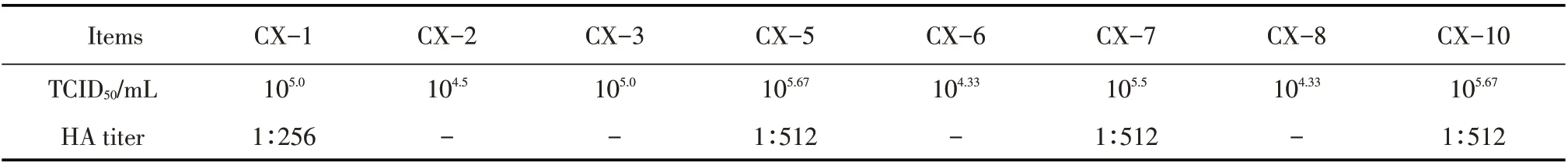
表1 分离CPV的TCID50及HA效价测定结果Table 1 Virus load and hemagglutination assay results
2.3 CPV 的PCR 及基因分型鉴定结果分别将8株分离病毒的第5 代细胞培养物反复冻融3 次后,提取总DNA 作为模板,经PCR 鉴定。结果显示,8株分离病毒均在297 bp 处出现目的条带,与预期结果相符(图2)。进一步表明分离到了8 株CPV。依据aa426 和aa440 分别为N、A 的为2a 型;aa426 和aa440 分别为D、A 的为2b 型;aa426 和aa440 分别为E、T 的为2c 型。扩增的片段经测序并分析后的结果显示,CX-1、CX-5、CX-7、CX-10 均为2a 型,CX-6 为2b 型,其余均为2c 型。

图2 分离病毒的PCR鉴定结果Fig.2 PCR amplified products from the virus
2.4 CPV VP2 基因的遗传进化分析将分离的8 株病毒与5 株CPV 参考株的VP2 基因利用MEGAX64 软件构建系统进化树。结果显示,分离的8 株CPV 分为两大分支,其中CX-2、CX-3 株与CX-8 株处于一大分支,亲缘关系较近,CX-1、CX-7 株与CX-5、CX-6、CX-10 株处于另一大分支,亲缘关系也较近;其中CX-8 株与澳大利亚株、日本分离株、四川分离株、北京及吉林延吉分离株的亲缘关系相对较近; CX-1、CX-5、CX-6、CX-7、CX-10 株均与参考株亲缘关系较远,其中CX-1 和CX-7 株亲缘关系最近,处于同一分支(图3)。结果表明,黑龙江省流行的CPV 与以往国内外参考株的亲缘关系相对较远,且黑龙江省不同地区CPV的流行呈多样性。

图3 CPV VP2基因的系统进化树Fig.3 Phylogenetic tree of the VP2 genes of CPV
2.5 动物回归试验结果实验犬分别口服和肌注CX-3、CX-5、CX-7、CX-10 株的第5 代细胞培养物,感染CX-5 株的犬在感染后第5 d 分别出现精神沉郁、采食下降的症状,感染后第6 d 有2 只犬体温升高至39.5 ℃和39.6 ℃,3 只犬均出现血便,有腥臭味,其中一只犬在感染后第7 d 出现水样稀便;感染CX-3 株的犬分别于感染后第7 d~9 d 出现精神沉郁,其中一只犬体温最高至39.3 ℃;另外两组组实验犬均有精神沉郁,采食下降的症状,且体温均有一过性升高;对照犬均正常,无任何临床症状。感染后第10 d 迫杀全部犬,采集其心、肝脏、脾脏、肺脏、肠淋巴及十二指肠和空肠,以研磨处理的各脏器样品及感染后第7 d 犬肛门拭子的处理液为模板,提取病毒总DNA,利用P1/P2 引物经PCR检测CPV。结果显示实验犬各脏器及肛门拭子样品均能扩增出目的条带,而阴性对照犬的各脏器和肛门拭子均为阴性结果(图4)。表明分离的CX-3 和CX-5 两株病毒比CX-7 和CX-10 的毒力更强,致犬的临床症状更明显。
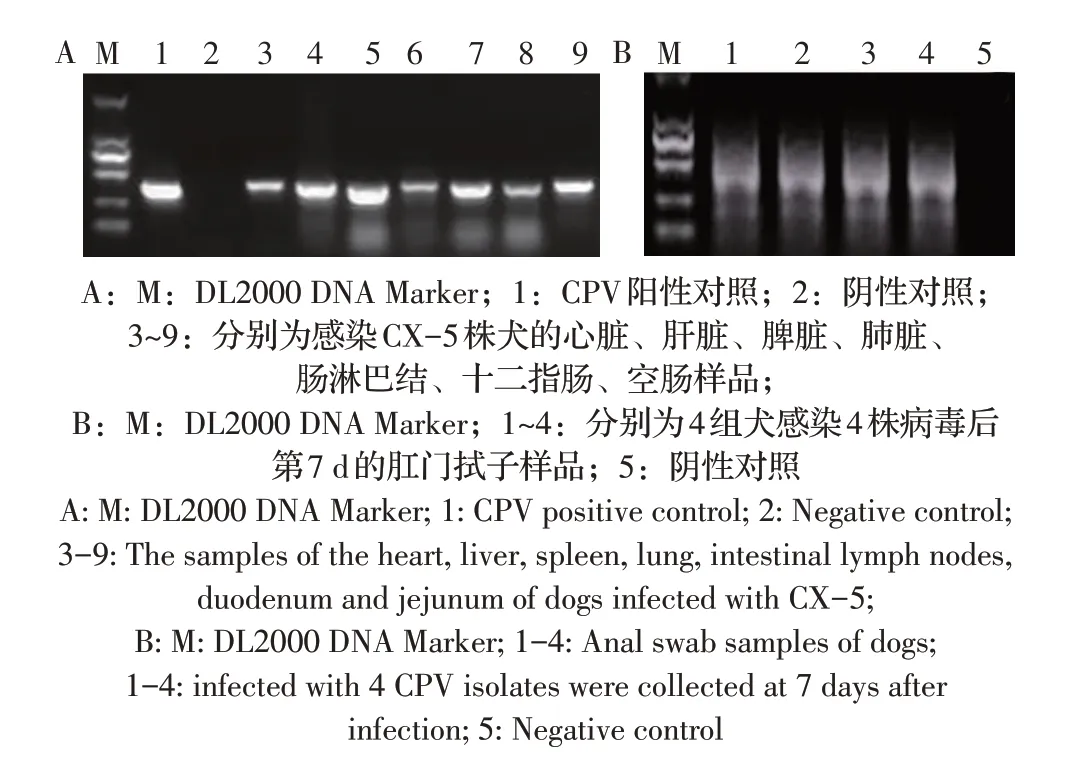
图4 感染犬各脏器(A)及肛门拭子(B)样品的PCR检测结果Fig.4 PCR results of CPV from organs(A)and anal swabs(B)of infected dogs
2.6 CPV强毒的鉴定结果实验组犬分别口服CX-3(实验A 组犬)和CX-5(实验B 组犬)感染犬的十二指肠和空肠病料样品研磨后混合处理悬液后,两组犬分别在感染后第5 d~第7 d 体温升高,A 组犬体温最高至39.7 ℃,B 组犬体温最高至39.8 ℃,A 组有2 只犬在感染后第6 d 有呕吐现象,第7 d 出现腹泻症状,排水样稀便,第8 d 有一只犬食欲废绝;B 组犬于感染后第6 d~第7 d 食欲废绝,第8 d 出现轻度血便、脱水症状,第9 d 均出现CPV 感染的典型症状:酱油色稀便,对照犬均正常,无任何临床症状。感染后第10 d 迫杀全部犬,采集其心、肝脏、脾脏、肺脏、肠淋巴结及十二指肠和空肠,以研磨处理的各脏器样品及犬肛门拭子处理液为模板,提取病毒总DNA,利用P1/P2 引物经PCR 检测CPV,结果显示感染犬样品均能扩增出297 bp的目的片段,对照犬均为阴性结果(图5)。表明分离到了两株CPV 强毒。

图5 感染犬各脏器(A)及粪便排毒(B)的检测结果Fig.5 Results of CPV replication in various organs(A)and virus shedding in feces(B)in infected dogs
3 讨 论
到目前为止,世界范围内CPV 的流行株还是以2a 型和2b 型为主,2c 型也在部分国家流行[12]。CPV是一种在复制过程中要依赖宿主细胞的单链DNA 病毒,其在复制过程中的复制效率和纠错能力不强,因此该病毒基因组的突变率高于一般的DNA 病毒,也导致CPV 对环境和宿主的适应性及逃避宿主免疫应答的能力大幅提高,从而提高了CPV 的进化效率和其在宿主动物体内的传播能力[13]。CPV 的这种进化速度快,且不断出现新血清型的特性,给迅速发展的养犬业疾病的防控带来很大的难度[14]。
本研究从黑龙江不同地区的患病犬粪便中分离出8 株CPV,对其的分型鉴定结果显示, 1 株病毒为2b 型(占比为12.5%),3 株病毒为2c 型(占比为37.5%),其余4 株均为2a 型(占比为50%)。王洋、胡博等于2018 年通过对CPV BJ03/17 株及国内外最近流行株的比较发现,与近几年分离株BJ15-1、SD19、LN1、SH1 及最新分离株SH15 相比,CPVBJ03/17 株VP2 主要的氨基酸位点并未发生变化,说明国内部分地区的CPV 流行株大体一致,且主要为2a 亚型,其次为2b 亚型[4]。孙明、邓小雨等于2017 年报道,我国流行的CPV 以2a 亚型为主,2b 伴随存在,2c 偶尔存在[15]。张淮瑜等于2020 年的研究结果显示,new CPV-2a 和new CPV-2b 似乎分别取代了原2a 和2b 亚型,成为许多亚洲国家主要流行的亚型,而2c亚型则在许多欧洲和美洲国家占主导地位[1],然而本研究结果显示,黑龙江地区流行的CPV 以2c 亚型较多,但仍以2a 亚型为主,说明近年来亚洲国家CPV 的流行已不仅是2a 和2b 亚型, 2c 亚型的流行有上升的趋势。另外在对CPV VP2 完整基因序列的分析发现,相对而言,分离的8 株CPV 与澳大利亚、日本及国内部分地区CPV 参考株的亲缘关系较远,仅CX-8 株与参考株亲缘关系较近,且8 株CPV分为两大分支,其中CX-2、CX-3 株与CX-8 株处于一大分支,亲缘关系较近,CX-1、CX-7 株与CX-5、CX-6、CX-10 株处于另一大分支,亲缘关系也较近,说明黑龙江省流行的CPV与以往国内外参考株的亲缘关系相对较远,且黑龙江省不同地区CPV 的流行呈多样性,另外由于CPV VP2 蛋白的氨基酸序列存在多种变异,因此,对更多地区CPV 抗原变异株的分子监测显得尤为重要[16]。
在动物回归试验中选取了HA 效价较高的3 株病毒和致严重CPE 的1 株病毒进行动物感染试验,结果感染犬均不同程度发病,根据该试验结果选取了2 株毒力较强的CPV,再次感染幼犬进行了强毒鉴定试验,结果这2 株病毒感染的幼犬均出现了CPV的典型发病症状,且CPV 在感染犬的各脏器均能够复制,组织嗜性较广,且能够通过粪便排毒,表明这2 株均为CPV 强毒。目前,CPV 在临床大多伴有犬瘟热病毒(CDV)和或犬腺病毒(CAV)的混合感染,所以临床犬的发病症状不仅是CPV 的单独感染所致,因此,实验室仅以CPV 感染幼犬尤其是杂交犬,很少能出现较典型的临床症状,更少有致感染犬死亡的,本研究中分离到的强毒株感染杂交幼犬后能产生典型CPV 感染的临床症状,说明分离到的这两株CPV 强毒,可以用于后续强毒模型的建立试验。本研究为黑龙江省CPV 的流行病学调查和其遗传进化等研究提供数据支持,同时也为后续的疫苗研究及强毒模型的建立奠定基础。

