中华倒刺鲃致病性嗜水气单胞菌的分离鉴定、耐药性及毒力基因检测
高金伟,田 兴,谢 敏,李绍明,袁希平,邓时铭,宋 锐
(湖南省水产科学研究所,湖南 长沙 410153)
中华倒刺鲃(Spinibarbus sinensis),隶属于鲤形目(Cypriniformes)、鲤科(Cyprinidae)、鲃亚科(Barbinae)、倒刺鲃属(Spinibarbus),俗称青波、岩鲫、乌鳞等,是我国长江流域特有的大型名贵经济鱼类。中华倒刺鲃以肉质细嫩、鲜腴肥美、营养丰富而著称,具有个体大、食谱广、生长快、适温范围广、易驯养、抗病力强等特点,适宜于池塘、水库和规模化养殖,备受消费者和水产养殖者的青睐,已成为我国淡水水域的重要养殖品种之一[1]。近年来,由于极大的市场需求和良好的经济前景的刺激,中华倒刺鲃的养殖规模和养殖密度不断提高,加之养殖环境恶化、管理操作不当、种质退化等原因,导致中华倒刺鲃的抗病力下降,病害的暴发日益严重,严重制约了中华倒刺鲃养殖业的发展壮大。目前,中华倒刺鲃的疾病有细菌性疾病、真菌性疾病、寄生虫性疾病等,其中细菌性疾病是危害最为严重、影响最为广泛的一类疾病,极大地影响了中华倒刺鲃的养殖效益。前期的研究报道了中华倒刺鲃肌肉溃烂病、细菌性烂鳃病、细菌性肠炎病、出血病等细菌性疾病[2-3],其中中华倒刺鲃肌肉溃烂病的病原为伯克霍尔德氏菌属(Burkholderid)中的洋葱霍尔德氏菌(Burkhol cepacid),而其余3 种细菌性疾病的病原仍未明确。此外,袁旦一等报道了一例维氏气单胞菌(Aeromonas veronii)和约氏不动杆菌(Acinetobacter johnsonii)混合感染导致的中华倒刺鲃持续性死亡的病例[4]。朱成科等报道了患病中华倒刺鲃的致病菌为迟缓爱德华菌(Edwadsiella tarda)[5]。目前,国内外仅有少数关于中华倒刺鲃致病菌的研究报道[2-5],而关于池塘养殖的中华倒刺鲃致病性嗜水气单胞菌(A. hydrophila)的分离鉴定尚未见报道。
2019 年6 月湖南省长沙市某水产养殖基地池塘套养的中华倒刺鲃大量死亡,其他混养品种(草鱼、鲢、鳙)未见死亡,病鱼的临床症状主要为体表出血,鳞片少量脱落,肛门脱垂红肿,剖检见淡黄色至淡红色腹水,脾、肾肿大,鳔上有出血点,肠道无内容物。通过镜检排除真菌及寄生虫感染。本研究对患病的中华倒刺鲃进行了病原菌分离鉴定,进而检测其携带的毒力基因和耐药性,旨在分析该菌的分类地位、致病力并筛选防治药物,以期为深入研究中华倒刺鲃病原多样性、嗜水气单胞菌的致病机理、传播途径及流行病学提供参考依据。
1 材料与方法
1.1 主要实验材料濒死中华倒刺鲃采自湖南省长沙市某水产养殖场,体质量(327.2±29.7)g,体长(28.6±1.83)cm。健康中华倒刺鲃取自湖南省水产科学研究所长沙基地,体质量(300±25.1)g,体长(25.2±3.28),暂养于长(320 cm)×宽(155 cm)×高(80 cm)的水泥池中,水温(28±1)℃,24 h 连续增氧,暂养1 周后用于人工感染试验。胰蛋白胨大豆肉汤培养基(TSB)、胰蛋白胨大豆琼脂培养基(TSA)、气单胞菌培养基(RS)、营养琼脂(NA)、MH 琼脂(MHA)、LB 琼脂和哥伦比亚血琼脂平板购自北京陆桥技术股份有限公司;革兰氏染色液、药敏纸片和生化鉴定管购自杭州微生物试剂有限公司;ExTaq®试剂盒和DL2000 Marker 购自宝生物技术(北京)有限公司;Ezup 柱式细菌基因组DNA 抽提试剂盒和琼脂粉购自生工生物工程(上海)股份有限公司。
1.2 细菌的分离与纯化在无菌条件下用接种环从患病中华倒刺鲃肝胰脏、脾脏和肾脏的新鲜断面及腹水中取样划线,接种于TSA培养基,28 ℃培养18 h后挑取单菌落接种于TSB 培养基,28 ℃、180 r/min 培养18 h 后,于TSA 培养基划线培养,从而获得纯培养的菌株。共获得4 株形态、大小基本一致的单克隆菌,依次编号为AH32~AH35,4 ℃保存备用。选取AH32 进行后续试验。
1.3 细菌形态特征观察和生化鉴定取纯培养菌AH32 经革兰氏染色,显微镜观察菌体形态。将该菌株接种于RS、NA、LB、哥伦比亚血琼脂等平板上,置于28 ℃培养24 h 后观察菌株生长情况。将该菌株无菌接种于细菌微量生化反应管中,测定其生理生化特性。
1.4 细菌的分子鉴定及系统发育树的构建提取分离菌株基因组DNA,于-20 ℃保存备用。16S rRNA基因序列的PCR 扩增引物及体系参照梁利国等的方法进行[6]。PCR 产物由上海生工生物工程技术服务有限公司测序。利用SeqMan 软件进行分离菌株16S rRNA 基因序列拼接。利用NCBI 的BLASTn 检索系统(http://blast.ncbi.nlm.nih.gov/Blast.cgi)分析16S rRNA 基因序列的同源性,并利用ClusterX 1.83 软件对14 株同源性较高的16S rRNA 基因序列进行多重比对,再利用MEGA7 软件包中Neighbour-Joining 法构建其系统发育树。
1.5 分离菌的多位点序列分型参照文献合成gyrB、groL、gltA、metG、ppsA和recA6 个管家基因的扩增引物[7],并将分离菌DNA 作为模板分别PCR 扩增6个管家基因,PCR 产物由上海生工生物工程技术服务有限公司测序。测得的管家基因序列利用SeqMan软件拼接,并在线上传至https://pubmlst.org/aeromonas/数据库中进行分析,得到每个管家基因的等位基因号,按照gyrB-groL-gltA-metG-ppsA-recA的顺序将等位基因号排列可得到该分离菌的序列型(Sequence type,ST),即多位点序列型。
1.6 分离菌毒力基因检测选取气单胞菌属(Aeromonas)中6种常见毒力基因进行PCR扩增(表1),包括气溶素(aer)、热不稳定肠毒素(alt)、黏附素(aha)、弹性蛋白酶(ela)、脂肪酶(lip)和蛋白酶(ahp),PCR 扩增产物经1.2%琼脂糖凝胶电泳检测。反应参数为:95 ℃5 min;94 ℃45 s、退火30 s(退火温度见表1)、72 ℃1 min,共35 个循环;72 ℃10 min。

表1 嗜水气单胞菌毒力因子的检测引物Table 1 Primers of the virulence genes in Aeromonas hydrophila
1.7 药物敏感试验采用K-B 纸片扩散法对菌株AH32 进行30 种常用抗生素的耐药性检测。以涂布法接种0.1 mL浓度为1×108cfu/mL(约0.5个麦氏浊度)的AH32 菌液于MH 琼脂培养基上,28 ℃培养24 h 后观察并记录抑菌圈的直径(包括药敏片),参照美国临床和实验室标准协会(CLSI)发布的抗微生物药物敏感性试验指南和中华人民共和国卫生行业标准-抗菌药物敏感性试验技术要求(WS/T 639-2018),以抑菌圈直径大小作为分离菌株对药物敏感性的判定依据。将分离菌AH32 对每种抗生素的耐药情况用S、I、R 记录,计算该菌的多重耐药指数(Multi-antibiotic resistance indexes,MARIs)。
1.8 动物回归感染试验挑取AH32 单克隆于LB 培养基中过夜培养(28 ℃,180 r/min),离心,弃上清,用0.9%的无菌生理盐水洗涤2次,制成菌悬液,采用紫外分光光度计法(OD600nm)测定菌悬液的浓度,将菌悬液分别10倍倍比稀释至1×109cfu/mL~1×105cfu/mL。将中华倒刺鲃随机分成18 组,每组10 尾鱼,5 个不同稀释度的菌液随机选取3 组腹腔注射0.1 mL 菌悬液,设为感染组;剩余3 组鱼腹腔注射0.1 mL 无菌生理盐水,设为对照组。连续7 d 记录并观察实验鱼的发病和死亡情况,同时从濒死的中华倒刺鲃的内脏器官进行病原菌的重分离,以引起人工感染的中华倒刺鲃发病死亡并能重新分离到相同的病原菌作为分离菌致病性的判定依据。
2 结果与讨论
2.1 分离菌形态特征和理化特性分析患病鱼的病料样品接种TSA 培养基28 ℃培养24 h 后形成边缘湿润、表面光滑、中央微凸起、直径约2 mm、灰白色或淡黄色的圆形菌落。分离菌在NA 和LB 琼脂培养基上的菌落特征与在TSA 琼脂培养基上的形态基本一致,在RS 培养基上呈橙黄色。在哥伦比亚血琼脂平板(含5%脱脂绵羊血)上生长良好,产生β-溶血圈。AH32 株为革兰氏阴性短杆菌,能够利用葡萄糖、麦芽糖、甘露醇、枸橼酸盐、丙二酸盐、七叶苷等,不能利用乳糖、蜜二糖、尿素等;分解赖氨酸脱羧酶、精氨酸脱羧酶和精氨酸双水解酶。
2.2 基于16S rRNA 基因序列的系统发育分析PCR扩增AH32株的16SrRNA片段长度为1368bp(MW440455)。将其通过EZBio Cloud 数据库进行序列同源性分析,结果与嗜水气单胞菌16S rRNA 基因序列同源性高达99.78%;进化树结果显示,菌株AH32 与嗜水气单胞菌(NR_043638、NR_074841、NR_113342)聚为一支(图1)。

图1 分离菌AH32 16S rRNA基因发育的系统进化树Fig.1 The phylogenetic analysis based on 16S rRNA gene sequence of AH32
综合分离菌株的表型特征、理化特性及16S rRNA 基因序列的系统发育分析结果,判定分离菌AH32 为气单胞菌属的嗜水气单胞菌。
2.3 多位点序列分型与毒力基因检测结果分离株AH32 管家基因的PCR 结果显示,获得与6 个管家基因片段大小对应的单一亮条带(图2A),对PCR 产物序列在线比对,发现嗜水气单胞菌AH32 的等位基因图谱为210-214-122-211-221-217,其序列型为ST251。菌株AH32 可检测到alt、aha、ela、lip和ahp毒力基因(图2B),检出率为83.3%,其毒力基因型为alt+aer-aha+ahp+lip+ela+。上述结果表明,嗜水气单胞菌AH32 携带多个与致病相关的毒力基因,且属于高致病性序列型ST251。
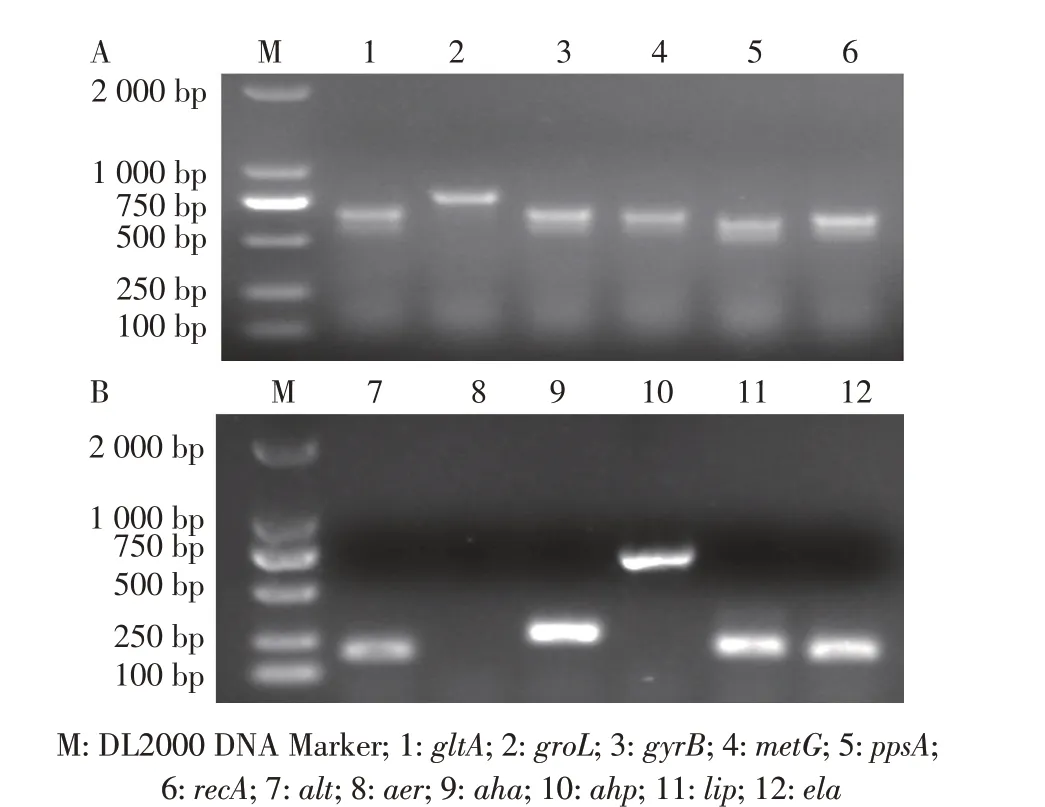
图2 分离株AH32的管家基因(A)和毒力基因(B)PCR扩增结果Fig.2 PCR amplification results of housekeeping genes(A)and virulence genes(B)of isolated strain AH32
研究发现,嗜水气单胞菌ST251 型是引起中国和美国养殖鱼类细菌性败血症的高风险序列型,能够对淡水鱼类的养殖造成严重的经济损失[8]。在中国,ST251 型菌株已成为江苏、湖南、湖北、广东等省份的主要流行菌株,其感染宿主主要为鲤科鱼类[8-9]。本研究中, ST251 型嗜水气单胞菌致中华倒刺鲃的大量死亡,再次说明ST251 型嗜水气单胞菌在湖南地区池塘养殖的鲤科鱼类中广泛传播。
致病菌表达和分泌毒力因子,进而侵入、定植和损伤宿主,检测致病菌的毒力基因是评估其潜在致病性的重要手段。本研究中,嗜水气单胞菌AH32 携带毒力基因aha、alt、ahp、lip和ela,未携带毒力基因aer,表明嗜水气单胞菌AH32 对中华倒刺鲃产生的致病性可能与其分泌的外毒素密切相关,至于其致病机理与外毒素的相关性有待进一步探究。黄沙鳖源嗜水气单胞菌的Alt和ahal基因与Aer、ahp等毒力基因之间存在协同作用,且毒力基因型为hly+Aer-Alt+Act+ahal-ahp+的嗜水气单胞菌致病力显著低于hly+Aer+Alt+Act+ahal-ahp+的菌株[10]。刘小芳等指出,鱼源嗜水气单胞菌的alt、aer、lip等毒力基因与嗜水气单胞菌的致病力呈正相关,且是否携带aer基因不作为气单胞菌致病力强弱的判定依据[11]。由此表明,嗜水气单胞菌毒力的强弱依赖于其毒力因子的合成与分泌,其毒力的发挥是多种毒力基因协同作用的结果,且与其携带毒力基因的种类、数量以及毒力基因的表达情况密切相关。
2.4 药敏试验结果分离菌AH32 对头孢他啶、头孢曲松、多西环素等19 种抗生素敏感,对链霉素、红霉素、美罗培南中度敏感,对氨苄西林、头孢拉定、克林霉素等8 种抗生素耐药。分离菌AH32 的MARIs 为0.33。以上结果表明,分离菌AH32 对所选用的抗生素具有一定的耐药性。
目前,抗菌药物依然是水产动物疾病控制的主要手段之一,但由于抗菌药物的不合理使用、耐药菌株的传播及耐药基因的水平转移,导致水产动物致病菌的耐药性问题日益突出。本研究中,分离株AH32 对第一代头孢类抗生素头孢拉定高度耐药,对头孢曲松、头孢吡肟等第三代和第四代头孢类抗生素高度敏感,这与蔡丽娟等在草鱼、鲫、团头鲂等鱼源嗜气单胞菌的药敏结果一致[12],而与鲟源嗜水气单胞菌对上述头孢类药物均高度耐药的研究结果不一致[13],表明嗜水气单胞菌不同分离株对抗菌药物的耐药性存在差异,这可能与养殖品种、养殖环境、用药习惯、给药途径等因素密切相关。目前,药敏试验仍然是筛选敏感性高、疗效确定抗菌药的重要手段。本研究中,嗜水气单胞菌AH32 对氟苯尼考、恩诺沙星、左氧氟沙星等19 种抗菌药物敏感。农业农村部发布的《水产养殖用药明白纸2020 年2 号》文件中指出,氟苯尼考、恩诺沙星和多西环素为已批准的水产养殖用兽药,因此在中华倒刺鲃养殖过程中,可选用这3 种药物防治。
2.5 人工感染试验结果将健康中华倒刺鲃经腹腔注射分离菌株AH32 后,接种不同浓度菌液后出现不同程度的死亡,且随着菌悬液浓度的增加,其死亡率呈上升趋势;对照组中华倒刺鲃在试验期间未出现死亡。接种24 h 后,1×109cfu/mL 浓度组的实验鱼开始出现死亡,胸鳍基部明显出血,肛门红肿,症状与自然发病的中华倒刺鲃临床症状一致。从感染死亡的鱼体肝脏、肾脏及腹水中再次分离纯化到感染菌,经细菌学特征鉴定,其性状与原菌株AH32 一致。结果表明,嗜水气单胞菌AH32 是该次中华倒刺鲃死亡的致病菌。
嗜水气单胞菌属于弧菌科(Vibrionaceae)、气单胞菌属,普遍存在于土壤、养殖水体和水生动物肠道中,是典型的人-兽-鱼共患条件致病菌。近年来,先后从青鱼(Mylopharyngod piceus)[6]、异育银鲫(Carassius auratus gibelio)[7]等不同的鲤科鱼类体内分离鉴定出嗜水气单胞菌,本研究首次从患病中华倒刺鲃体内分离获得嗜水气单胞菌,表明嗜水气单胞菌对水生动物宿主的广泛适应性及其宿主范围的进一步扩大。

