基于microcarrier 6正常免疫鼠人源宫颈癌移植瘤模型的构建及其临床应用意义
刘昆燕,张秋实,张 凯,洪 丰,王全义,彭一晴,赵 影,段亚楠,周润生,彭存旭*
(1.济宁医学院临床医学院,山东 济宁272000;2.广东省第二人民医院 妇科(妇幼健康研究所);3.吉林大学第二医院; 4.济宁医学院附属医院 a.中美肝病与免疫研究所; b.病理科;c.生殖医学科;d.妇科)
宫颈癌(CC)是女性最常见的恶性肿瘤之一,在全球女性恶性肿瘤中其发病率及死亡率均位居第四[1]。随着社会发展以及环境改变等因素,宫颈癌患者的发病更趋向于年轻化,且呈现逐年上升的趋势,在我国其发病率仅次于乳腺癌而位居第二[2]。因此构建能够模拟肿瘤患者特征的宫颈癌动物模型在宫颈癌发病机制研究和临床治疗方面意义重大。
患者来源的肿瘤组织动物移植模型(PDX)能最大程度保留原发肿瘤组织的肿瘤异质性及原发肿瘤的肿瘤微环境[3],被认为是最接近临床患者的肿瘤动物模型。但目前国内外移植瘤模型多选用免疫缺陷鼠,如裸鼠、SCID鼠等,导致传统的PDX模型在肿瘤免疫治疗、肿瘤发生的免疫相关机制研究中具有明显局限性,严重影响疾病的精准治疗与预后判断,并且移植瘤的成瘤周期一般需要4-6个月。因此,如果本研究能克服传统PDX模型这一缺陷,在正常免疫小鼠体内成功构建人宫颈癌PDX模型,对宫颈癌的免疫相关机制研究及精准治疗意义重大。
microcarrier 6是一种新型3D微载体,呈多层孔样条索状,并相互交联蜷曲,镜下呈“迷宫”样且有足够空间的不规则结构。该新型微载体由带正电的有机复合多聚物构成,孔径大小不一,其颗粒大小和表面正电荷密度均可根据实验需要调节,该微载体是不含杂质、不易污染的有机化合物。更为重要的是该新型微载体同时还具有低免疫原性、生物兼融性和可代谢性的特征,非常有利于细胞生长。与此同时,其不规则结构在建模早期可以起到屏障作用,在一定程度上缓解了体内免疫细胞直接杀伤肿瘤细胞的作用。另外,用CXCL-12α和VEGF对微载体进行修饰后,可诱导血管长入,促进血管形成,为肿瘤的生长提供丰富的营养。
本研究将从手术切除的宫颈癌标本组织中分离提取的癌细胞,与mocrocarrier 6共同孵育24 h,将(宫颈癌细胞-微载体)复合体经皮下接种到小鼠体内,成功建立了新型患者来源的正常免疫小鼠宫颈癌移植瘤模型。
1 材料和方法
1.1 材料
1.1.1肿瘤标本 5例新鲜宫颈癌肿瘤组织均取自济宁医学院附属医院妇科,所有标本的获取均经患者本人及家属同意,签署知情同意书。详细信息见表1,人体标本实验通过了济宁医学院附属医院伦理委员会的批准。

表1 宫颈癌相关PDX模型的病例信息
1.1.2实验动物 C57BL/6雌性90只小鼠,6-8周龄, 22-25 g/只,由济南朋悦实验动物繁育有限公司提供[许可证号 SCXK(鲁) 20140007],饲养在济宁医学院SPF级实验动物中心,饲养动物实验过程均严格按照济宁医学院动物伦理委员会相关规定进行。
1.1.3主要试剂 DMEM培养基、胰酶、胶原酶II、胎牛血清、红细胞裂解液、青链霉素购于Gibco公司,主要抗体 P16、CK5/6单克隆抗体购于Abcam公司。microcarrier 6为美国ELYON BIOTECHNOLOGIES LLC公司提供。
1.2 方法
1.2.1原代宫颈癌细胞的获取 将手术切除下的新鲜肿瘤组织标本立即放入含10%浓度青链霉素的DMEM培养基中,置 冰盒内转运到实验室,在超净工作台内,取出标本,去除坏死组织,用含10%浓度青链霉素的生理盐水反复冲洗3次直至清洁,再加入50%浓度青链霉素完全浸泡10 min直至洁净无菌,将标本置于培养皿中用眼科剪剪至1 mm3大小,加入以DMEM培养基为溶剂配制的0.05%胶原酶Ⅱ溶液, 37℃消化1 h,加入适量DMEM反复吹打,70 μm滤网过滤后以1200转/分,离心8 min,弃上清,以红细胞裂解液重悬细胞,置于37℃ 10 min,即可得到人原代宫颈癌细胞。
1.2.2人原代宫颈癌细胞与microcarrier 6共培养 将微载体microcarrier 6 置于75%酒精浸泡24 h,用1×磷酸盐缓冲液(PBS)清洗3遍,于含10%胎牛血清的DMEM培养基中孵育24 h;用趋化因子-12α(CXCL-12α)和血管内皮生长因子(VEGF)对微载体microcarrier 6 进行修饰,浓度均为100 ng/mL,孵育时间为3 h。取指数生长期原代宫颈癌细胞,用台盼蓝染色实验计数活细胞数>95%,用含10%胎牛血清的RPMI 1640培养基重悬细胞,调整宫颈癌细胞浓度为2×107/mL,与修饰好的微载体microcarrier 6悬液按照体积比为1∶1混合后,置37℃、5% CO2培养箱中培育24 h。镜下观察,肿瘤细胞在微载体microcarrier 6 内达到饱和状态。
1.2.3正常免疫小鼠宫颈癌PDX模型的建立 5例标本共用90只C57BL/6雌鼠,每例15只。每次实验分为3组,细胞对照组、微载体对照组和实验组,每组5只小鼠。细胞对照组小鼠单纯接种含2×107个/mL宫颈癌细胞悬液150 μl/只;空载体对照组小鼠单纯接种含30 μg 空微载体悬液150 μl/只;实验组小鼠接种含2×107个/mL宫颈癌细胞、30 μg微载体的细胞-微载体混合物悬液150 μl/只。异氟烷麻醉小鼠,按分组要求依次对每组小鼠右腋下皮下进行接种移植。
1.2.4小鼠模型的观察指标及移植瘤生长评估 将皮下接种后的小鼠按分组隔离饲养,每日对各组小鼠分别称量、记录体质量,观察每组小鼠食欲及每组小鼠的活动度。记录小鼠皮下移植瘤的成瘤时间、移植瘤的体积。自移植瘤长出后,每天测量肿瘤的最长瘤径(a)和最短瘤径(b),依照肿瘤体积公式V=1/2×a×b2,计算肿瘤的体积并绘制出肿瘤生长曲线。
1.2.5小鼠模型病理学检查 建模第16天时,统一异氟烷麻醉后处死宫颈癌移植瘤小鼠,并完整分离移植瘤,将其称重、测量移植瘤长径,观察其质地、形态、局部浸润程度及坏死程度。固定移植瘤组织(10%中性甲醛),包埋切片(石蜡),常规病理染色(HE);按试剂盒说明,进行免疫组化染色(EnVision二步法),检测P16、CK5/6在各组移植瘤中的表达情况。判定染色结果:P16阳性的颗粒定位于肿瘤细胞核和(或)细胞浆中,均出现黄色或棕黄色颗粒;CK5/6阳性的颗粒定位于细胞浆中,显棕黄色。于高倍镜下随机选取95个视野,统计阳性百分率=阳性细胞数/计数细胞总数。阳性细胞百分率<10%为阴性(-),阳性细胞百分率≥10%为阳性(+)。
2 结果
2.1 基于微载体microcarrier 6构建人原代宫颈癌细胞体外三维培养体系
光镜下观察刚分离出的原代宫颈癌细胞几乎全为单个细胞,呈球形,其折光性较强(图1A);微载体microcarrier 6在光镜下观察为不规则长梭状或团状,质地疏松,其内部含有大量孔隙(图1B);被修饰过的microcarrier 6与患者来源的原代宫颈癌细胞共培养24 h后,光镜下可见宫颈癌细胞很好的贴附在微载体microcarrier 6上,直至达到饱和状态,微载体外周可见不规则细胞团(图1C)。

图1 人原代宫颈癌细胞三维培养体系形态学特征
2.2 基于microcarrier 6在正常免疫小鼠体内建立宫颈癌PDX模型
整个实验全过程中,各组小鼠体质量及毛发均没有明显变化,只有实验组小鼠在1周后表现出活动度减少与食欲稍减退,各组小鼠均无死亡。细胞对照组:自实验开始至实验结束全过程无小鼠长出肿瘤。空载体对照组:共有4只小鼠在右侧腋下发现0.2 cm左右的结节,质地柔软,剖开后可见豆渣样载体物质流出,未成瘤,其余的空载体对照组小鼠均未长出肿瘤。而在接种移植后8-10天实验组小鼠即有皮下包块可触及,25只实验组小鼠共有22只有皮下包块可触及,得出总的成瘤率为88%(表2)。移植瘤生长迅速,移植瘤的生长高峰期则在移植后11-15天,高峰期移植瘤体积迅速增大,在移植后12天左右,肉眼即可观察到皮下的隆起包块,16天肿瘤直径可达到0.8-1.2 cm(图2)。肿瘤部分剖开后,发现移植瘤组织较易与周围正常组织分离开,移植瘤形态不规则,多数为椭圆形,可见移植瘤周围血供较丰富,切开移植瘤组织后可见实质部分颜色以灰白色为主。
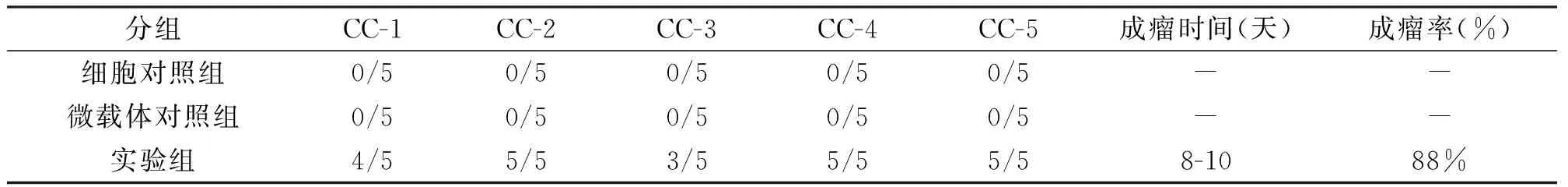
表2 成瘤时间和成瘤率
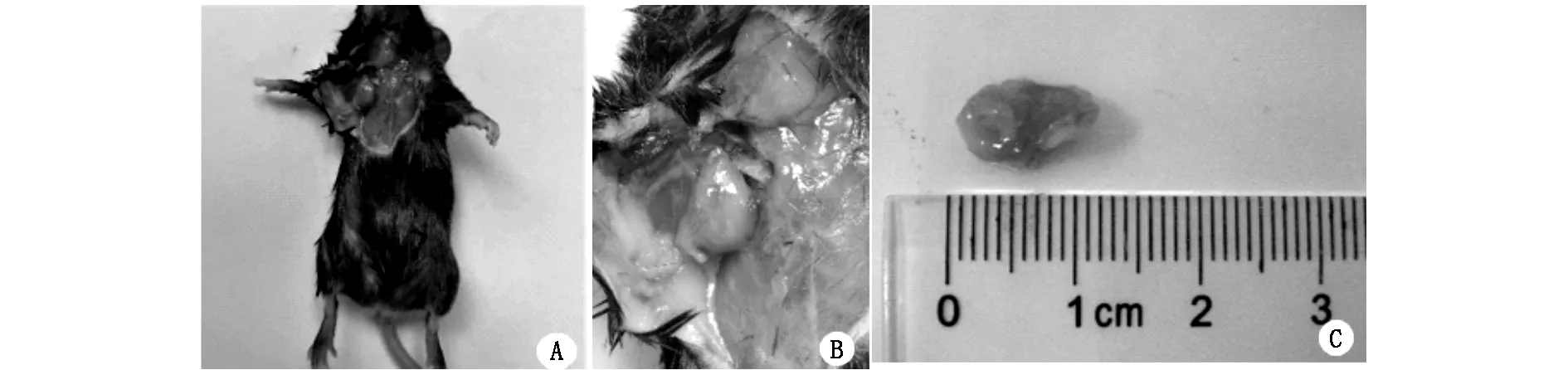
图2 microcarrier 6 宫颈癌建模组
2.3 病理学检查
2.3.1HE染色 实验组小鼠形成的移植瘤组织与患者来源的人原代宫颈癌组织非常相似,在光镜下,见大量大小不一的异型性明显的杂乱排列的核大且深染的细胞,向毗邻的肌肉及脂肪组织呈现出浸润生长;且移植瘤也伴有中央区坏死;接种16 天时有少量残余microcarrier 6被新生细胞包绕并形成肉芽肿;实验组宫颈癌移植瘤组织其边缘有新生毛细血管且血管异常丰富(图3)。
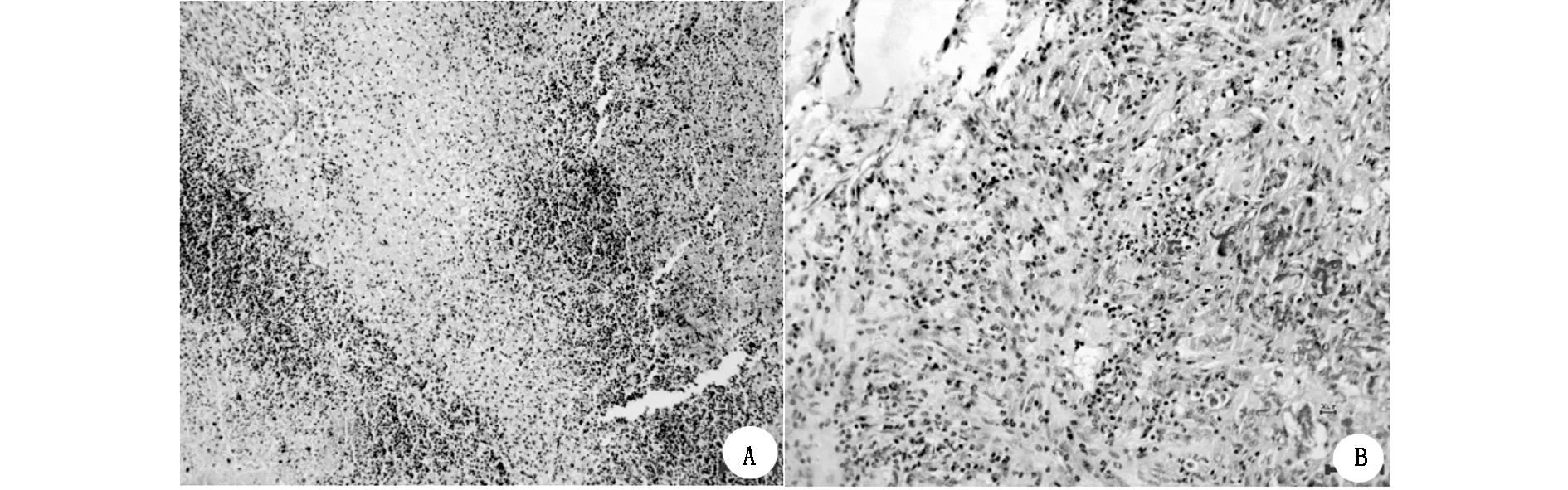
图3 小鼠人源性宫颈癌细胞移植瘤接种成功肿瘤组织石蜡切片
2.3.2免疫组织化学方法 结果显示,P16、CK5/6均为阳性表达(图4),因此也证实上述异型细胞为人源性宫颈癌细胞。
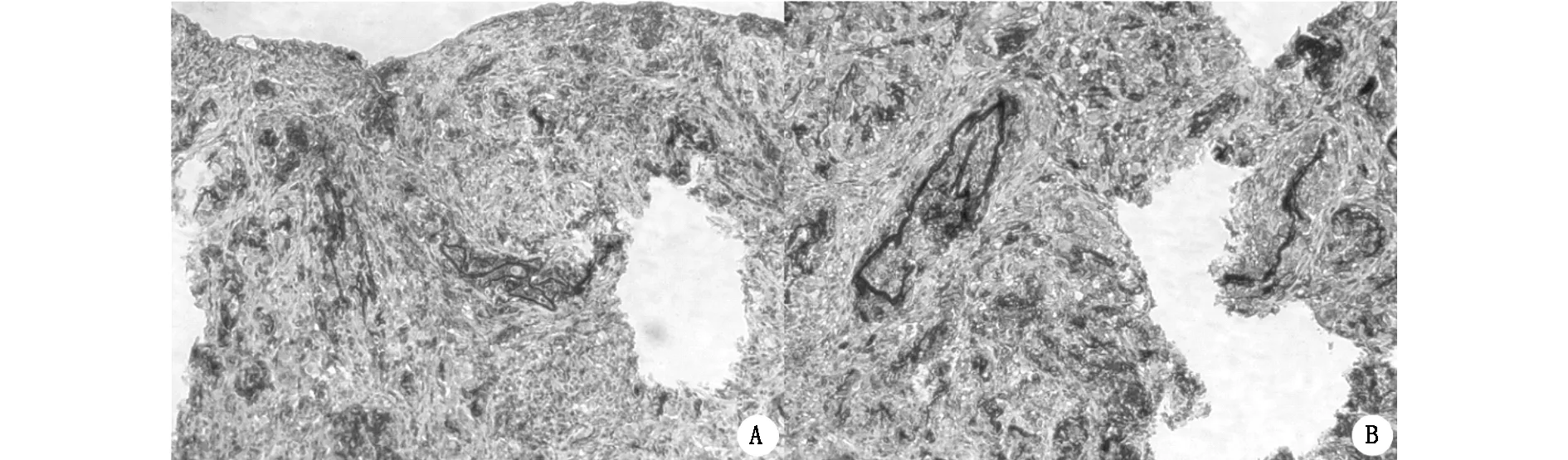
图4 免疫组化示细胞-微载体复合物小鼠宫颈癌移植瘤为人源性宫颈癌细胞 (×200)
3 讨论
宫颈癌是严重威胁人类健康的常见恶性肿瘤之一,占全球女性恶性肿瘤中发病率及死亡率的第四位,且宫颈癌的发病趋向于年轻化,呈现逐年上升的趋势,在我国其发病率仅次于乳腺癌而位居第二,对女性健康构成严重威胁。目前其发病机制尚不完全清楚,建立合适的宫颈癌动物模型为研究宫颈癌的发生发展机制、为抗肿瘤药物的筛选同时为药物的开发[4]提供了全新的平台。
本课题组前期研究发现单纯以人原代宫颈癌细胞接种于正常免疫鼠体内,即便增加3倍细胞数量,也无法成瘤,考虑为异种移植排异反应所致。3D微载体是一种支持细胞生长的支撑结构,弥补了上述缺陷,由带正电的多聚有机复合物构成,质地疏松,具有多层孔隙样结构,有助于肿瘤细胞的快速附着及扩增。并且可在较短时间内起到屏障与保护作用,阻挡机体的免疫细胞对微载体内的癌细胞直接杀伤作用,并且经过VEGF和CXCL-12α修饰后,3D微载体能够诱导移植瘤血管生长,为肿瘤的快速形成及快速增殖提供足够的营养。以上条件为肿瘤细胞的稳定生长提供良好的环境基础。3D微载体肿瘤细胞培养系统能够高度模拟肿瘤生长的微环境,目前已成为研究的热点[5-8]。
转化医学所需的宫颈癌模型需满足能够准确地反映宫颈癌生物特性,充分地模拟人类的肿瘤微环境,且易于操作,重复性高。移植瘤PDX模型为目前最接近于临床并且应用最广泛的动物模型,但是,目前肿瘤模型主要利用免疫缺陷鼠例如裸鼠、SCID鼠等。虽然特殊的免疫缺陷鼠成瘤率较正常免疫鼠高,但难以真实反应肿瘤的发生发展及转归与机体的免疫系统之间内在的相互作用关系,为更准确地还原患者肿瘤组织学、分子生物学特点及肿瘤微环境,弥补因免疫缺陷小鼠缺乏免疫细胞,而不能准确模拟机体免疫系统对肿瘤的免疫攻击等重要缺点,本研究基于microcarrier 6微载体技术已成功创建了10到15天快速成瘤的正常免疫小鼠宫颈癌PDXs模型[9]。
本实验结果发现,基于microcarrier 6微载体复合患者来源的原代宫颈癌细胞建立正常免疫鼠宫颈癌移植瘤模型的成瘤率达88%。该模型的特点是肿瘤成瘤较快,重复性好,操作相对简便。实验显示,移植瘤在8-10天就可长出,11-15天为其生长高峰期。病理学HE染色提示大量异型核细胞的浸润生长,可侵及脂肪、肌肉、神经等组织,肿瘤中央因瘤细胞生长过速,血供不足可见坏死灶。在肿瘤周边还可见到毛细血管分布。这些均符合人肿瘤生长特点。免疫组化检测显示,P16、CK5/6阳性表达[10],进一步证实异型细胞来源于人宫颈癌细胞。
综上,本实验基于microcarrier 6-3D微载体将免疫功能正常的小鼠成功构建出人原代移植瘤动物模型,该动物模型保留了小鼠正常的免疫功能及人源性肿瘤的特征,为临床转化提供了新途径,为进一步研究宫颈癌形成过程中免疫逃逸及免疫调节机制提供了新思路。

