高雄激素相关的慢性炎症与多囊卵巢综合征的研究进展*
吕 镁 徐泽均 孙任任 莫中成 谢远杰1,**
(1)南华大学衡阳医学院应用解剖与生殖医学研究所,衡阳421001;2)桂林医学院-岳阳市妇幼保健院广西基础医学协同创新研究生联合培养基地,岳阳416000;3)安顺市人民医院,安顺561000)
多囊卵巢综合征 (polycystic ovarian syndrome,PCOS)是一种与代谢、心理和免疫相关的生殖功能缺陷性疾病,发病率为5%~20%,现已成为影响育龄期妇女健康的问题之一[1]。Leventhal 和Stein[2]首先将多囊卵巢综合征定义为月经过少和多囊卵巢,还可表现为多毛、不孕、肥胖、复杂妊娠、胰岛素抵抗、心血管疾病、焦虑和抑郁。鹿特丹标准是普遍接受的PCOS 诊断标准,即必须存在至少以下两个特征:高雄激素血症(hyperandrogenism,HA)生化或临床表征、多囊卵巢和少/寡排卵[3]。尽管该病症状和体征在育龄妇女最为明显,但在青春期前和更年期后也存在相关风险和症状。
多囊卵巢综合征被认为是不孕症的潜在危险因素,因为它往往导致排卵不足。性激素是月经周期和卵巢其他事件的调节器。当女性体内的激素水平不断受到干扰时,就会破坏卵巢功能,导致卵巢囊内囊肿的形成,进而导致月经周期不规律,降低女性受孕几率。
PCOS 被认为处于慢性促炎症状态,HA 是其突出特征之一,而且炎性细胞的存在可能与PCOS相关的2型糖尿病及心血管疾病有关。任何对肾上腺或卵巢活动的干扰都可改变雄激素水平,过量的雄激素除了加速原始卵泡向窦卵泡的转化,还刺激炎症的形成[4]、增强内脏脂肪[5]。通过不同机制,脂肪组织也会引起PCOS的慢性炎症反应。除了脂肪细胞本身会释放炎症因子外,脂肪组织里的巨噬细胞也会分泌肿瘤坏死因子-α (tumor necrosis factor α,TNF-α)、白介素(interleukin,IL)-6 等促炎症因子,诱导卵巢发生炎症反应。研究表明,PCOS患者体内的炎症因子表达升高也可以促进雄激素水平增高[6],导致卵巢发生多囊样改变[7]。
本文综述了近几年对雄激素相关炎症的研究,发现脑神经元Kisspeptin、GnRH、褪黑素等能通过下丘脑-垂体-卵巢轴(hypothalamic-pituitaryovarian axis,HPO)参与调节雄激素的生成,参与慢性炎症的形成,与PCOS的发生发展密切相关。
1 雄激素的合成、调控及基本功能
在哺乳动物和啮齿类动物体内,雄激素主要由卵巢和肾上腺生成。大约一半的睾酮来源于卵巢和肾上腺的直接分泌,而一半是由外周循环系统的雄烯二酮转化产生的,而雄烯二酮也是来源于卵巢和肾上腺。本篇文章涉及的高雄激素主要是由卵巢功能异常导致的。
月经周期正常的女性,下丘脑分泌促性腺素释放激素(gonadotropin-releasing hormone,GnRH),诱导垂体分泌黄体生成素(luteinizing hormone,LH)、卵泡刺激素(follicle stimulating hormone,FSH)。LH主要作用于卵泡膜细胞,促进雄性激素的合成。随着雄激素的产生,FSH作用于卵巢颗粒细胞将雄激素转化为雌激素,促进初级卵泡的生长(图1)。PCOS 女性神经内分泌功能障碍导致HPO功能紊乱,使得LH生成过多、囊肿大量形成,并导致雄激素过剩[3]。目前很多PCOS研究都是基于其高雄激素这一特点进行动物造模,常用的雄激素有睾酮、双氢睾酮(dihydrotestosterone,DHT)、丙酸睾酮等,由于睾酮在体内能转化为雌激素,通常会选用DHT 或者丙酸睾酮。正常生理水平雄激素通常和促性腺激素一起在窦前到窦卵泡早期的卵泡发育中起重要作用,但是高水平的雄激素不仅会抑制卵泡生长,还可促进卵泡过早黄体化,阻碍优势卵泡的选择,诱导炎症的形成,是PCOS维持慢性炎症状态的重要因素。在卵巢中,炎症因子由白细胞、卵母细胞和卵泡细胞分泌,以旁分泌和自分泌方式调节性腺类固醇的合成、卵泡发育、黄体生成、卵巢细胞增殖、卵子形成、激素平衡和黄体功能。
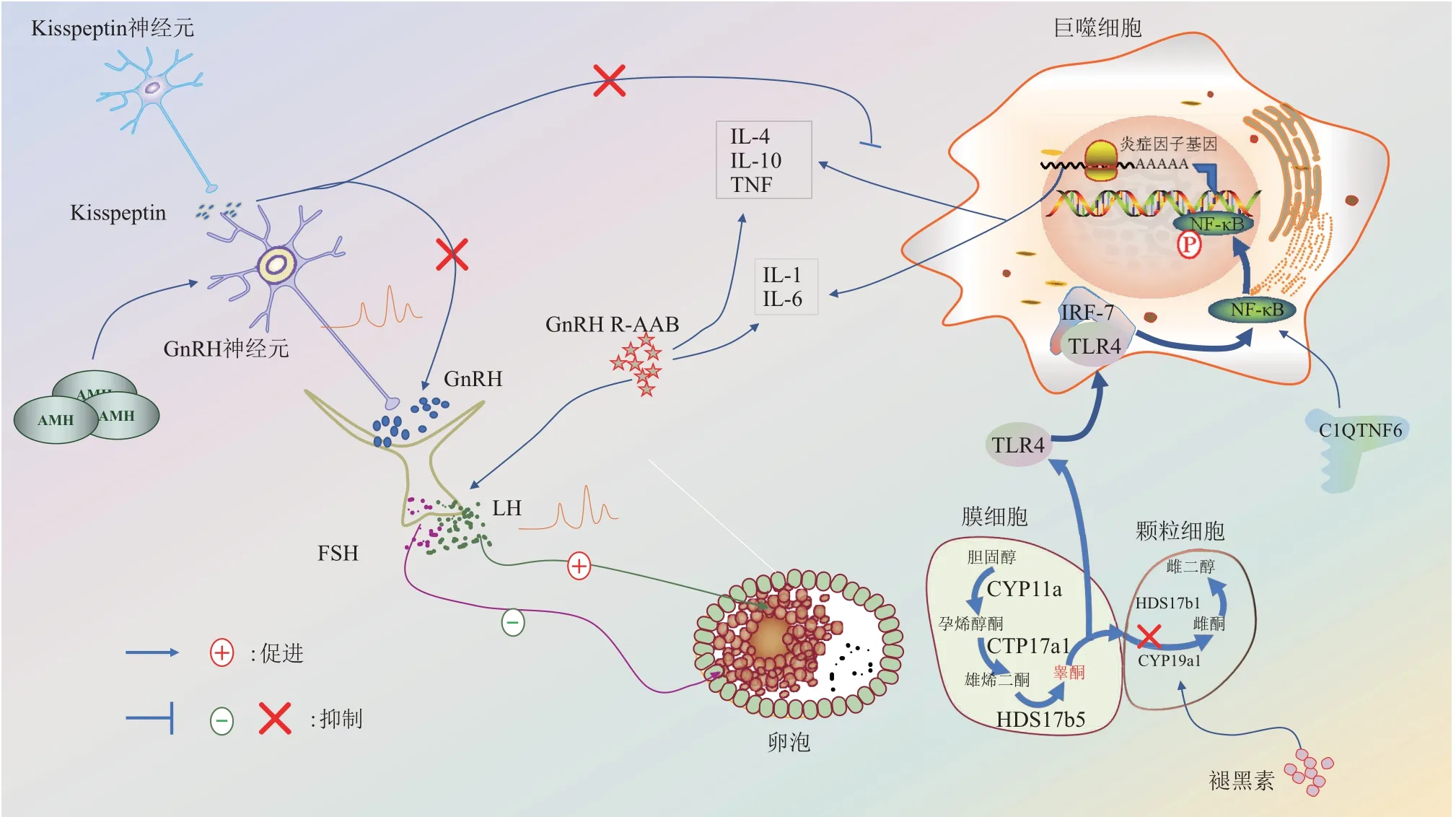
Fig.1 Kisspeptin,AMH,and melatonin regulate high androgen-related inflammation in PCOS图1 Kisspeptin、AMH、褪黑素调节PCOS中高雄激素相关炎症
此外,负责调节激素和代谢节律的中心机制被破坏使得LH平均水平和脉冲频率升高,驱动卵泡膜细胞合成性类固醇,从而导致HA,异常高频率LH脉冲反映GnRH神经回路过度活跃,表明PCOS的病因或表型存在神经内分泌基础,同时暗示GnRH脉冲频率及其神经网络上游发生变化,特别是GnRH 神经元和Kisspeptin 神经元,以及最近被定义为GnRH/LH 脉冲发生器的KNDy 细胞(表达kisspeptin、神经激肽B(neurokinin B,NKB)和强啡肽(dynorphin,Dyn))[8]。
2 不同因素对雄激素相关炎症的影响
HA 是PCOS 导致不孕的主要原因,长期持续暴露于高雄激素环境可导致卵泡发育障碍及内分泌紊乱。由于LH/FSH水平异常增高促进雄激素水平增高,而雄激素反馈调节下丘脑抑制FSH 释放而促进LH 水平,最终导致LH/FSH、雄激素水平逐渐增高。高雄激素刺激卵巢慢性低级别炎症,激活NLRP3 炎性小体[9],进而诱发卵巢颗粒细胞炎性死亡、卵泡功能障碍和卵巢间质细胞纤维化等一系列病理变化。经过DHT 处理的大鼠血清炎症标志物(TNF-α、IL-6、IL-1)水平增高,卵巢多核巨细胞和淋巴细胞聚集,提示高雄激素状态可诱导炎症[10]。而且研究证实[7],雄激素可以通过激活卵巢NF-κB 通路,促进相关炎症指标水平增高,导致炎症反应,提示炎症可能是PCOS发病的重要因素之一。另有报道[11],雄激素激活TLR4/IRF-7/NF-κB信号通路,导致PCOS患者子宫内膜低度慢性炎症的发生,该信号通路可被二甲双胍抑制。最新研究表明,二甲双胍除了可以通过减低胰岛素敏感性、降低雄激素水平外,还可以逆转相关炎症因子,在改善PCOS 代谢失调中发挥重要作用[12]。这些研究结果提示,HA可促进炎症的形成,使得PCOS患者卵泡发育异常,导致不孕。
产前雄激素暴露导致KNDy神经元及其传入网络发生改变[8],电针亦可刺激下丘脑Kisspeptin 蛋白表达[13-14],高水平Kisspeptin 不仅可促进GnRH表达,改善PCOS激素水平变化,还可抑制炎症因子表达,改善细胞凋亡[15],从而挽救PCOS 妇女的排卵[16],另外Kisspeptin受体激动剂也有治疗女性生殖障碍的潜力[17]。长期暴露于雄激素可影响线粒体功能,导致细胞凋亡和自噬失衡[18],而这一现象可以被褪黑素改善[19]。这些研究结果提示,HA导致的炎症与上游神经元相关因子表达变化有关(图1)。
2.1 低水平Kisspeptin促进GnRH、LH的释放,有利于雄激素相关的炎症形成
Kisspeptin 神经元位于下丘脑弓状核(arcuate nucleus,ARC) 和前腹侧室周核(anteroventral periventricular nucleus,AVPV),主要调控GnRH神经元脉冲频率和幅度,影响性激素的生成和反馈。位于ARC 的Kisspeptin 神经元除了表达Kisspeptin 外,还共表达NKB 和Dyn 两种神经肽,因此被称为KNDy 神经元[20]。正常生理情况下,KNDy 神经元激活引起低频率GnRH 脉冲,导致FSH增加,促进卵泡募集和发育,KNDy神经元活性下调和AVPV 的Kisspeptin 神经元激活产生高频率GnRH 脉冲,引起LH 分泌增加,促进排卵。PCOS 中GnRH 神经元的传入调节器发生改变,构成该疾病高频率GnRH 和LH 分泌潜在病理基础[21]。PCOS 小鼠弓形核中LH 脉冲异常活跃,Kisspeptin和神经激肽B基因表达升高[22],有助于PCOS 的神经内分泌机制的研究。在队列研究[23]中发现,PCOS 患者FSH、性激素结合球蛋白和kisspeptin 水平明显低于对照组,LH、游离睾酮、17-OH-黄体酮、硫酸脱氢表雄酮、雌二醇和游离雄激素指数显著增高,回归分析显示PCOS患者血浆Kisspeptin水平降低,与LH、雌二醇水平呈正相关。PCOS 条件下GnRH 和LH 的脉冲性增加可能是位于下丘脑-垂体轴中GnRH 刺激性和抑制性神经递质改变的累积效应,这也是多囊卵巢综合征女性抑郁和焦虑类情绪障碍的常见原因[9]。提示Kisspeptin 通过调节GnRH 脉冲频率和幅度调控性激素水平,参与PCOS性激素复杂的内分泌系统调节系统。
内质网应激涉及多种慢性病理条件,ROS、TLR 配体和细胞因子等促炎症刺激可以触发内质网应激,从而导致适应性未折叠蛋白反应(unfolded protein reaction,UPR)激活,进一步放大炎症反应。内质网应激-UPR-炎症反应是肥胖、胰岛素抵抗和2 型糖尿病之间的关键联系。据报道[24],Kisspeptin在调节UPR通路及其参与的雄激素相关的下丘脑神经元细胞内质网应激中具有意想不到的作用。该研究检测了PCOS患者、大鼠模型血浆和下丘脑神经元细胞中激素的表达,发现PCOS 女性血浆中睾酮水平较高,Kisspeptin 水平低于非PCOS 女性;PCOS 大鼠模型下丘脑中的Kisspeptin 表达显著下调,UPR 通路被激活;抑制或敲低GT1-7细胞系Kisspeptin可模拟DHT对下丘脑神经元UPR 通路的增强作用[24]。又有研究发现[25],在痛经时,Kisspeptin 与LH 脉冲分泌的时间偶联,支持PCOS 的神经内分泌障碍可影响Kisspeptin与LH脉冲的偶联,并可能随着疾病的进展而恶化这一论述。病例回顾性分析[26]发现,Kisspeptin可能通过调节LH水平进而在PCOS患者排卵障碍中发挥重要作用,并通过调节糖脂代谢影响机体能量平衡。除了上文所提到的Kisspeptin 减少可促进雄激素相关的慢性炎症的形成,还有证据显示Kisspeptin 可以直接抑制NK 细胞IL-4、IL-10和IFN 的产生[27],抑制炎症进程,但是这一进程在PCOS 中是否存在还需要进一步研究。由此可知,Kisspeptin不仅可以通过影响LH的释放,引发雄激素相关炎症,影响PCOS的进程,而且可以直接通过NK 细胞调节炎症的发生,但是其在PCOS中的具体作用还亟待进一步研究。
2.2 AMH激活GnRH神经元导致HA,可能与雄激素相关炎症有关
PCOS 女性体内AMH 水平不断升高归因于卵泡发生过程中窦卵泡的异常募集。实验证明[28],小鼠和人类都有一个显著的GnRH神经元子集表达AMH受体,AMH与受体结合能有效激活GnRH神经元放电。有结果显示,血清Kisspeptin 水平在PCOS 患者和正常女性相似,但与PCOS 患者血清AMH 水平呈正相关[29]。结合体内和体外实验发现,AMH 增加了LH 依赖的GnRH 的脉动和分泌,促进雄激素水平的增高,支持AMH 对GnRH 神经元的中枢作用,导致PCOS的HA。暴露于AMH的雌性小鼠GnRH 神经元活动增加,LH 脉冲频率和雄激素水平增加,AMH 通过激活GnRH 神经元发挥中枢调控作用,最终导致母亲和胎儿均发生HA。因此,近几年出现了一种新型PCOS 高雄激素血症模型,即出生前暴露于过量AMH[30]。
与在高雄激素水平环境中发育的雌性后代一样,产前暴露于AMH 的老鼠也会在成年期呈现PCOS 表型,虽然AMH 给药和外源性雄激素是否作用于相同的细胞和分子途径现在还不清楚,但是这种新型动物模型给PCOS的研究提供了更多的可能性。现有的研究显示,AMH 可以激活GnRH 神经元促进雄激素的释放,促进PCOS的形成,且上文阐述了高雄激素与PCOS 慢性炎症形成息息相关,但是并没有直接的证据证明AMH导致的高雄激素与PCOS 的炎症有关,根据现有文献猜测,AMH 可能会参与PCOS 雄激素相关炎症的形成,但是这还需要实验进一步证实。
2.3 GnRH及其受体参与雄激素相关炎症的形成
下丘脑GnRH 脉冲性分泌到垂体前叶触发LH和FSH 的合成和释放,然后作用于卵巢以调节类固醇生成、卵泡生成和排卵[31],在调节生殖功能的神经内分泌控制中起关键作用。GnRH除了控制LH 分泌的脉冲频率,还调节促性腺激素亚基mRNA 表达和LH 合成,从而有助于一定时间内LH 的绝对量释放量(即基础水平)及脉冲幅度的增加,进而促进雄激素的生成。对产前雄激素暴露的雌性小鼠与对照鼠相比,GnRH神经元动作电位放电活动增加[30],这与GnRH 神经元的GABA 输入数量增加有关。此外,GnRH神经元突触后电流的GABA能频率和幅度都增加,表明GnRH神经元的GABA 能驱动增强[30]。GABA 通过激活GABA受体促使GnRH 神经元兴奋,增高LH 水平,表明GnRH神经元的过度活跃驱动了PCOS样模型中LH分泌。而且Tata 等[30]发现,持续过度刺激雌性小鼠GnRH神经元可干扰其后代内分泌活动,但接受GnRH 拮抗剂治疗后神经内分泌表型可恢复正常。低水平Kisspeptin、高水平AMH 及GABA 都可以通过兴奋GnRH 神经元调节LH 分泌的脉冲频率及幅度,使得睾酮水平增高,有利于炎症的形成,促进PCOS的发生发展。
此外,最近发现一个研究和治疗PCOS的新靶点——促性腺激素释放激素受体(GnRHR)激动性自身抗体(AAb)。GnRHR 是7 次跨膜G 蛋白偶联受体(GPCR)家族的成员,介导细胞对多种刺激的反应,并参与多种生理和病理过程,是一种针对GPCR 的功能性新型自身免疫抗体[32]。在大鼠中诱导GnRHR-AAb 导致LH 的脉动性、睾酮浓度以及炎症因子(TNF、IL-1、IL-18)增加,扰乱动情周期,增加闭锁卵泡,激活垂体和卵巢的胰岛素信号[33-34]。这些变化复制了PCOS患者表型,提示GnRHR-AAb 可能参与了PCOS 的发病机制。最新研究表明,PCOS 不孕患者的血清GnRHR-AAb 活性明显高于排卵不孕症患者,其血清GnRHR-AAb活性升高与睾丸激素和促炎细胞因子增高有关[35]。自身抗体主要充当变构受体激动剂或拮抗剂靶向结合相关受体,持续促进或阻断受体信号传导,从而促进疾病的发病机制。最近在一项回顾性研究中证明[36],GnRHR 的 激 动 性AAb 存 在 于PCOS 患 者中,并且可能与病理生理相关,因为它们具有持续激活GnRHR 的潜力。作为新发现的PCOS 相关因子,GnRHR-AAb可以通过影响HPO的功能、胰岛信号及炎症因子等水平调节PCOS的形成,虽然其具体机制现在还不清楚,但其具有作为检测和治疗PCOS 新标志物的潜能,为PCOS 的诊断和治疗提供了一个新的可能。
2.4 褪黑素关联炎症因子受体降低雄激素水平,改善卵母细胞质量
褪黑激素(N-乙酰-5-甲氧基色胺)是一种由松果体合成和分泌的吲哚胺,分布在各种组织中,包括女性生殖系统[37]。其以在昼夜节律(睡眠-觉醒周期)中的功能而闻名[38]。作为一种强大的抗氧化剂和自由基清除剂,褪黑激素还具有多种生殖益处,例如抗生殖细胞的氧化应激、延缓卵巢衰老、促进卵母细胞成熟和促进胚胎发育[39]。褪黑激素可以通过与受体(melatonin receptors,MTR)结合来调节卵巢功能[40],或者直接螯合氧和氮活性物质,并在没有受体的情况下动员细胞内抗氧化酶[41],消除自由基,具有显着的抗氧化作用[37]。
褪黑素还可以通过黄体化颗粒细胞的细胞外信号调节激酶途径,上调细胞色素P450家族19亚家族A1成员的表达,加快雄性激素向17-雌二醇的转化[42],降低雄激素水平。还有研究表明,PCOS大鼠MT1R/MT2R、雌激素受体及细胞因子受体表达下调,IL-6、TNF-α水平升高,而补充褪黑素后这些细胞因子表达模式和循环水平得到恢复,提示MT1R/MT2R 可以通过细胞因子IL-2R 和IL-6R 调节雌激素的生成[43]。一项临床回顾实验表明,褪黑素治疗6 个月后AMH 水平显著下降,几乎95%的参与者月经周期和雄激素水平得到改善[44]。说明褪黑素可以从调节类固醇激素的转化、抑制炎症来改善卵母细胞质量,可以被认为是PCOS潜在的治疗药物。
2.5 C1QTNF6可能是一个良好的新诊断靶点
C1q 和TNF 相关基因6(C1QTNF6)或C1q/TNF相关蛋白(CTRPs)是新发现的与炎症相关的脂联素副产物,参与糖脂代谢、宿主炎症和器官发生的新型脂肪因子。研究表明[45],PCOS患者血清和卵巢颗粒细胞中的C1QTNF6、TNF、IL-6、CRP表达显著升高,雄激素诱导的PCOS模型血清和卵巢中也观察到C1QTNF6 等出现了相似的变化,而且结果还证实C1QTNF6通过AKT/NF-κB信号通路影响炎症反应,参与PCOS 的发病机制。在包括120例PCOS患者和60例健康对照的病例-对照研究中,确定了血清CTRP6 水平与PCOS 患者代谢综合征的某些成分之间的关系,所有受试者中PCOS组与对照组相比,血清脂联素水平显著降低,空腹胰岛素、胰岛素抵抗稳态模型评估、游离睾酮、hs-CRP 水平均显著升高,血清CTRP6 与体重指数呈正相关[46];也有研究显示,脂联素、CTRP12和CTRP13水平的降低和肥胖无关,都可以独立预测PCOS[47]。这一发现表明,CTRP6可影响雄激素相关炎症,揭示了CTRP6 在PCOS 发病机制中的可能作用,成为一个良好的潜在诊断靶点。然而其在PCOS中的具体生理机制,还需进一步验证。
3 总结和展望
PCOS是复杂的综合性内分泌疾病,育龄期妇女因卵泡发育异常导致不孕,但是其具体机制现在还不清楚。下丘脑GnRH激活促使垂体分泌FSH和LH,使得LH/FSH 增高,雄激素生成增多,转化为雌激素路径受阻导致HA,是PCOS 卵泡发育异常导致不孕的关键生理现象。Kisspeptin、AMH、GnRH-AAB 可以通过影响GnRH 神经元促使雄激素水平增高,HA 引起炎症因子TNF、IL 的增高,炎症形成有利于PCOS的发生发展。褪黑素作为一个潜在的治疗靶点,可通过改善雄激素水平及炎症,缓解PCOS 的进程。之前对于PCOS 的研究着重在下丘脑-垂体-性腺轴,近几年倾向神经、内分泌、免疫、代谢多系统综合研究,但是其具体机制还没解释清楚。本文综述了神经-内分泌调节和炎症因子之间的联系,发现下丘脑上游神经可通过调节HPO促使HA形成,进而导致炎症的发生,参与PCOS 的发生发展,同时褪黑素、GnRH-AAB、C1QTNF6 可能是PCOS 治疗或诊断的新靶标,希望这可以给PCOS的研究提供一些新的思路。

