定量脑电图联合经颅多普勒超声对动脉瘤蛛网膜下腔出血后迟发性脑缺血的预测价值研究
齐丽霞,李自如,姚远,2,朱润秀
脑血管疾病主要分为出血性脑血管疾病和缺血性脑血管疾病,蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是常见的出血性脑血管疾病。虽然SAH仅占急性脑卒中的10%、出血性脑卒中的20%,但其死亡率高达40%,且50%~66%的患者会遗留终身残疾[1-2]。SAH的病因较多,其中动脉瘤蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)占70%~80%[3]。aSAH的病理生理学变化较复杂,临床症状轻重不一,其特征性表现为剧烈头痛,且病情来势凶猛,进展非常迅速,临床转归复杂,常见并发症有再出血、迟发性脑缺血(delayed cerebral ischemia,DCI)、脑积水、癫痫等[4]。近年随着手术技术的提高及神经血管成像、神经介入和神经重症监护领域的发展,aSAH患者再出血问题已得到很好的控制,但DCI仍是影响患者生存率和生活质量的主要原因[5]。国内外有研究采用经颅多普勒超声(transcranial doppler ultrasound,TCD)、定量脑电图(quantitative electroencephalography,QEEG)单独预测DCI,但TCD的预测效能受年龄、性别、颅内压、血二氧化碳浓度等的影响[6],故其阴性预测值较高[7];QEEG虽然较传统脑电图直观、便于观察,但其对临床工作者的专业技术要求较高。因此,本研究将TCD和QEEG联合,以期提高临床医生对aSAH患者发生DCI的预测价值。
1 对象与方法
1.1 研究对象 选取2019年12月至2021年1月内蒙古自治区人民医院神经内科和神经外科收治的aSAH患者54例,均符合《中国蛛网膜下腔出血诊治指南2015》[8]中的aSAH诊断标准,并经颅脑CT和/或脑脊液检查结果证实为SAH,经颅脑CTA和/或DSA检查证实颅内有明确责任动脉瘤。以患者发病后14 d或出现DCI为观察终点,将其分为DCI组16例和非DCI组38例。DCI判定标准参照《脑血管痉挛防治神经外科专家共识》[9]及文献[10],具体如下:出现新的局灶性神经功能缺损(如偏瘫、偏盲、失用、失语)、颅内压增高表现(如头痛、呕吐等)或意识障碍进行性加重(格拉斯哥昏迷量表评分下降≥2分)持续1 h,伴或不伴脑血管痉挛,且排除电解质紊乱、癫痫发作、再出血、脑积水加重等。本研究通过内蒙古自治区人民医院伦理委员会审核通过(编号:202103412L)。
1.2 纳入与排除标准 纳入标准:(1)年龄≥18岁;(2)发病至入院时间<48 h。排除标准:(1)合并颅内、外大血管狭窄或闭塞者;(2)QEEG、TCD检查前服用镇静催眠类药物、麻醉药、抗精神病药物、抗癫痫药物者;(3)合并可影响颅内脑电活动的疾病,如代谢性脑病、炎症性脑病、帕金森、帕金森综合征及其他系统恶性疾病者;(4)既往有脑卒中病史,且改良Rankin量表评分≥1分;(5)既往有精神疾病史或不能配合本研究者。
1.3 研究方法 收集所有患者基线资料及入院后24 h内QEEG、TCD检查结果。基线资料包括性别、年龄、吸烟史、饮酒史、高血压病史、糖尿病病史、卒中或短暂性脑缺血发作(transient ischemic attack,TIA)病史、改良Fisher分级[11]及改良Hunt-Hess分级[12]。改良Fisher分级、改良Hunt-Hess分级标准详见表1~2。采集原始脑电图和处理后的QEEG,所用仪器为美国Cadwell公司生产的数字化脑功能监护仪,指标包括相对δ功率(relative delta power,RDP)、相对θ功率(relative theta power,RTP)、相对α功率(relative alpha power,RAP)、相对β功率(relative beta power,RBP)、α/δ比值(alpha/delta ratio,ADR)、(α+β)/(δ+θ)比值〔(alpha+ beta)/(delta+ theta)ratio,ABDTR〕及相对α变异。TCD检查采用2.0 MHz脉冲多普勒探头,由于SAH多影响双侧大脑,且判断颅内血管痉挛时大脑中动脉显示较佳,故记录所有患者左、右大脑中动脉收缩期血流速度(systolic velocity,Vs)、舒张期血流速度(diastolic velocity,Vd)并取均值,计算平均血流速度(mean velocity,Vm)和搏动指数(pulsatility index,PI);Vm=(Vs+2Vd)/3,PI=(Vs-Vd)/Vm。

表1 改良Fisher分级标准Table 1 Modified Fisher grading criteria

表2 改良Hunt-Hess分级标准Table 2 Modified Hunt-Hess grading criteria
1.4 统计学方法 应用SPSS 25.0统计学软件进行数据处理。计量资料以(±s)表示,组间比较采用成组t检验;计数资料以相对数表示,组间比较采用χ2检验;aSAH患者发生DCI的影响因素分析采用多因素Logistic回归分析;并进一步绘制ROC曲线以评估ADR、大脑中动脉Vm及其联合对aSAH患者发生DCI的预测价值。以P<0.05为差异有统计学意义。
2 结果
2.1 基线资料 两组患者性别、年龄、改良Hunt-Hess分级及有吸烟史、饮酒史、高血压病史、糖尿病病史、卒中或TIA病史者占比比较,差异无统计学意义(P>0.05);两组患者改良Fisher分级比较,差异有统计学意义(P<0.05),见表3。
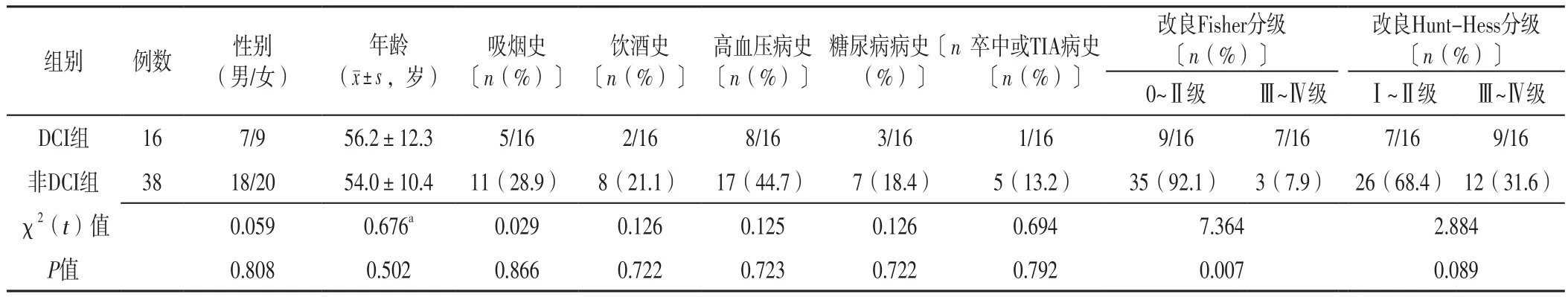
表3 DCI组和非DCI组患者基线资料比较Table 3 Comparison of baseline data between the DCI group and the non-DCI group
2.2 QEEG、TCD检查结果 两组患者RDP、RAP、ADR、相对α变异及大脑中动脉Vs、Vm、PI比较,差异有统计学意义(P<0.05);两组患者RTP、RBP、ABDTR及大脑中动脉Vd比较,差异无统计学意义(P>0.05),见表4。
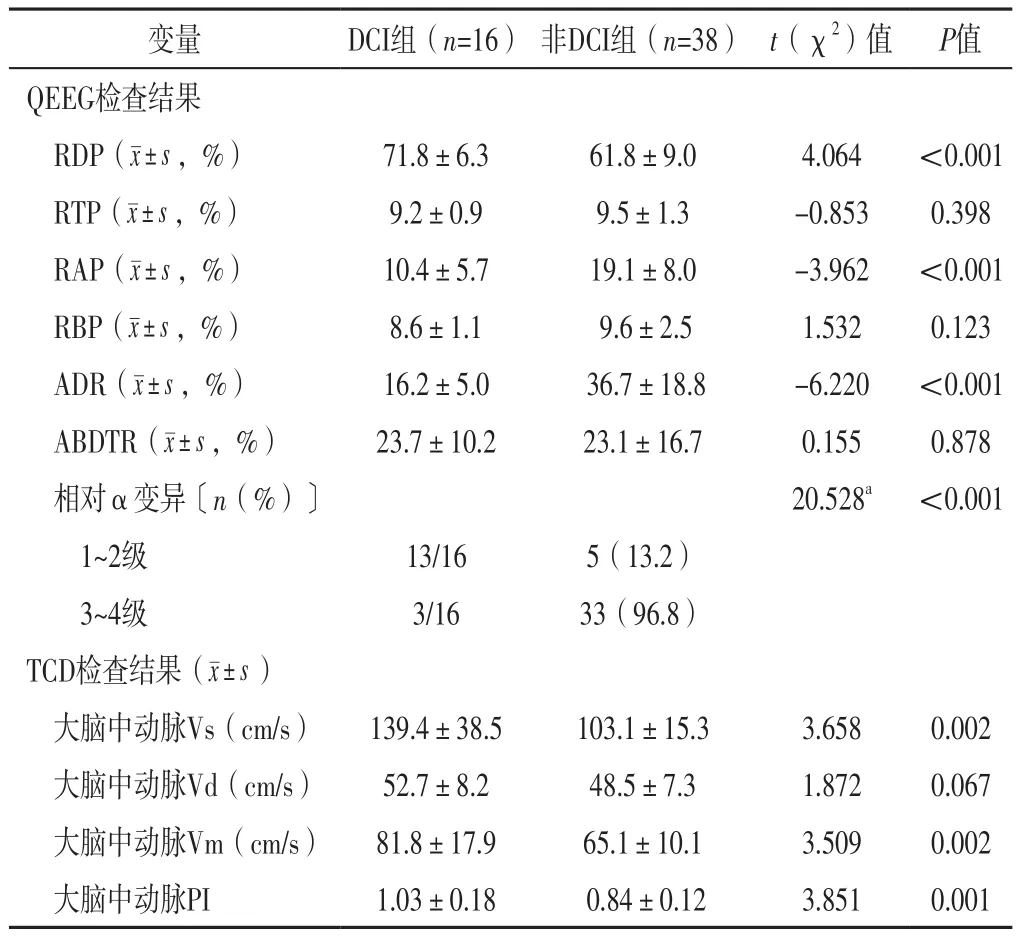
表4 DCI组和非DCI组患者QEEG、TCD检查结果比较Table 4 Comparison of QEEG and TCD examination results between the DCI group and the non-DCI group
2.3 多因素Logistic回归分析 将表3~4中差异有统计学意义的指标作为自变量,DCI发生情况作为因变量(赋值:未发生=0,发生=1),进行多因素Logistic回归分析,结果显示,ADR及大脑中动脉Vm是aSAH患者发生DCI的影响因素(P<0.05),见表5。
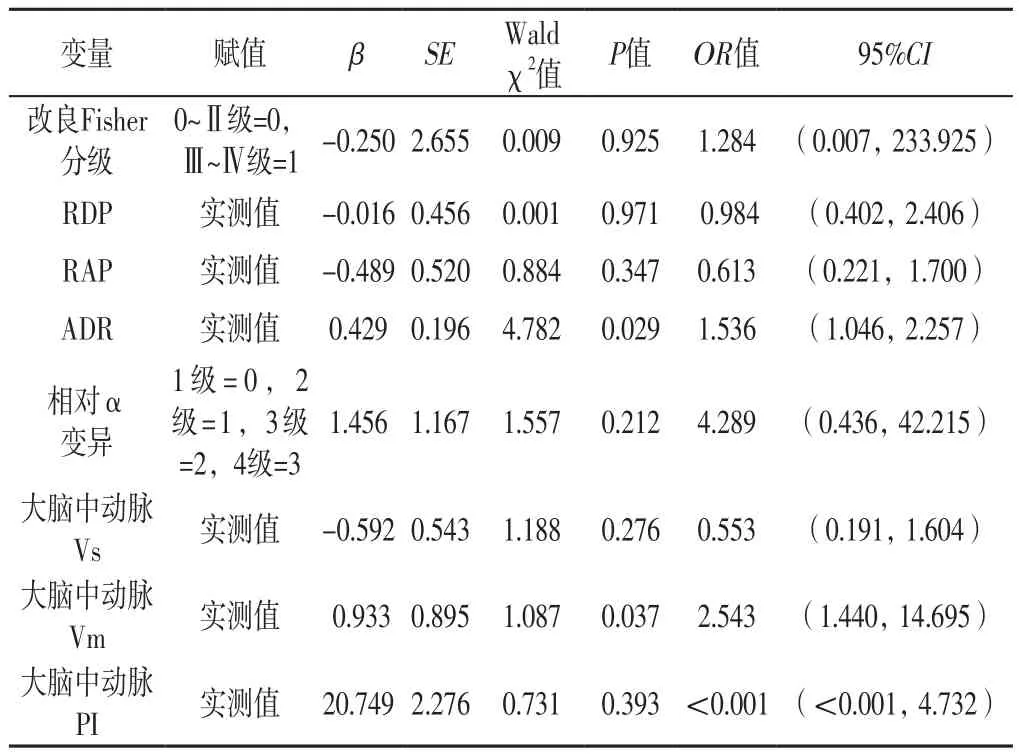
表5 aSAH患者发生DCI影响因素的多因素Logistic回归分析Table 5 Multivariate Logistic regression analysis on influencing factors of DCI in patients with aSAH
2.4 ROC曲线 ROC曲线分析结果显示,ADR联合大脑中动脉Vm预测aSAH患者发生DCI的AUC为0.946〔95%CI(0.888,1.000)〕,ADR预测aSAH患者发生DCI的AUC为0.844〔95%CI(0.714,0.913)〕,大脑中动脉Vm预测aSAH患者发生DCI的AUC为0.771〔95%CI(0.624,0.919)〕,见图1。ADR联合大脑中动脉Vm预测aSAH患者发生DCI的AUC分别高于ADR、大脑中动脉Vm,差异有统计学意义(Z值分别为1.97、2.19,P值分别为0.048、0.029)。
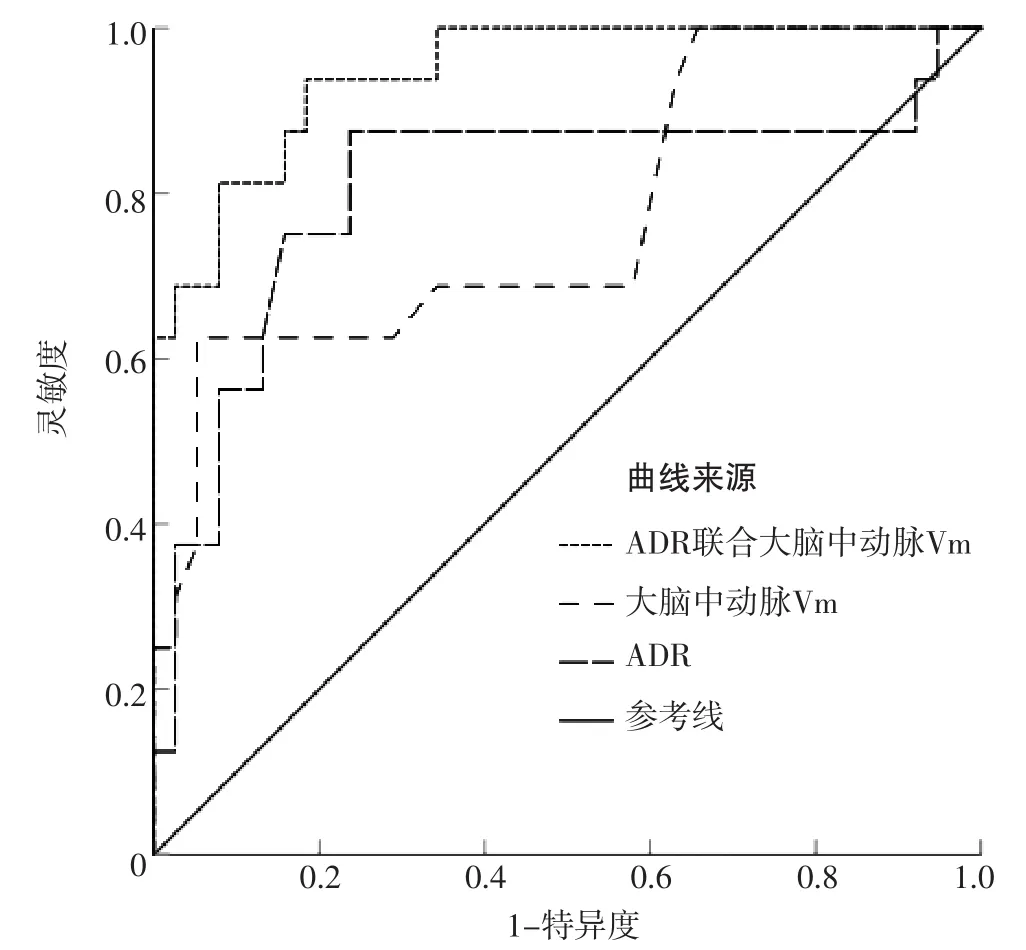
图1 ADR、大脑中动脉Vm及其联合对aSAH患者发生DCI的预测价值Figure 1 Predictive value of ADR,middle cerebral artery Vm and their combination for the DCI in patients with aSAH
3 讨论
研究表明,Fisher分级、Hunt-Hess分级与DCI发生有关[13];但本研究结果显示,仅改良Fisher分级是aSAH患者发生DCI的影响因素,与PLATZ等[14]研究结果一致。改良Fisher分级、改良Hunt-Hess分级相对简便,但二者均依赖颅脑CT检查结果并受检查者主观因素影响,故其准确性有待进一步探究。
目前,临床上常用的DCI预测方法包括脑灌注压、MRA、CTA、DSA、QEEG及TCD,其中脑灌注压为有创检查,MRA需要搬动患者,CTA及DSA既为有创检查且费用较高,故在临床中应用较少;QEEG和TCD为无创检查,可以床旁操作、重复检查,易被患者接受,是目前临床中应用较多的检查手段。
研究表明,连续脑电图监测可以较好地预测aSAH后DCI的发生情况,且对梗死后认知障碍具有一定预测价值[15],但由于原始脑电数据庞大,耗费人力、物力等,导致其在临床应用受限。近年来,QEEG的出现实现了床旁实时监测。既往研究发现,ADR衰减与α波变异可作为DCI的预测因子,具有一定特异性,其可以在颅脑CT显示缺血性改变前发现患者病情恶化[16-18];CLAASSEN等[19]研究发现,总功率、相对α功率、相对δ功率、ADR及ABDTR等指标中仅ADR能更好地预测DCI的发生,连续监测过程中ADR 6次较基线下降超过10%,其预测DCI的灵敏度为100%、特异度为76%;单次监测较基线下降超过50%,其预测DCI的灵敏度为89%、特异度为84%。本研究结果显示,两组患者RDP、RAP、ADR、相对α变异比较有统计学差异,但多因素Logistic回归分析结果发现仅ADR是aSAH患者发生DCI的影响因素。
TCD主要通过血管口径变化导致血流速度改变,从而识别大脑血管痉挛;此外,该检查还可以观察血流频谱变化,当出现湍流频谱伴海鸥鸣时,提示存在血管痉挛,易并发脑梗死[20]。本研究结果显示,两组患者大脑中动脉Vs、Vm及PI比较有统计学差异,但多因素Logistic回归分析结果显示,仅大脑中动脉Vm是aSAH患者发生DCI的影响因素。CHANG等[21]研究结果显示,aSAH患者入院后2~7 d大脑中动脉Vm增加可能与DCI发生独立相关,本研究结果与之基本一致。本研究结果还显示,ADR联合大脑中动脉Vm预测aSAH患者发生DCI的AUC为0.946,分别高于ADR(AUC=0.844)、大脑中动脉Vm(AUC=0.771)。
BUDOHOSKI等[22]研究结果显示,DCI常于aSAH后 3~5 d出现,7~10 d达到高峰,2周后逐渐缓解。因此,本研究以aSAH后14 d为观察终点,且发现16例DCI患者发病时间集中在aSAH后2~6 d,这对探索、确定DCI发生最小时间窗具有一定参考价值。如果能掌握aSAH后DCI发生的最小时间窗,就可以缩短监测时间,进而提高患者的配合程度并节约医疗资源。
综上所述,ADR、大脑中动脉Vm是aSAH患者发生DCI的影响因素,ADR联合大脑中动脉Vm对aSAH患者发生DCI的预测价值较高。但本研究为单中心研究、样本量较小,且未对大脑中动脉之外的其他颅内、外血管血流频谱进行分析,未来仍需要联合多中心、扩大样本量进一步验证本研究结论并积极探索更多的预测指标。
作者贡献:齐丽霞、朱润秀进行文章的构思与设计,结果分析与解释;朱润秀进行研究的实施与可行性分析;齐丽霞、李自如、姚远、朱润秀进行数据收集、整理、分析;齐丽霞负责撰写、修订论文;姚远、朱润秀负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。

