血清胰岛素样生长因子1、白介素17、白介素23水平与新生儿缺氧缺血性脑病患儿疾病严重程度及预后的关系研究
卢艳辉,刘振奎,王雅莉,高娇娇,曹燕玲,孙喜斌,王艳飞,郭卫平
新生儿缺氧缺血性脑病(hypoxic ischemic encephalopathy,HIE)是由母胎或新生儿疾病等多种原因导致的新生儿脑组织缺血缺氧性损伤,其发病率约为0.86%,但致死率高达20%~25%;此外,治疗后患儿可能存在神经系统后遗症,严重影响患儿的生长发育[1-3]。目前,CT、MRI等影像学检查对新生儿HIE的诊断和预后预测具有较高价值,但存在动态监测困难、新生儿HIE早期临床症状不明显、漏诊率高等局限性。既往研究表明,白介素(interleukin,IL)-17/IL-23炎症轴与慢性阻塞性肺疾病继发肺部感染、脑出血继发性炎症损伤有关[4-5],但其与新生儿HIE的关系尚不清楚。本研究旨在探讨血清胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)、IL-17、IL-23水平与新生儿HIE患儿疾病严重程度及预后的关系,现报道如下。
1 对象与方法
1.1 研究对象 选取2019年7月至2021年7月河北北方学院附属第一医院儿内科收治的新生儿HIE 87例作为研究对象,均符合新生儿HIE的诊断标准[6],参照改良的Sarnat标准判断疾病严重程度,并将患儿分为轻-中度组(n=52)和重度组(n=35);另选择同期本院正常足月新生儿87例作为对照组。三组胎龄、性别、出生体质量、体温、心率及分娩方式比较,差异无统计学意义(P>0.05),见表1。本研究经河北北方学院附属第一医院医学伦理委员会审核批准(批准编号:W2022008),三组新生儿家属均对本研究知情同意。1.2 新生儿HIE患儿的纳入与排除标准 纳入标准:(1)足月单胎;(2)母亲为初产妇,既往体健;(3)出生6 h内经CT及MRI检查证实为新生儿HIE;(4)出生后60 min内脐动脉血pH值<7,出生体质量为2~4 kg;(5)出生后10 min Apgar评分≤5分。排除标准:(1)母亲妊娠前存在宫内感染、严重贫血、高危妊娠等情况;(2)伴有先天性脑部发育不良、胆红素脑病、颅内出血;(3)因持续性肺动脉高压、产伤等多种原因引起抽搐;(4)中途转院。
表1 三组一般资料比较Table 1 Comparison of general data among the three groups
1.3 治疗方法 参考《2018昆士兰临床指南:缺氧缺血性脑病》,所有患儿出生6 h内给予吸氧、维持生命体征、纠正水电解质紊乱等常规对症支持治疗及亚低温治疗,亚低温治疗措施具体如下:患儿平躺在红外线辐射台上,鼻咽部和肛门处放置温度计,采用特制的冰帽裹住患儿头部,使鼻咽部温度为33 ℃,肛温为34 ℃,低温治疗维持72 h[6]。治疗结束后,通过红外线辐射使体温以0.5 ℃/h速度复温,维持6 h。治疗期间每小时监测血压、体温、尿量,治疗结束后行神经系统检査,临床医师可根据患儿具体情况使用奥拉西坦、单唾液酸四己糖神经节苷脂钠、胞二磷胆碱等常规药物治疗。
1.4 观察指标 (1)血清IGF-1、IL-17、IL-23水平。所有患儿及正常足月新生儿于入组1 d内空腹采血5 ml,3 000 r/min离心5 min(离心半径为12.5 cm),留取血清,于-20 ℃冰箱中保存待测。采用酶联免疫吸附试验检测血清IGF-1、IL-17、IL-23水平,均由医院检验科医师严格按照试剂盒说明书进行操作。(2)预后情况。本研究将死亡、放弃治疗后死亡定义为预后不良。
1.5 统计学方法 采用SPSS 21.0统计学软件进行数据处理。符合正态分布的计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,两组间比较采用成组t检验;计数资料以相对数表示,组间比较采用χ2检验。新生儿HIE患儿血清IGF-1、IL-17、IL-23水平与疾病严重程度的关系采用Spearman秩相关分析;绘制ROC曲线以评价血清IGF-1、IL-17、IL-23水平及三者联合对新生儿HIE患儿预后的预测价值,AUC比较采用Delong检验。以P<0.05为差异有统计学意义。
2 结果
2.1 三组血清IGF-1、IL-17、IL-23水平比较 三组血清IGF-1、IL-17、IL-23水平比较,差异有统计学意义(P<0.05);轻-中度组和重度组血清IGF-1水平低于对照组,血清IL-17、IL-23水平高于对照组,差异有统计学意义(P<0.05);重度组血清IGF-1水平低于轻-中度组,血清IL-17、IL-23水平高于轻-中度组,差异有统计学意义(P<0.05),见表2。
表2 三组血清IGF-1、IL-17、IL-23水平比较(±s)Table 2 Comparison of serum levels of IGF-1,IL-17 and IL-23 among the three groups
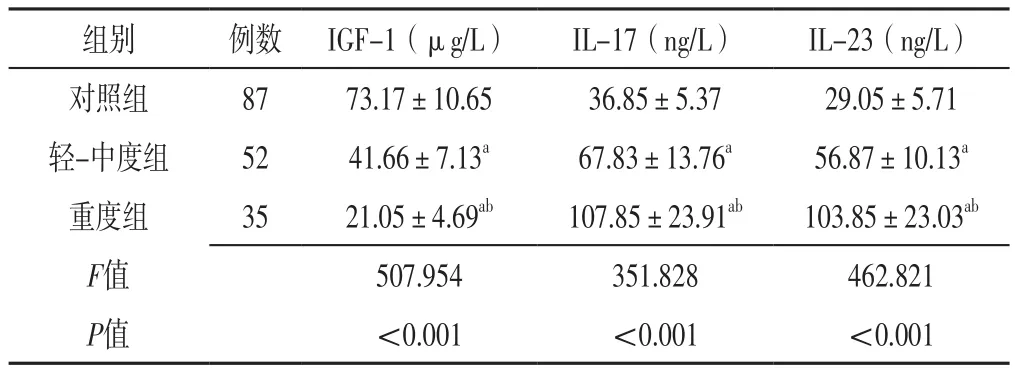
表2 三组血清IGF-1、IL-17、IL-23水平比较(±s)Table 2 Comparison of serum levels of IGF-1,IL-17 and IL-23 among the three groups
注:IGF-1=胰岛素样生长因子1,IL=白介素;a表示与对照组比较,P<0.05;b表示与轻-中度组比较,P<0.05
组别 例数 IGF-1(μg/L) IL-17(ng/L) IL-23(ng/L)对照组 87 73.17±10.65 36.85±5.37 29.05±5.71轻-中度组 52 41.66±7.13a 67.83±13.76a 56.87±10.13a重度组 35 21.05±4.69ab 107.85±23.91ab 103.85±23.03ab F值 507.954 351.828 462.821 P值 <0.001 <0.001 <0.001
2.2 新生儿HIE患儿血清IGF-1、IL-17、IL-23水平与疾病严重程度的相关性 Spearman秩相关分析结果显示,新生儿HIE患儿血清IGF-1水平与疾病严重程度呈负相关(rs=-0.572,P<0.001),血清IL-17、IL-23水平与疾病严重程度呈正相关(rs值分别为0.511、0.558,P值均<0.05)。
2.3 不同预后患儿血清IGF-1、IL-17、IL-23水平比较87例患儿中,预后不良23例。预后良好患儿血清IGF-1水平高于预后不良患儿,血清IL-17、IL-23水平低于预后不良患儿,差异有统计学意义(P<0.05),见表3。
表3 不同预后患儿血清IGF-1、IL-17、IL-23水平比较(±s)Table 3 Comparison of serum levels of IGF-1,IL-17 and IL-23 in children with different prognosis

表3 不同预后患儿血清IGF-1、IL-17、IL-23水平比较(±s)Table 3 Comparison of serum levels of IGF-1,IL-17 and IL-23 in children with different prognosis
预后 例数 IGF-1(μg/L) IL-17(ng/L) IL-23(ng/L)不良 23 18.75±5.19 125.67±21.33 110.75±21.80良好 64 40.83±8.53 73.38±12.65 60.06±8.59 t值 11.638 13.990 15.642 P值 <0.001 <0.001 <0.001
2.4 血清IGF-1、IL-17、IL-23水平及三者联合对HIE患儿预后的预测价值 ROC曲线分析结果显示,血清IGF-1水平预测新生儿HIE患儿预后的AUC为0.785〔95%CI(0.715,0.943)〕,血清IL-17水平预测新生儿HIE患儿预后的AUC为0.655〔95%CI(0.513,0.794)〕,血清IL-23水平预测新生儿HIE患儿预后的AUC为0.710〔95%CI(0.583,0.857)〕,三者联合预测新生儿HIE患儿预后的AUC为0.895〔95%CI(0.835,0.971)〕。三者联合预测新生儿HIE患儿预后的AUC分别大于血清IGF-1、IL-17、IL-23水平单独预测新生儿HIE患儿预后的AUC,差异有统计学意义(Z值分别为-2.377、-2.478、-2.421,P值均<0.05),见表4、图1。
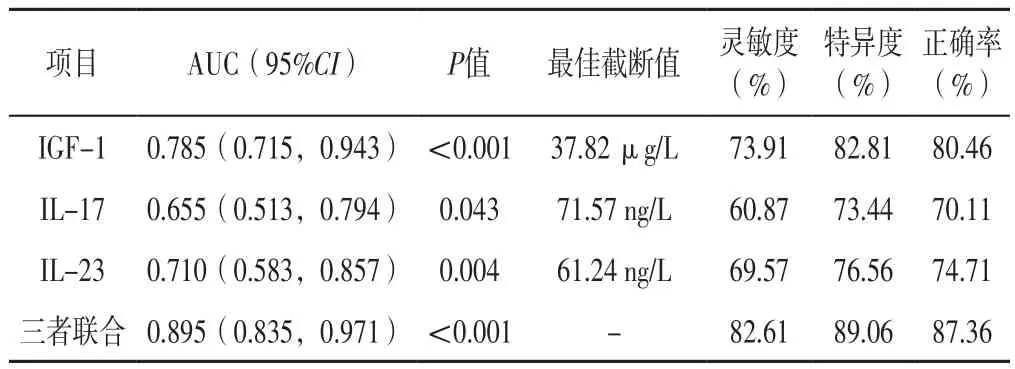
表4 血清IGF-1、IL-17、IL-23水平及三者联合对新生儿HIE患儿预后的预测价值Table 4 Value of serum IGF-1,IL-17,IL-23 levels and their combination in predicting prognosis of children with neonatal HIE
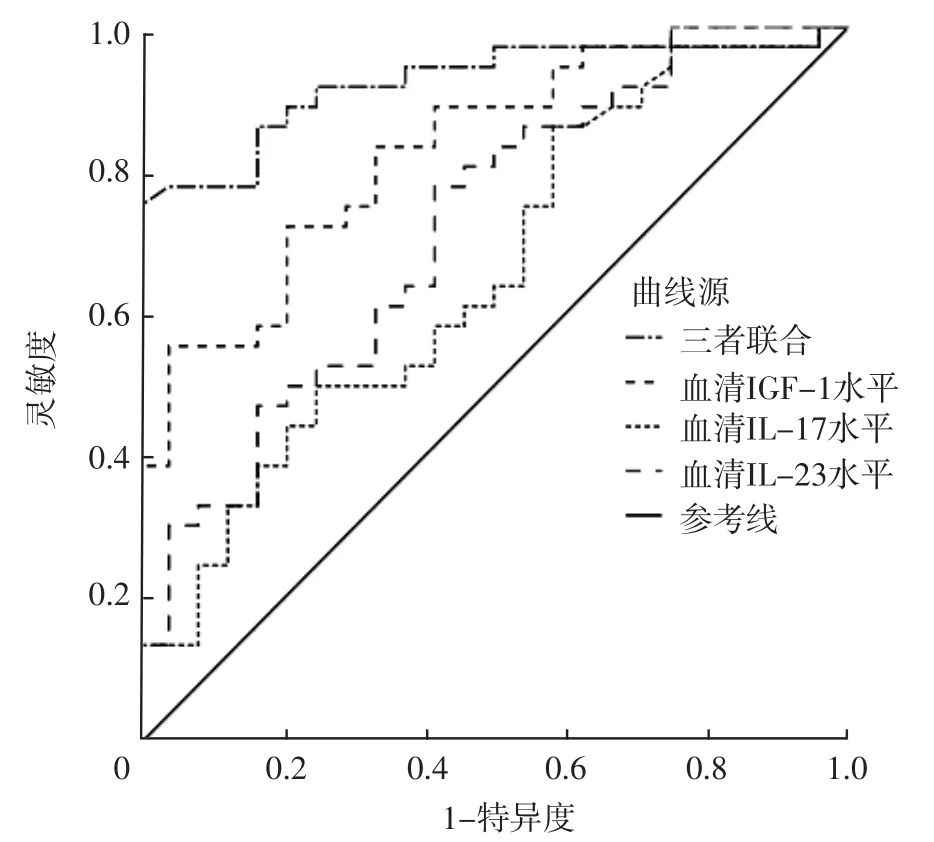
图1 血清IGF-1、IL-17、IL-23水平及三者联合预测HIE患儿预后的ROC曲线Figure 1 ROC curve of serum levels of IGF-1,IL-17,IL-23 and their combination for predicting the prognosis of children with neonatal HIE
3 讨论
新生儿HIE致病机制复杂,可能与再灌注损伤、细胞能量代谢、神经元坏死或凋亡、血流动力学改变、胶质细胞激活有关,严重者甚至导致患儿死亡[7]。现有研究表明,促炎因子是导致HIE患儿神经系统损伤的重要途径,缺血脑组织可激活小胶质细胞,促进肿瘤坏死因子、IL-6等多种炎性因子分泌,进一步损伤受损的神经元,造成不可逆转的神经损伤,进而对患儿预后产生不良影响[8-9]。因此,早期干预新生儿HIE对减少其神经系统后遗症具有重要意义。
IGF-1是一种有4个结构域的神经营养因子,可调控机体糖原和蛋白质合成、脂质分解、细胞增殖等多种生理功能,其通过特定的受体转导途径及信号通路而促进相关神经蛋白酶表达,使神经元增殖,激活星形胶质细胞,抑制兴奋性氨基酸神经毒性,进而起到修复受损神经元的作用;同时,其还能调节脑血流量,促进缺血坏死脑组织血管新生,具有神经保护作用[10-12]。本研究结果显示,轻-中度组和重度组血清IGF-1水平低于对照组,重度组血清IGF-1水平高于轻-中度组;且新生儿HIE患儿血清IGF-1水平与疾病严重程度呈负相关。分析其原因可能为:新生儿HIE疾病严重程度越重,则患儿脑组织损伤越严重,机体在应激状态下促使IGF-1聚集到受损脑组织并进行积极修复,进而使血清IGF-1水平下降。
研究表明,IL-23/IL-17炎症轴在脑出血、脑梗死及多重耐药感染患者中呈高表达,其能反映疾病感染状态及转归情况[13-14]。IL-17是辅助性T细胞17(T helper cell 17,Th17)分泌的炎症微调因子,可促进中性粒细胞成熟,激活下游炎症因子共同参与HIE的发生、发展[15];其可反映脑胶质瘤、急性脑梗死等脑损伤患者的炎症状态,是部分脑损伤患者早期诊断和预后预测的有效指标[16-17]。IL-23能促使Th17分泌IL-17,形成免疫级联效应,与IL-17一同加剧新生儿HIE患儿缺血脑组织炎症反应,导致患儿神经系统损伤加重[18-19]。本研究结果显示,轻-中度组和重度组血清IL-17、IL-23水平高于对照组,重度组血清IL-17、IL-23水平高于轻-中度组;且新生儿HIE患儿血清IL-17、IL-23水平与疾病严重程度呈正相关;表明血清IL-17、IL-23水平越高则新生儿HIE患儿疾病严重程度越重,可能原因为:脑组织缺血缺氧破坏了血-脑脊液屏障,使小胶质细胞外溢,促使Th17、中性粒细胞等炎症细胞进入缺血脑组织,释放更多的IL-17,同时IL-23表达增高,协同IL-17进一步加剧患儿炎症反应,导致神经元进一步凋亡,进而加重患儿病情。
本研究患儿经积极治疗后仍有23例(占26.4%)预后不良,与李花等[20](21.8%)、王俊姬等[21](25.0%)研究结果相似,表明新生儿HIE患儿死亡风险较高。本研究结果显示,预后良好患儿血清IGF-1水平高于预后不良患儿,血清IL-17、IL-23水平低于预后不良患儿,且三者联合预测新生儿HIE患儿预后的AUC分别大于血清IGF-1、IL-17、IL-23水平单独预测新生儿HIE患儿预后的AUC,表明三者联合对新生儿HIE患儿预后具有一定预测价值,且IL-23/IL-17炎症轴可能成为新生儿HIE的治疗靶点。
综上所述,血清IGF-1水平与新生儿HIE患儿疾病严重程度呈负相关,血清IL-17、IL-23水平与新生儿HIE患儿疾病严重程度呈正相关,且三者联合对新生儿HIE患儿预后具有一定预测价值。
作者贡献:卢艳辉进行文章的构思与设计,论文的撰写与修订;刘振奎进行研究的实施与可行性分析,负责文章的质量控制及审校;高娇娇、曹燕玲、孙喜斌、郭卫平进行资料收集;王雅莉、王艳飞进行资料整理、统计学处理;卢艳辉、刘振奎对文章整体负责、监督管理。
本文无利益冲突。

