内源性刺激响应策略在肿瘤精准诊疗中的应用
赵 旭,王孟超,张抗抗,严秀平1,2,
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.江南大学 国际食品安全联合实验室,江苏 无锡 214122;3.江南大学 食品学院,分析食品安全学研究所,江苏 无锡 214122)
癌症严重威胁人类的生命健康,如何实现肿瘤精准诊断和治疗是亟待解决的科学难题。肿瘤微环境较正常机体环境具有低pH值、乏氧、高谷胱甘肽(GSH)含量、过表达酶以及氧化应激增加等系列异常特征[1-3]。这些内源性差异为肿瘤精准诊疗体系的构建和发展提供了可能。内源性刺激响应型诊疗剂可对肿瘤微环境产生快速、精准应答,提高诊疗剂的肿瘤选择性及诊疗信噪比,从而实现增强疗效的同时极大地降低副作用。因此,内源性刺激响应型诊疗剂已逐渐成为肿瘤精准诊疗领域的研究热点。近年来,基于不同内源性刺激响应的诊疗剂已被广泛开发[4-6]。本文从不同内源性刺激角度,综述了近年来发展的刺激响应型诊疗剂的设计原理及研究进展,并展望了该领域面临的问题及发展趋势。
1 p H响应型
受肿瘤细胞过度增殖以及异常的血管结构影响,肿瘤组织的代谢过程以无氧糖酵解为主,导致肿瘤微环境具有弱酸性。实体瘤细胞外微环境的pH值为6.5~6.8,内吞囊泡具有更强的酸性(早期内涵体pH 5.5~6.5,晚期内涵体或溶酶体的pH低至5.0~5.5)[7-8]。弱酸性微环境对肿瘤侵袭、免疫、自噬以及耐药性产生等过程起促进和调节作用[9],因此也成为肿瘤精准诊疗的重要靶点。目前已有大量基于肿瘤弱酸性特性设计合成pH响应型诊疗剂的报道[10-11]。pH响应型诊疗剂的响应机制主要可概括为酸碱敏感基团的质子化/去质子化[12-13]、酸敏感化学键的断裂[14-15]以及酸敏感无机物的降解[16-17]。
分子中引入酸碱敏感的基团,不同pH条件下上述基团发生质子化/去质子化,使得分子结构、亲-疏水性、体积以及空间构象等发生改变,进而实现肿瘤精准诊断以及靶向给药等,是构建pH响应型诊疗剂的常用策略之一。例如,Zhao等[18]设计合成了系列pH可逆激活型不对称菁类荧光/光热/光动力(FL/PTT/PDT)一体化分子,用于肿瘤精准诊断及治疗(图1)。该类分子中未被取代的氮原子进入肿瘤弱酸性微环境后被质子化,使得探针分子由碱式体转变为酸式体形式,伴随着分子内电荷诱导转移产生,进而激活探针分子的荧光。肿瘤特异性荧光成像指引下施加808 nm激光照射,激活光热/光动力性能,进而实现精准成像指引的特异性治疗。Wang等[19]报道了细胞内酸激活性多功能胶束,用于耐药肿瘤的光热/化疗协同治疗(图2)。胶束由键合有光敏剂的pH响应的二嵌段共聚物(PDPC)和阿霉素聚合前药(PDOX)组成。胶束在血液循环过程保持稳定,内吞进入细胞后弱酸微环境诱导胶束质子化进而发生解离,从而激活荧光成像及治疗功能。

图2 酸响应胶束的组成及原理示意图[19]Fig.2 Structural composition and schematic diagram of the acid-switchable micelles[19]
选用pH敏感的化学键(如腙键、酯键、亚氨键、β-羧基酰胺键等)作为桥基构建诊疗探针,该类结构在正常体液条件下可稳定存在,到达肿瘤部位后pH敏感的桥联基团发生水解断裂,进而实现肿瘤靶向成像及治疗是构建pH响应型诊疗剂的另一常用策略[14-15,20]。其中,β-羧基酰胺键具有酸敏感的水解特性,可实现肿瘤微环境触发的电荷反转。正常生理条件下,β-羧基酰胺键末端羧基的存在使其带负电;在肿瘤弱酸性微环境下酰胺键断裂,裸露出的-NH2被质子化呈现出正电性,进而满足了长血液循环和肿瘤靶向等环节对材料所带电荷的不同需求。
虽然pH响应型诊疗体系已大量涌现且展现了良好的应用前景,但该研究仍处于起步阶段,诊疗体系及其降解/代谢产物的生物安全性、pH响应的不可逆性以及肿瘤组织不同部位pH差异对结果灵敏性的影响等诸多问题仍需解决。
2 乏氧响应型
肿瘤细胞过度增殖以及异常血管结构造成的又一微环境特征是氧含量降低(乏氧)[21-22]。基于肿瘤组织处含氧量低这一特性,近年来涌现出大量乏氧响应型精准诊疗策略。其中,设计乏氧响应型前药以及乏氧响应型智能载药体系是最为常见的策略。
乏氧响应型前药的设计策略主要是在药物分子骨架中引入易被还原基团(如硝基、醌、氮氧化物、过渡金属等),这些基团在肿瘤乏氧区域被还原酶还原,使得原本无毒或低毒的前体物质转变为高毒性的还原型代谢产物,进而实现肿瘤细胞的高选择性杀伤。例如,Wang等[23]设计合成了整合素功能化的装载吲哚菁绿(ICG)和乏氧激活型药物替拉扎明(TPZ)的聚乳酸-羟基乙酸脂质纳米体系(图3)。将乏氧激活型药物TPZ装载于纳米载体中,不仅改善了TPZ的生物相容性,还提高了其肿瘤部位的渗透和靶向富集能力。近红外光激发下,ICG分子将氧气分子转变为单线态氧,在发挥光动力治疗作用的同时进一步加剧了肿瘤部位的乏氧,进而激活TPZ发挥化学治疗作用,实现光动力-化疗协同治疗。

图3 乏氧激活型纳米平台用于肿瘤光动力-化疗协同治疗示意图[23]Fig.3 Illustration of the hypoxia-activated nanoplatform for tumor photodynamic-chemotherapy synergistic therapy[23]
乏氧响应型载药体系主要依赖于在聚合物载体中引入硝基咪唑、偶氮苯片段或者金属配合物等乏氧敏感片段[24-25]。例如,Yang等[24]利用酰胺缩合反应制得光敏剂二氢卟吩改性人血清白蛋白(HC)以及化疗药物奥沙利铂改性人血清白蛋白(HO),进一步以偶氮苯为桥基将两者交联制备了乏氧响应型纳米诊疗体系。肿瘤乏氧微环境下连接基团偶氮苯还原断裂,该纳米诊疗体系降解为HC和HO,实现了肿瘤靶向荧光成像指引的化疗-光动力协同治疗。
乏氧响应策略虽展现出较好的肿瘤精准治疗的应用前景,但乏氧环境一般存在于深层肿瘤组织[21-22],因此限制了此类响应型诊疗剂的广泛应用。如何增强诊疗体系的肿瘤组织穿透能力和乏氧敏感性是待解决的难题。
3 氧化还原响应型
内源性氧化还原物种通过形成一个复杂的抗氧化防御系统来调节氧化还原平衡,影响细胞生长、增殖以及凋亡等多阶段。其中,过氧化氢(H2O2)和GSH是最具代表性的内源性氧化还原物质,已被作为有效的“调节因子”和“靶点”用于氧化还原响应型肿瘤诊疗平台的构建[26]。
H2O2响应型诊疗平台的设计策略可分为以下3类[26-28]:①提高氧气(O2)依赖型治疗模式的治疗效率。内源性的H2O2可在过氧化氢酶的作用下催化分解原位生成O2,从而缓解肿瘤微环境的乏氧状态,增强O2依赖型治疗策略(如光动力疗法、声动力疗法等)的疗效。②产生其他活性较高的活性氧或活性氮等,造成肿瘤细胞氧化损伤。H2O2可通过芬顿或类芬顿反应转化为羟基自由基等,导致脂质过氧化,DNA和蛋白质损伤。③含有H2O2敏感的化学键的反应型纳米平台。具有过氧化氢酶模拟活性的纳米材料已广泛应用于催化内源性H2O2原位自补给O2,如二氧化锰、氧化铈、金属有机框架、钯纳米颗粒等。
肿瘤微环境中过高含量GSH为氧化还原响应诊疗平台设计提供了又一靶点[29-30]。GSH响应型诊疗平台的设计策略主要是将GSH可裂解基团(如S-S、Se-Se、C-Se、Au-S等)插入到诊疗探针或载体的结构骨架中。值得注意的是,GSH可消耗H2O2催化氧化产生的活性氧(ROS)等,进而降低疗效。因此,增加ROS水平的同时耗尽GSH,最大程度地扩增肿瘤氧化应激是最具前景的设计策略[26,31]。
H2O2和GSH在肿瘤组织不同部位存在浓度差异以及H2O2随治疗过程耗竭等问题制约了氧化还原响应型诊疗体系的深入发展[26,31]。
4 酶响应型
酶活性失调和异常表达与许多疾病的发生息息相关。肿瘤组织较正常组织过表达一些特定的酶(如金属基质蛋白酶、组蛋白酶B、磷脂酶以及透明质酸酶等)[32-33]。以过表达的内源性酶为生物触发器,构建酶响应型精准诊疗平台,已成为近年来的研究热点[34-36]。酶响应型诊疗平台的设计原则主要是依赖于酶对其底物的高选择性和水解特性。将酶特异性底物作为桥联基团、载体或门控开关等构建智能诊疗体系,在高浓度酶作用下酶底物被水解切断,诊疗体系发生偶联键断裂或解组装等进而使结构和性质发生改变,实现肿瘤特异性诊治。Wang等[33]设计了肿瘤细胞内酯酶响应型纳米载药系统。该智能载药系统在血液循环过程中保持稳定,在富含酯酶的肿瘤微环境下高效释放7-乙基-10-羟基喜树碱,显著提升了该药物在肿瘤内的蓄积。
酶响应型诊疗体系具有良好的灵敏性和特异性,但在不同肿瘤或同种肿瘤的不同发展时期,过表达酶的种类和水平存在较大差异。同种酶亦存在不同亚型,同一家族酶的底物也存在类似性[34,36]。因此,需要发现更优的肿瘤特异性酶,设计更为巧妙的响应型策略以提高诊疗的准确性和灵敏性。
5 双/多刺激响应型
基于内源性刺激响应的智能诊疗平台展现了良好的应用前景,但如上所述,单一刺激响应策略存在一些不足,限制了其进一步应用和发展。为此,双刺激/多刺激响应策略应运而生,并逐渐成为内源性刺激响应型诊疗平台的研究热点和发展趋势[37-40]。Fu等[31]开发了一种具有产生H2O2及清除GSH功能的纳米催化诊疗剂,实现了pH、H2O2、GSH和葡萄糖氧化酶(GOx)等多因素调控的饥饿/化学动力学/化疗协同治疗(图4)。采用仿生矿化的方法,以聚乙二醇修饰的GOx(PEG-GOx)为模板制备了铜离子掺杂的磷酸钙纳米粒子(PGC),进一步装载抗癌药阿霉素(DOX)制得PGC-DOX。肿瘤的弱酸性微环境诱导磷酸钙壳层降解释放出GOx、Cu2+及DOX。GOx催化肿瘤内葡萄糖产生H2O2,消耗肿瘤内营养物质葡萄糖,实现饥饿治疗的同时为后续的类芬顿反应提供了原料。Cu2+与GSH反应的还原产物Cu+通过类芬顿反应将H2O2转化成强毒性的·OH,实现化学动力学治疗。同时,Cu2+与GSH之间的氧化还原反应还可清除GSH,以避免其消耗活性氧等物质,进一步增强化学动力学疗效。
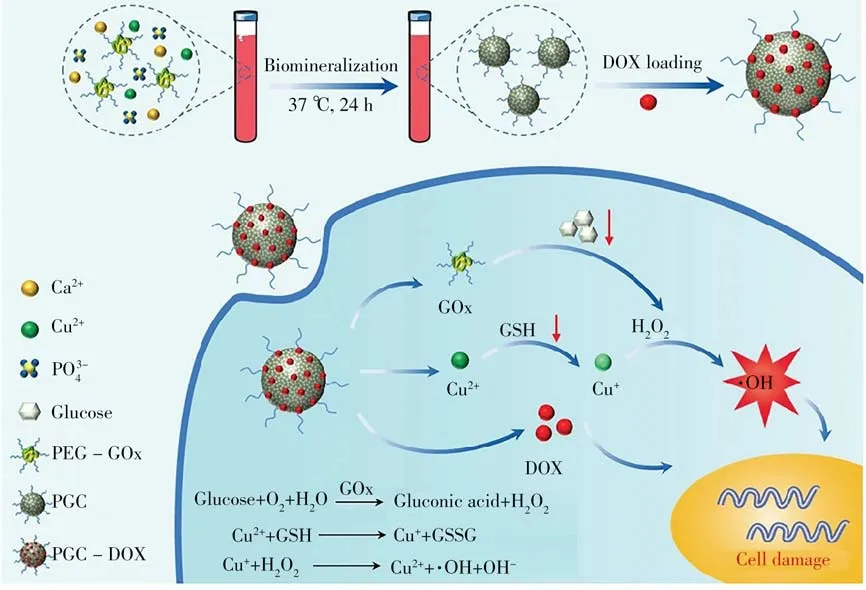
图4 诊疗平台PGC-DOX制备及多刺激介导的饥饿/化学动力学/化疗协同治疗示意图[31]Fig.4 Illustration of the preparation process and therapeutic mechanism of PGC-DOX theranostics platform for multi-stimuli mediated starvation/chemodynamic/chemotherapy cooperative therapy[31]
不同刺激响应策略巧妙融合构建的双刺激/多刺激响应型诊疗体系展现出更智能、更全面的疗效。但复杂的制备流程,不同组分间的交叉影响以及复合材料的生物安全性等问题给该类诊疗剂的应用和临床转化带来了更多困扰。
6 结论与展望
肿瘤微环境较正常组织的显著差异为肿瘤精准诊疗平台的构建及研发提供了广阔空间和替代靶点。目前,大量微环境响应型诊疗平台已被开发。然而,现有微环境响应型诊疗研究大多停留于基础研究和起步阶段,复杂的制备流程,复合材料的稳定性及生物安全性等极大地限制了该类诊疗剂的进一步发展。因此,设计构建组分简单、制备工艺简便、易于放大生产、稳定性和安全性良好的多重响应型智能诊疗平台,将更具研究及应用价值。此外,将内源性刺激响应策略与外源性刺激(如光、磁、声等)巧妙结合,设计更智能、更精准、更灵敏的诊疗平台,亦具有较好的应用前景。
- 分析测试学报的其它文章
- Research Progress of Hemicyanine Dye for Molecular Imaging
- 碱性磷酸酶的体外检测和体内成像研究进展
- Recent Progress in Nanoscale MOFs for Biological Imaging of Tumors and Tumor Markers
- I-Motif-based Nanosystems for Biomedical Applications:p H Imaging,Drugs Controlled Release and Tumor Theranostics
- A Low-cost,Automated Nucleic Acid Extraction System Converted from the Open-Source Rep Rap 3D Printer
- Research Progress on Analytical Methods for Deciphering Adenosine-to-inosine RNA Editing

