普罗布考联合依那普利叶酸片治疗早期糖尿病肾病的效果观察
张玉静,刘艳玲
(邢台市人民医院肾内科,河北 邢台 054001)
糖尿病肾病(DKD)是糖尿病常见的一种微血管并发症,也是威胁糖尿病患者生命安全的主要原因之一。早期DKD 患者的临床症状不明显,其尿液中的白蛋白较少。此病患者随着病情的加重可出现大量蛋白尿,若治疗不及时可进展为终末期肾病。目前临床上主要是对DKD 患者进行控制血糖、降血压、纠正脂质代谢紊乱及控制饮食等治疗。研究指出,对DKD 患者进行上述常规治疗虽然能在一定程度上改善其血流动力学指标,减少其蛋白尿,但很难延缓其病情的进展[1]。近年来随着临床上对DKD 发病机制研究的不断深入,发现氧化应激在糖尿病及其并发症的发生、发展中起到重要作用[2]。陶珍珍等[3]指出,同型半胱氨酸(Hcy)可通过降低腺苷酸的水平、增强局部的氧化应激反应、促进蛋白质Hcy 化、抑制DNA 甲基化等途径引起肾小球硬化,最终导致肾功能损伤。普罗布考最初作为调脂药应用于临床。后期的研究发现,普罗布考还具有强大的抗氧化作用,现阶段其已被广泛应用于心脑血管疾病的治疗中[4],但用其治疗DKD 的研究报道较少。依那普利叶酸片是一种新型的降压药,主要用于治疗伴有高Hcy 血症的高血压。依那普利叶酸片可有效降低血Hcy 的水平,减轻机体的氧化应激损伤。本文将我院收治的100 例早期DKD 患者作为研究对象,探讨用普罗布考联合依那普利叶酸片治疗早期DKD 的效果。
1 资料与方法
1.1 一般资料
选取2017 年5 月至2019 年6 月期间我院收治的100 例早期DKD 患者作为研究对象。其纳入标准是:病情符合《中国2 型糖尿病防治指南(2013 年版)》[5]中关于2 型糖尿病的诊断标准,且糖化血红蛋白的水平≤7% ;病情符合《糖尿病肾病防治专家共识(2014 年版)》[6]中关于DKD的诊断标准及国际通行的Mogensen 糖尿病肾病分期标准中关于早期DKD 的诊断标准;尿微量白蛋白排泄率(UAER)为20 ~200 μg/min ;年龄为20 ~70 岁;近3 个月内未应用其他抗氧化剂;病历资料完整、真实、有效。其排除标准是:合并有糖尿病急性并发症、其他肾脏疾病、急性冠状动脉综合征或脑卒中;存在严重的心、肝、肺等器官功能障碍;合并有自身免疫性疾病、贫血或血小板异常;近3 个月内应用过糖皮质激素或免疫抑制剂;处于妊娠期或哺乳期。按照随机数表法将其分为常模组和治疗组,每组各有患者50例。在常模组患者中,有男性28 例,女性22 例;其平均年龄为(51.23±8.12)岁,糖尿病的平均病程为(10.59±3.67)年,DKD 的平均病程为(8.62±1.93)个月。在治疗组患者中,有男性29例,女性21 例;其平均年龄为(52.39±10.67)岁,糖尿病的平均病程为(11.33±4.29)年,DKD 的平均病程为(8.75±1.99)个月。两组患者的一般资料相比,差异无统计学意义(P>0.05)。本研究已通过我院医学伦理委员会的审核及批准,所有患者均知晓本研究内容,并签署了自愿参与本研究的知情同意书。
1.2 方法
对两组患者均进行降血糖(用胰岛素或口服类降糖药)、调脂(用他汀类药物)、控制饮食等常规治疗。在此基础上,用依那普利叶酸片(生产厂家:深圳奥萨制药有限公司;批准文号:国药准字H20103783 ;规格:10 mg:0.8 mg/ 片)对常模组患者进行治疗,其用法是:口服,1 片/ 次,1 次/d。用普罗布考片联合依那普利叶酸片(其药品信息及用法同上)对治疗组患者进行治疗。普罗布考片(生产厂家:承德颈复康药业集团有限公司;批准文号:国药准字H10960161;规格:0.25 g/ 片)的用法是:口服,2 片/ 次,2 次/d。两组患者均持续治疗12 周。
1.3 观察指标
治疗前后,比较两组患者的氧化应激指标,包括血红素氧合酶1(HO-1)、氧化低密度脂蛋白/β2- 糖蛋白Ⅰ(ox-LDL/β2-GP Ⅰ)、超氧化物歧化酶(SOD)和Hcy。上述指标的检测方法是:采集患者的外周静脉血,对血液标本进行离心处理,分离出血清。采用酶联免疫吸附试验(ELISA)检测血清中HO-1(试剂盒购自武汉华美生物工程有限公司)和ox-LDL/β2-GP Ⅰ(β2-GP Ⅰ多克隆抗体购自Chemicon 公司,羊抗人apoB 多克隆抗体购自金斯瑞生物科技股份有限公司)的水平,采用黄嘌呤氧化酶法检测血清中SOD(试剂盒购自南京建成生物工程研究所)的水平,采用酶循环法检测血清中Hcy(试剂盒购自北京九强生物技术股份有限公司)的水平。治疗前后,比较两组患者的肾功能指标,包括UAER 和血肌酐(Scr)。Scr 的检测方法是:采集患者清晨空腹状态下的外周静脉血,对血液标本进行离心处理,分离出血清。采用肌氨酸氧化酶法检测血清中Scr(试剂盒购自上海科华生物工程股份有限公司)的水平。采用HITACHI7600 自动生化分析仪和免疫散射比浊法检测患者的UAER,试剂盒购自英国朗道公司。治疗前后,比较两组患者血压(包括收缩压和舒张压)、血清总胆固醇(TC)、三酰甘油(TG)和空腹血糖的水平。采用袖带式血压计测量患者的血压,取两次测量结果的平均值作为最终结果。采用己糖激酶法检测患者的空腹血糖,试剂盒购自中生北控生物科技股份有限公司。TC、TG 的检测方法是:采集患者清晨空腹状态下的外周静脉血,对血液标本进行离心处理,分离出血清。采用日立自动化分析仪(7600 Automatic Analyzer)和放射免疫分析法检测血清中TC、TG 的水平,试剂盒购自北方生物研究所。比较两组患者治疗期间发生不良反应的情况。
1.4 统计学方法
用SPSS 19.0 软件处理本研究中的数据,计量资料用±s表示,用t检验,计数资料用% 表示,用χ² 检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 治疗前后两组患者氧化应激指标的比较
治疗前,两组患者血清HO-1、ox-LDL/β2-GP Ⅰ、Hcy、SOD 的水平相比,差异无统计学意义(P>0.05)。治疗后,常模组患者血清Hcy 的水平低于治疗前,其血清HO-1、SOD 的水平均高于治疗前,差异有统计学意义(P<0.05)。治疗前后,常模组患者血清ox-LDL/β2-GP Ⅰ的水平相比,差异无统计学意义(P>0.05)。治疗后,治疗组患者血清Hcy、ox-LDL/β2-GP Ⅰ的水平均低于治疗前,其血清HO-1、SOD 的水平均高于治疗前,差异有统计学意义(P<0.05)。治疗后,治疗组患者血清Hcy、ox-LDL/β2-GP Ⅰ的水平均低于常模组患者,其血清HO-1、SOD的水平均高于常模组患者,差异有统计学意义(P<0.05)。详见表1。
表1 治疗前后两组患者氧化应激指标的比较(± s

表1 治疗前后两组患者氧化应激指标的比较(± s
注:* 与本组治疗前比较,P <0.05 ;# 与常模组治疗后比较,P <0.05。
组别 时间 血清HO-1(mmol/L)血清ox-LDL/β2-GP Ⅰ(U/mL)血清Hcy(μmol/L)血清SOD(μ/mL)常模组(n=50) 治疗前 40.12±2.87 3.02±0.12 18.77±2.10 90.82±13.11治疗后 41.31±2.92* 3.00±0.18 17.19±1.94* 101.53±13.28*治疗组(n=50) 治疗前 40.35±3.07 3.04±0.15 18.83±2.44 91.30±12.66治疗后 43.04±2.81*# 2.67±0.17*# 15.84±2.35*# 113.25±14.07*#
2.2 治疗前后两组患者肾功能指标及血脂水平的比较
治疗前,两组患者的UAER、Scr、血清TC及TG 的水平相比,差异无统计学意义(P>0.05)。治疗后,两组患者的UAER、Scr、血清TC 和TG 的水平均低于治疗前,差异有统计学意义(P<0.05)。治疗后,治疗组患者的UAER、Scr、血清TC 和TG 的水平均低于常模组患者,差异有统计学意义(P<0.05)。详见表2。
表2 治疗前后两组患者肾功能指标及血脂水平的比较(± s
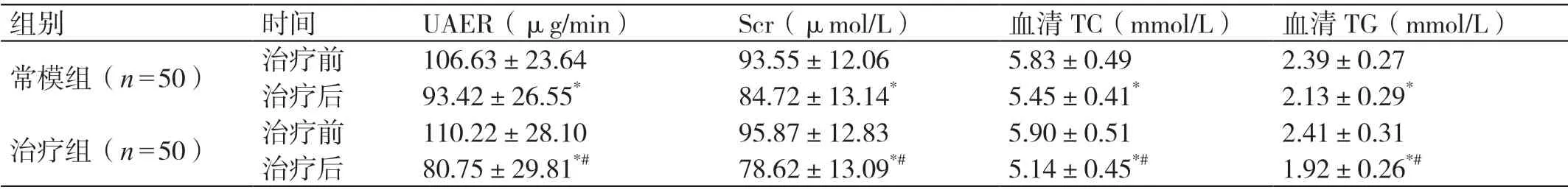
表2 治疗前后两组患者肾功能指标及血脂水平的比较(± s
注:* 与本组治疗前比较,P <0.05 ;# 与常模组治疗后比较,P <0.05。
组别 时间 UAER(μg/min) Scr(μmol/L) 血清TC(mmol/L) 血清TG(mmol/L)常模组(n=50) 治疗前 106.63±23.64 93.55±12.06 5.83±0.49 2.39±0.27治疗后 93.42±26.55* 84.72±13.14* 5.45±0.41* 2.13±0.29*治疗组(n=50) 治疗前 110.22±28.10 95.87±12.83 5.90±0.51 2.41±0.31治疗后 80.75±29.81*# 78.62±13.09*# 5.14±0.45*# 1.92±0.26*#
2.3 治疗前后两组患者血压及血糖水平的比较
治疗前,两组患者的收缩压、舒张压及空腹血糖的水平相比,差异无统计学意义(P>0.05)。治疗后,两组患者的收缩压、舒张压和空腹血糖的水平均低于治疗前,差异有统计学意义(P<0.05)。治疗后,治疗组患者的收缩压、舒张压和空腹血糖的水平均低于常模组患者,差异有统计学意义(P<0.05)。详见表3。
表3 治疗前后两组患者血压及血糖水平的比较(± s

表3 治疗前后两组患者血压及血糖水平的比较(± s
注:* 与本组治疗前比较,P <0.05 ;# 与常模组治疗后比较,P <0.05。
组别 时间 收缩压(mmHg) 舒张压(mmHg) 空腹血糖(mmol/L)常模组(n=50) 治疗前 136.83±10.49 80.23±5.63 11.39±0.27治疗后 125.45±8.41* 75.14±4.03* 8.13±0.29*治疗组(n=50) 治疗前 138.90±10.51 79.39±4.33 11.41±0.31治疗后 120.14±5.45*# 70.06±4.15*# 6.12±0.26*#
2.4 治疗前后两组患者发生不良反应情况的比较
治疗期间,两组患者中仅有1 例患者出现轻微干咳的症状,无需停药,未影响治疗。
3 讨论
DKD 是由于长期慢性高血糖所导致的肾脏损害,此病患者的主要特征是持续出现尿蛋白。出现微量蛋白尿是糖尿病患者肾脏损害的早期征兆,若未及时进行治疗,可进展为大量蛋白尿,并最终发展为终末期肾病。DKD 是引起终末期肾病的主要原因[7-8]。DKD 的发病机制复杂,涉及血管活性物质紊乱、氧化应激、肾脏纤维化、炎症反应等多种因素[9]。氧化应激是机体在受到多种病理因素的刺激后,导致体内的活性氧(ROS)产生过多、抗氧化能力下降,使机体正常的氧化还原状态失衡,进而导致蛋白质、脂质、核酸等生物大分子物质出现氧化损伤,以致干扰正常的机体功能。机体长期处于高糖环境可通过多元醇途径、糖基化蛋白产物途径等多种途径诱导细胞代谢紊乱,导致肾组织的氧化应激水平增高,使体内的ROS 过量蓄积。另一方面,肾组织的氧化应激水平增高又可导致抗氧化酶糖基化,使SOD、过氧化氢酶及谷胱甘肽过氧化物酶的活性下降,削弱机体清除氧自由基的能力,进而可加重肾脏损伤。近年来,越来越多的证据表明氧化应激在DKD 的发生、发展中起到关键作用[10-11]。朱勤等[12]研究发现,DKD 大鼠肾组织中HO-1 的表达下降,SOD 的活性降低,提示氧化应激可参与DKD 的发展。目前临床上治疗DKD 的方法主要是针对已知的危险因素(如高血糖、高血压、脂代谢紊乱及不健康的饮食结构和生活方式等)进行干预,但一些患者的疗效并不理想[13]。寻找新的治疗靶点及药物一直是DKD 研究领域的重点和热点。研究显示,普罗布考可减少DKD 患者的尿蛋白,改善其肾功能,对DKD 的发展具有延缓作用。将普罗布考与依那普利叶酸片联用,可产生协同增效的作用,能进一步改善DKD 患者的病情。Hcy 是一种血管损伤性氨基酸,高Hcy 可通过促进ROS 的大量产生而引起氧化应激损伤,进一步激活多元醇、晚期糖基化终末产物、己糖等,最终导致肾脏损伤。陆璟园等[14]研究发现,高Hcy 血症是血管病变的危险因素之一,可损伤血管内皮,增加DKD 的发生风险。ox-LDL/β2-GP Ⅰ是一种稳定的复合物,可逃避肝组织间叶细胞的识别和清除,能真实、准确地反映机体ox-LD 的水平及氧化应激状态。詹松军等[15]研究发现,随着DKD患者病情的发展,其血浆中ox-LDL/β2-GP Ⅰ的水平会逐步增高,对其进行彩色多普勒血流显像提示其肾脏的血流灌注逐渐减少。本研究中常模组患者在接受治疗后其血清Hcy 的水平下降,血清HO-1、SOD 的水平升高。原因分析在于,依那普利叶酸片是一种新型的复方制剂,其中含有的依那普利可抑制血管紧张素转换酶的活性,减少血管紧张素的生成,从而可降低肾小球毛细血管压,减少尿蛋白的滤过,并通过抑制高糖应激下转化生长因子-β1/Smad 通路而降低转化生长因子-β1的表达,减少ROS 的生成,减轻氧化应激损伤,进而可保护肾脏。叶酸在细胞内可转化为甲基四氢叶酸,而甲基四氢叶酸是Hcy 降解途径中再合成蛋氨酸的甲基供体,故摄入叶酸可降低血Hcy 的水平[16],有利于预防或延缓糖尿病微血管和大血管并发症的发生、发展。本研究中常模组患者接受治疗后其血清Hcy 的水平下降,考虑主要与叶酸的作用有关(叶酸一方面能直接减轻血管内皮损伤,另一方面还可减轻机体的氧化应激损伤)。普罗布考是一种人工合成的抗氧化剂,其分子中的酚羟基易被氧化而发生断裂,捕捉氧离子并与之结合,形成稳定的酚氧基,进而可有效降低血浆中氧自由基的浓度,抑制脂质过氧化反应,预防或延缓动脉粥样硬化的发生、发展。同时,普罗布考还可抑制尼克酰胺腺嘌呤二核苷酸磷酸的氧化活性,起到内源性抗氧化作用。普罗布考可诱导血HO-1 的表达,提高机体的抗氧化能力。因此,本研究中治疗组患者在加用普罗布考进行治疗后其血清ox-LDL/β2-GP Ⅰ的水平明显下降,血清HO-1 和SOD 的水平明显升高,其疗效优于常模组患者。HO-1 和SOD 是人体内两种重要的抗氧化防御酶,能抑制炎症反应,保护血管内皮细胞,减轻细胞损伤、蛋白质氧化及脂质过氧化反应。将普罗布考与依那普利叶酸片联用,可起到双重抗氧化及保护血管内皮的作用,使DKD 患者的蛋白尿显著减少,并有效改善其血压、血脂和血糖的水平,延缓其肾病的发展。
综上所述,在对早期DKD 患者进行常规治疗的基础上,用普罗布考联合依那普利叶酸片对其进行治疗能显著改善其肾功能,减轻其氧化应激损伤,增强其机体的抗氧化能力,减少其尿蛋白,降低其血压、血糖和血脂的水平,保护其肾脏,且治疗的安全性较高。该治疗方案有着较好的临床应用前景。

