淀粉粒径对大麦淀粉物化特性的影响
肖璐婷,李秀红,刘栗君,叶发银,2,3*,赵国华,2,3
淀粉粒径对大麦淀粉物化特性的影响
肖璐婷1,李秀红1,刘栗君1,叶发银1,2,3*,赵国华1,2,3
1西南大学食品科学学院,重庆 400715;2川渝共建特色食品重庆市重点实验室,重庆 400715;3重庆市特色食品工程技术研究中心,重庆 400715
【目的】大麦籽粒是一类重要的谷物原料,在啤酒酿造、禽畜喂饲、药食保健等领域的用途十分广泛。研究表明,籽粒中的淀粉颗粒大小及淀粉组成结构决定其用途。通过研究不同品种大麦不同粒径淀粉颗粒的组成结构及物化性质,为大麦淀粉加工利用提供参考。【方法】以西引2号(Xiyin-2)、京辛1号(Jingxin-1)、苏啤6号(Supi-6)3种不同用途的大麦品种籽粒为原料,采用沉降分离法得到大、中、小3个粒径的淀粉颗粒,研究颗粒显微形态、淀粉晶体结构、直链淀粉含量、支链淀粉侧链分布以及淀粉颗粒热特性、水合性质、糊化特性和消化特性与粒径的关系。【结果】大颗粒大麦淀粉多呈盘状,中颗粒淀粉呈扁圆形或椭球形,小颗粒淀粉呈球形或多角形。在偏振光显微镜下,所有大麦淀粉颗粒具有典型的偏光十字,且偏振光亮斑随粒径增加而增强。大麦淀粉的大颗粒占比最高(87.62%—89.48%),其次为中颗粒(8.97%—9.42%)和小颗粒(1.55%—3.29%)。大麦淀粉的表观直链淀粉含量为19.12—30.63 g/100 g,粒径对其含量的影响缺乏规律性。所有样品均为A型结晶,相对结晶度随着粒径增大而增加。大麦支链淀粉的侧链分布呈现双峰模式,主峰在DP12处,次峰在DP38处,大麦支链淀粉以B1链含量最高(34.34%—44.76%),其次是A链(25.12%—34.52%),大麦支链淀粉的平均链长为DP 22.86—25.00。热特性分析结果表明,小颗粒大麦淀粉的糊化温度区间(∆)最大,糊化焓(∆)则随着粒径增加而增大。大麦淀粉的膨胀力表现出品种差异,京辛1号大麦淀粉所有粒径颗粒均具有较高的膨胀力。糊化特性分析结果表明,大颗粒淀粉的峰值黏度、崩解值、终值黏度比中颗粒和小颗粒淀粉更高。消化特性分析结果表明,大麦淀粉颗粒快消化淀粉(RDS)含量随着粒径减小而增加,而粒径对其慢消化淀粉(SDS)和抗性淀粉(RS)含量的影响缺乏规律。【结论】粒径对大麦淀粉的直链淀粉含量、支链淀粉精细结构、相对结晶度等结构特征有较大影响,从而影响大麦淀粉的热特性、糊化特性及消化特性等性能。
淀粉粒径;大麦淀粉;分子结构;加工特性;消化特性
0 引言
【研究意义】在麦类、薯类、豆类等作物组织中,其富含的淀粉颗粒通常大小不一,并以特定的粒径分布和数量比例存在。通过分级分离得到同一原料中的不同粒径淀粉,通常具有不同的组成和结构,由此表现出不同的加工性能[1-2]。大麦(L.)的全球种植面积在禾谷类粮食作物中排第四位,仅次于小麦、水稻和玉米[3]。大麦目前主要用于酿造和饲料,有些大麦品种则作为杂粮供人食用。鉴于其丰富的营养成分和生物活性成分健康促进效应的不断发现,以及加工手段的革新,大麦在营养与健康、食品及功能性配料加工等方面的研究日渐受到重视。淀粉是大麦胚乳的主要碳水化合物成分,占其干重的66%—75%[4]。大麦淀粉颗粒同样呈现粒径多样性[5]。有关酿造大麦的研究结果表明,大麦淀粉的含量、组分及粒径对啤酒和威士忌的品质和产量具有显著影响。开展不同品种大麦来源的不同粒径淀粉的结构组成及功能性的比较研究,对大麦淀粉加工利用及相关制品的开发具有理论指导和实际意义。【前人研究进展】不同品种的大麦淀粉均存在粒径、组成和加工特性上的差异。JAISWAL等[6]将大麦淀粉划分为A型(>15μm)、B型(5—15μm)和C型(<5μm)3种类型。TAKEDA等[7]研究表明大麦籽粒中大、中、小淀粉颗粒的支链淀粉平均链长及侧链分布无明显差异,但大、中颗粒的直链淀粉含量更高且其平均聚合度较小。MYLLRINEN等[8]研究发现大麦大颗粒淀粉中内源性脂质含量低于小颗粒。NAGULESWARAN等[9]研究表明大麦大颗粒淀粉的直链淀粉含量及相对结晶度高于小颗粒淀粉,而小颗粒淀粉具有更高的糊化温度、更低的糊化焓,更易被淀粉酶水解。AHMED等[10]研究发现抗性淀粉的含量与粒径<15μm淀粉颗粒的比例呈正相关,而与粒径在15—45 μm的淀粉颗粒比例呈负相关。有学者注意到不同粒径的大麦淀粉在酿造品质上的差异[11]。在大麦淀粉糖化过程中,小颗粒淀粉维持结构完整的时间更长,甚至当大颗粒淀粉完全糊化后,还能观测到小颗粒淀粉[12]。实际上,制麦芽含有相当比例的小颗粒大麦淀粉,由于它们比大颗粒的糊化温度高,这会影响到糖化的效率和质量[13]。【本研究切入点】由于啤酒工业是大麦主要的消费领域,因此,国外开展了大麦淀粉粒径与制麦芽加工特性的相关研究。国内有学者初步研究了酿造及饲料用大麦的籽粒结构和淀粉粒的特性[11]。但目前有关大麦淀粉颗粒的粒径特异性对其加工特性及营养特性的影响研究偏少,不同用途(酿造、食用、饲料用)大麦籽粒中粒径对大麦淀粉特性的研究值得深入,这对于专用型大麦淀粉的开发具有重要意义。【拟解决的关键问题】粒径与大麦淀粉理化性质及加工特性之间具有重要关联性。本研究以不同用途(酿造、食用、饲料用)大麦籽粒为材料,通过提取淀粉、反复沉降分级分离出大、中、小颗粒淀粉。通过研究粒径对大麦淀粉化学组成、分子结构、结晶特性、热特性、水合特性、糊化特性、体外消化特性等理化性质的影响,并对粒径与大麦淀粉加工性能之间关系进行分析,为大麦淀粉的修饰改性、相关功能性配料开发提供参考。
1 材料与方法
试验于2017—2020年在西南大学食品科学学院食品科学实验室进行。
1.1 试验材料与试剂
大麦(L.):西引2号(Xiyin-2),产地山东;京辛1号(Jingxin-1),产地江苏;苏啤6号(Supi-6),产地江苏。
无水乙醇、乙酸钠,成都科龙化工试剂厂;人工唾液(科达AR-8802),东莞市科鸿化工有限公司;胰蛋白酶、胃蛋白酶(400 U∙mg-1)、淀粉葡萄糖苷酶(3 300 U∙mL-1)、-淀粉酶(12 U∙mL-1),美国Sigma-Aldrich有限公司;葡萄糖氧化酶/过氧化物酶(GOPOD)试剂盒,爱尔兰Megazyme公司。
1.2 仪器与设备
分析天平(JA3003B):上海精天电子仪器有限公司,恒温水浴锅(HH-W420):金坛市大地自动化仪器厂,漩涡振荡器(HQ60):北方同正生物技术发展公司,普通粉碎机(JIASOUND):永康市红太阳机电有限公司,定时电脑泵(BT-100-4):上海青浦沪西仪器厂,数显酸度计(JA3003B):杭州雷磁分析仪器厂,电热恒温鼓风干燥箱(DHG-9070A):上海齐欣科学仪器有限公司,超声波清洗器(KQ-500E):昆山市超声仪器有限公司,可见分光光度计(L6):上海精科科学仪器厂,扫描电子显微镜(Quanta 200):荷兰FEI公司,荧光正置显微镜(BX53):日本OLYMPUS公司,激光粒度散射仪(Mastersvzer2000):英国马尔文仪器有限公司,离子色谱仪(ICS-3000):美国DIONEX公司,X-射线衍射仪(D2):德国Bruker AXS有限公司,差示扫描量热仪(DSC200F3):德国NETZSCH公司,快速黏度分析仪(TecMaster RVA):北京长流科学仪器公司,电子调温万用电炉(DK-98-11):天津市泰斯特仪器有限公司。
1.3 试验方法
1.3.1 大麦淀粉的制取与分级分离[14-15]称取500g大麦籽粒,用普通粉碎机粉碎3 min,过100目筛,按料液比1﹕10将筛下物加入到质量分数0.5%的氢氧化钠水溶液中,混合均匀后,静置4h,采用1﹕1盐酸调节体系pH至中性,离心(4 528×,20min),得到的沉淀加入蒸馏水,混合均匀后离心,重复以上操作直至沉淀中无肉眼可见的杂质。将沉淀置于40℃烘箱中干燥16h,得到西引2号、京辛1号和苏啤6号的淀粉。进一步参照DHITAL等[16]研究方法对大、中、小颗粒的大麦淀粉进行分级分离。称取原淀粉40g,放入2L量筒中,加蒸馏水至2L刻度线,用玻璃棒搅拌均匀。大麦淀粉因粒径等差异呈现不同的沉降速度。不同粒径淀粉采集的时间可由斯托克斯方程(式(1))得到:
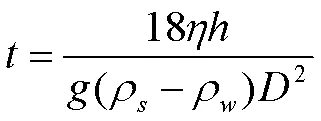
式中,:水的黏度(1.003×10-3Pa·s-1,20℃);:沉降高度(m);:重力加速度(9.8m·s-2);ρ:淀粉的密度(1 500kg·m-3);ρ:水的密度(998.23kg·m-3);:颗粒直径(m)。
前期试验发现,小淀粉(<4.37 µm)可在静置沉淀6h后,用定时电脑泵抽取中层300—1 400mL处的混合液,混合液经离心(4 528×,15min)得到,重复以上操作直至上清液澄清透明无明显可见淀粉(至少重复7次);对量筒中剩余的淀粉悬液静置沉淀3h后,用定时电脑泵抽取中层300—1 400mL处的混合液,混合液经离心(3 578×,10min)得到中等颗粒的大麦淀粉(6.61—10.00 µm);余下的即为大颗粒大麦淀粉(10.00—34.67 µm)。西引2号、京辛1号及苏啤6号的大、中、小颗粒的淀粉分别标记为XLS、XMS、XSS、JLS、JMS、JSS、SLS、SMS和SSS。
1.3.2 大麦淀粉化学组成测定 水分含量按GB 5009.3—2016直接干燥法测定;灰分含量按GB 5009.4—2016灼烧法测定;粗蛋白含量按GB 5009.5—2016凯氏定氮法测定;直链淀粉含量测定参照GB/T 15683;总淀粉含量测定参照GB/T 5009.9— 2008。
1.3.3 显微形貌及偏光十字观测 将淀粉均匀铺在镀有双面胶带的铝制短管上,置于离子溅射仪中,对样品喷金处理,镀上一层10 nm的薄膜后,在15 kV加速电压下测定,并在不同放大倍数下采集电镜图片[16]。
称取一定量的淀粉样品,加入甘油﹕蒸馏水(1﹕1,v/v),搅拌得到6%的淀粉悬液,滴加于载玻片上,盖上盖玻片后,采用荧光正置显微镜分别在普通光及偏光下进行基本形貌和偏光十字观测[17]。
1.3.4 淀粉相对结晶度测定 取0.5g淀粉样品置于X-射线衍射仪的样品盒中,采用步进扫描法。测试条件如下:靶及波长:Cu、Kα,1.5406Å;Ni片滤波;狭缝系统:DS/RS/SS=1.0/0.1/1.0mm;探测器:闪烁计数器;电压:40kV;电流:40mA;扫描速度:2°/min;扫描范围:3—60°(2);步宽:0.02°;扫描方式:连续。采用MDI jade6计算淀粉的相对结晶度[18]。
1.3.5 粒径分布测定 称取1.0g淀粉,置于激光粒度分析仪的样品池中,加入蒸馏水,用超声波振荡2min,使淀粉颗粒均匀分布,当遮光率达到15%—20%时,测定粒径范围及分布[19]。测试条件:颗粒折射率:1.530;分析模式:通用;分散剂:蒸馏水。
1.3.6 支链淀粉链长分布测定 支链淀粉链长分布使用配备有脉冲安培检测器的高效阴离子交换色谱仪测定,方法参照文献[20]。色谱柱:CarboPac PA20(3 mm×150 mm)分析柱和CarboPac PA20(3 mm×30 mm)保护柱;流动相:NaOH(0.1 mol∙L-1)、NaOH(0.1 mol∙L-1)+NaAc(1 mol∙L-1)、水;固定相:阴离子交换树脂;流速:0.4 mL·min-1;柱温:30℃。
1.3.7 水合性质测定 0.1g干淀粉(105℃预处理2h)置于试管中,加入10mL蒸馏水,室温下磁力搅拌30min;接着将样品分别置于65℃、75℃、85℃、95℃水浴中保温1h。然后迅速将其冷却至室温,并转移到离心管中离心(1 006×,15min)。淀粉的溶解性()和膨胀力()分别由(2)和(3)方程计算得到[21]:
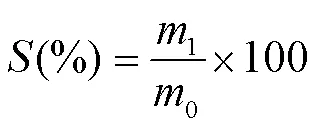
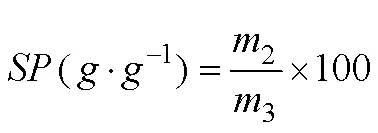
式中:0为淀粉干基重量(g);1为上清液烘干至恒重后的质量(g);2为沉淀物的初始重量(g);3为沉淀物烘干至恒重后的质量(g)。
1.3.8 热特性测定 采用差示扫描量热仪进行热特性的测定[11]。称取2.5mg淀粉试样,加水量与淀粉试样质量比为2.5﹕1,封于坩埚中,在4℃平衡24h后测定。扫描条件:扫描范围:20℃—100℃;扫描速率:10 ℃·min-1。
1.3.9 糊化特性测定 采用快速黏度分析仪进行糊化特性的测定[22]。准确称取3.0g淀粉,制取成6%的淀粉悬液倒入专用铝盒中,混合均匀,测定糊化参数。测定条件:10s内离心力由960r/min降到160r/min并保持稳定。50℃维持1min,以10℃·min-1升温至95℃,在95℃保持5min,然后以10℃·min-1的速度冷却到50℃,在50℃保持2min。
1.3.10 淀粉颗粒的体外消化特性测定 准确称量约0.5 g淀粉,用含-淀粉酶(1 mL,290U∙mL-1)的人工唾液处理15—20s,然后加入胃蛋白酶(5 mL,1 mg·mL-1)、稀盐酸(5mL,0.02mol·L-1),在37℃下于振荡水浴中水解30min。加入氢氧化钠溶液(5mL,0.02mol·L-1),然后加入乙酸钠缓冲液(10 mL,0.2mol·L-1)、胰蛋白酶(2mg·mL-1)和淀粉葡萄糖苷酶(28µL·mL-1)的混合物。反应体系在37℃分别酶解0、20和120min。在每个指定的水解时间结束后,置于冰水混合物中10min终止反应,离心。将上清液与GOPOD试剂混合,反应液于510nm波长下比色。葡萄糖释放量根据标准曲线计算。大麦淀粉的快消化淀粉(rapidly digestible starch,RDS)、慢消化淀粉(slowly digestible starch,SDS)和抗性淀粉(resistant starch,RS)含量可以分别由式(4)、(5)和(6)得到[16,23]:
(%)=[(20-)×0.9/]×100(4)
(%)=[(120-20)×0.9/]×100(5)
(%)=1-(+) (6)
式中,20为酶水解20min 后的总葡萄糖含量(mg);为样品中总淀粉含量(mg);为酶水解处理前样品中葡萄糖含量(mg);120为酶水解120min后的总葡萄糖含量(mg)。
1.4 数据统计与分析
所有测定至少重复3次,结果以平均值±标准偏差表示。绘图采用Origin18.0进行。采用SPSS 20.0进行统计分析,用Duncan’s法进行显著性检验(<0.05)。
2 结果
2.1 大麦淀粉颗粒的化学组成
各品种大麦淀粉的水分含量在10.93—15.90 g/100 g。3种大麦淀粉的含量在98.13—98.95 g/100 g。各品种大麦淀粉的总淀粉含量无显著性差异,表观直链淀粉含量有显著性差异(<0.05),其中京辛1号总淀粉含量最高(98.95 g/100 g),西引2号直链淀粉含量为27.60%,比京辛1号和苏啤6号分别高5.23%和2.9%(表1)。大麦淀粉根据在水中的不同沉降时间,可以分为大、中、小颗粒淀粉,不同粒径级的D[3,2]、D[4,3]和d(0.5)值如表1所示。各品种大麦淀粉的D[3,2]在7.53—8.31μm,D[4,3]在16.20—17.13μm,D[3,2]和D[4,3]之间差异较大,说明3种大麦淀粉粒径分布较为分散。除京辛1号淀粉外,西引2号与苏啤6号淀粉D[3,2]、D[4,3]、d(0.5)均无显著性差异。
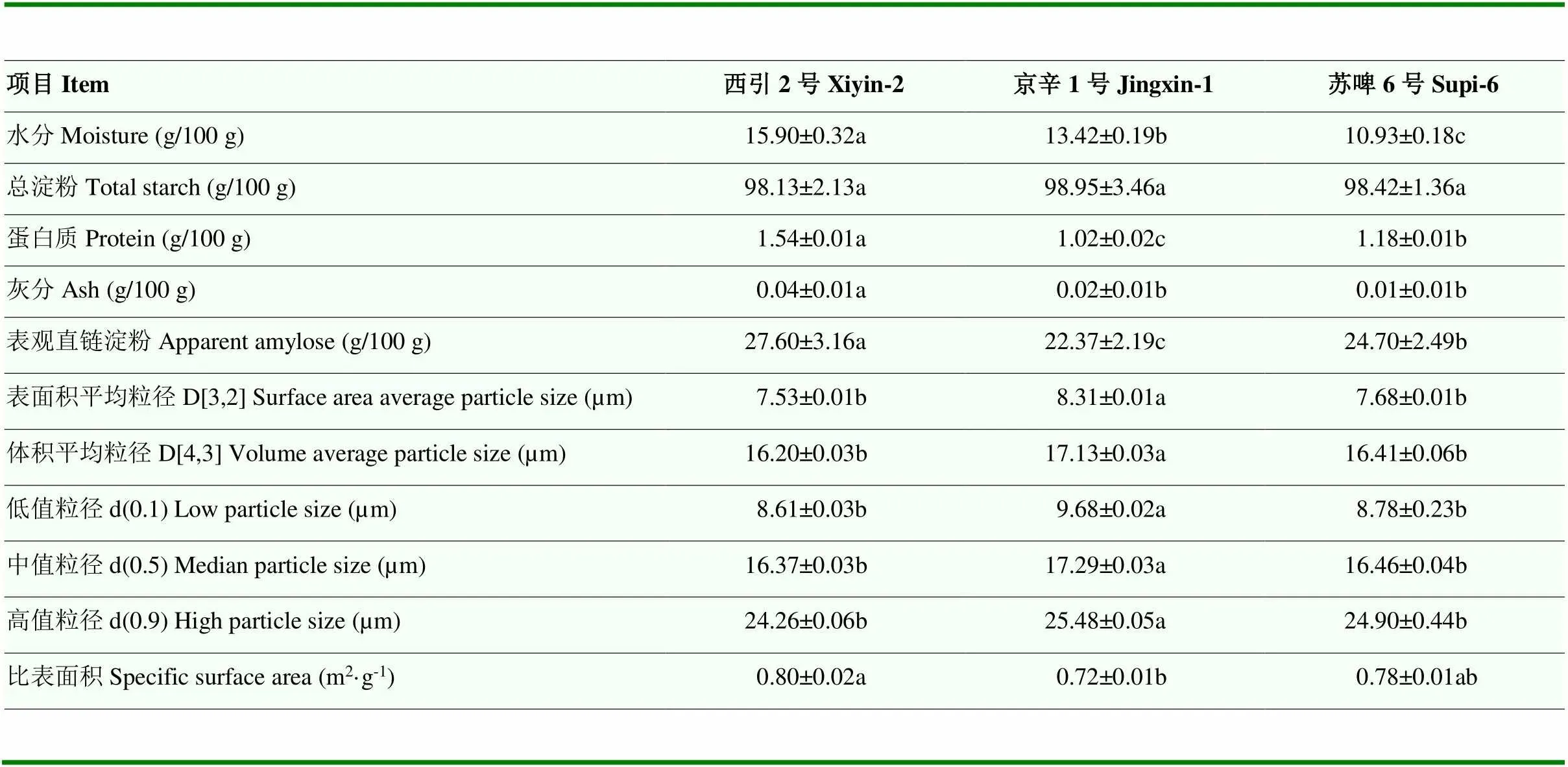
表1 大麦淀粉的基本特性*
*:除水分外,其余含量均为干基。同行不同小写字母表示差异显著(<0.05)
The other contents are presented as dry basis except moisture.Different letters in the same row indicate significant differences (<0.05)
2.2 不同粒径大麦淀粉的显微形貌及偏光十字特征
3个品种大麦淀粉经过分级分离后得到大、中、小颗粒的淀粉,采用光学显微镜按照白光及偏振光模式对其进行观测,结果如图1所示。对大、中淀粉颗粒而言,白光模式下淀粉颗粒内部呈现一些阴影区域,这说明淀粉颗粒不同区域具有不同透光性。在偏振光模式下,各粒径淀粉颗粒具有典型的偏光十字,其交叉点(脐点)基本处于淀粉粒的几何中心。偏振光模式下亮斑的亮度在大颗粒中最强,中等颗粒次之,而小颗粒的最暗。
在光学显微观测的基础上,为观测不同粒径大麦淀粉颗粒的显微结构,采取扫描电子显微镜分析。图2显示,大、中颗粒的尺寸差异较小,而小颗粒淀粉的尺寸远小于大、中颗粒。大颗粒大麦淀粉呈盘状,中颗粒淀粉呈扁圆形或椭球形,小颗粒淀粉呈球形或多角形。
2.3 不同粒径大麦淀粉的组成及直链淀粉含量
表2所示,大淀粉颗粒体积百分比最大(87.62%—89.48%),其次是中颗粒(8.97%—9.42%),小颗粒淀粉的体积百分比最小(1.55%—3.29%)。3个品种大麦淀粉的直链淀粉含量存在粒径差异性。对于西引2号,中等颗粒的直链淀粉含量最高,而京辛1号和苏啤6号则是大颗粒淀粉直链淀粉含量最高,两个品种的直链淀粉含量反而是中等颗粒的最小。
2.4 不同粒径大麦淀粉的支链淀粉链长分布特征
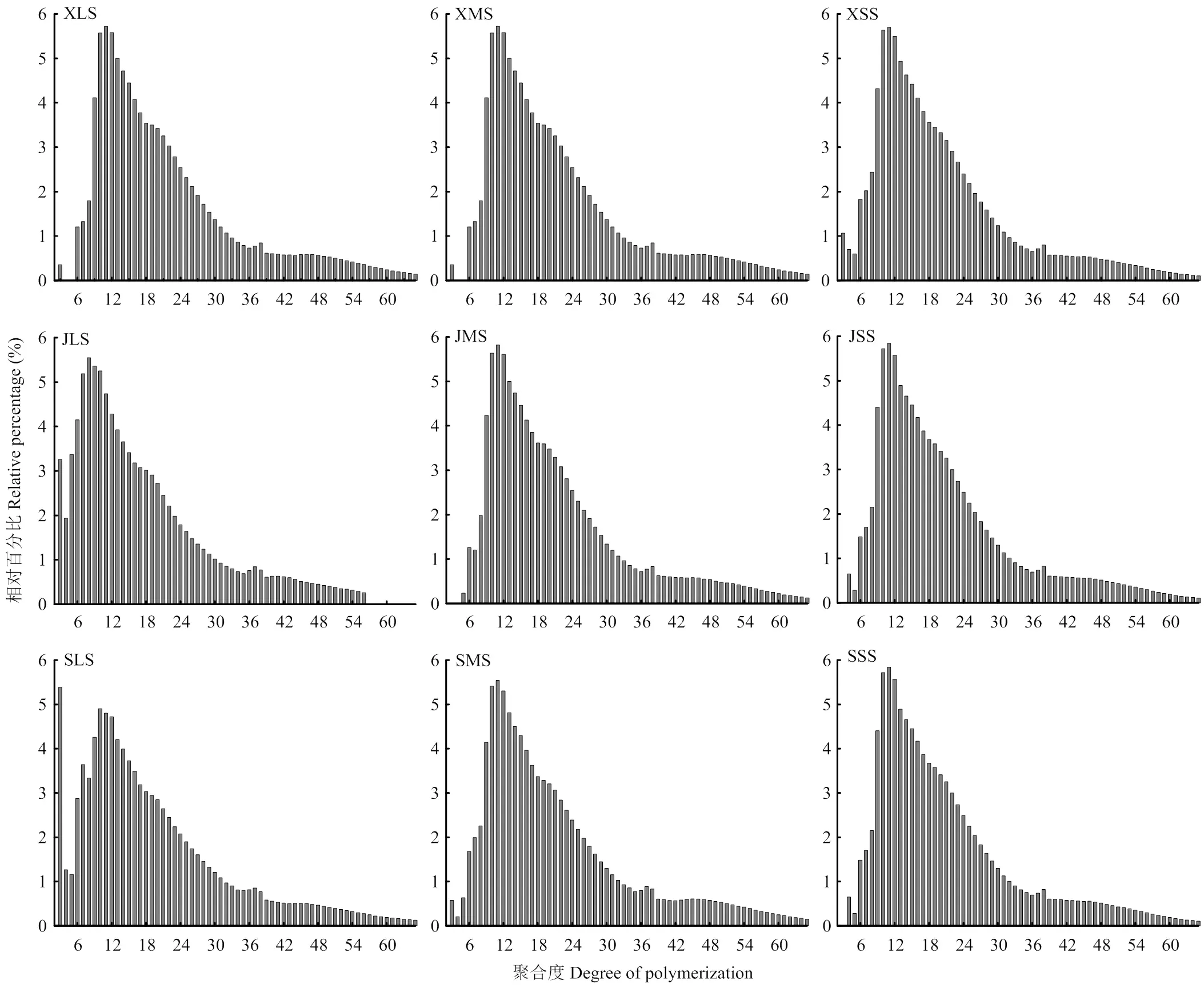
采用高效阴离子交换色谱得到不同粒径大麦淀粉的支链淀粉链长分布曲线,结果如图3所示。经过分级分离后得到大、中、小颗粒的淀粉,其支链淀粉链长分布曲线均呈现出两个明显的峰值,第一个峰值出现在DP 12,另一个峰值出现在DP 38附近。根据HANASHIRO等[24]的研究,通常将支链淀粉侧链分布按照聚合度(DP)分为4部分:A链(DP 6—12)、B1链(DP 13—24)、B2链(DP 25—36)和B3链(DP>36)。由表2可见,直链淀粉的平均链长在DP 22.86—25.00。3个品种的大麦支链淀粉侧链分布均以B1链的百分比最大,A链次之,然后是B2链和B3链。对于A链,西引2号小颗粒淀粉以及京辛1号和苏啤6号大颗粒淀粉的A链比例最高;B1链及B2链的百分比最高值也出现在不同粒径的淀粉中;仅B3链的百分比在所有中等颗粒的淀粉中出现最大值。
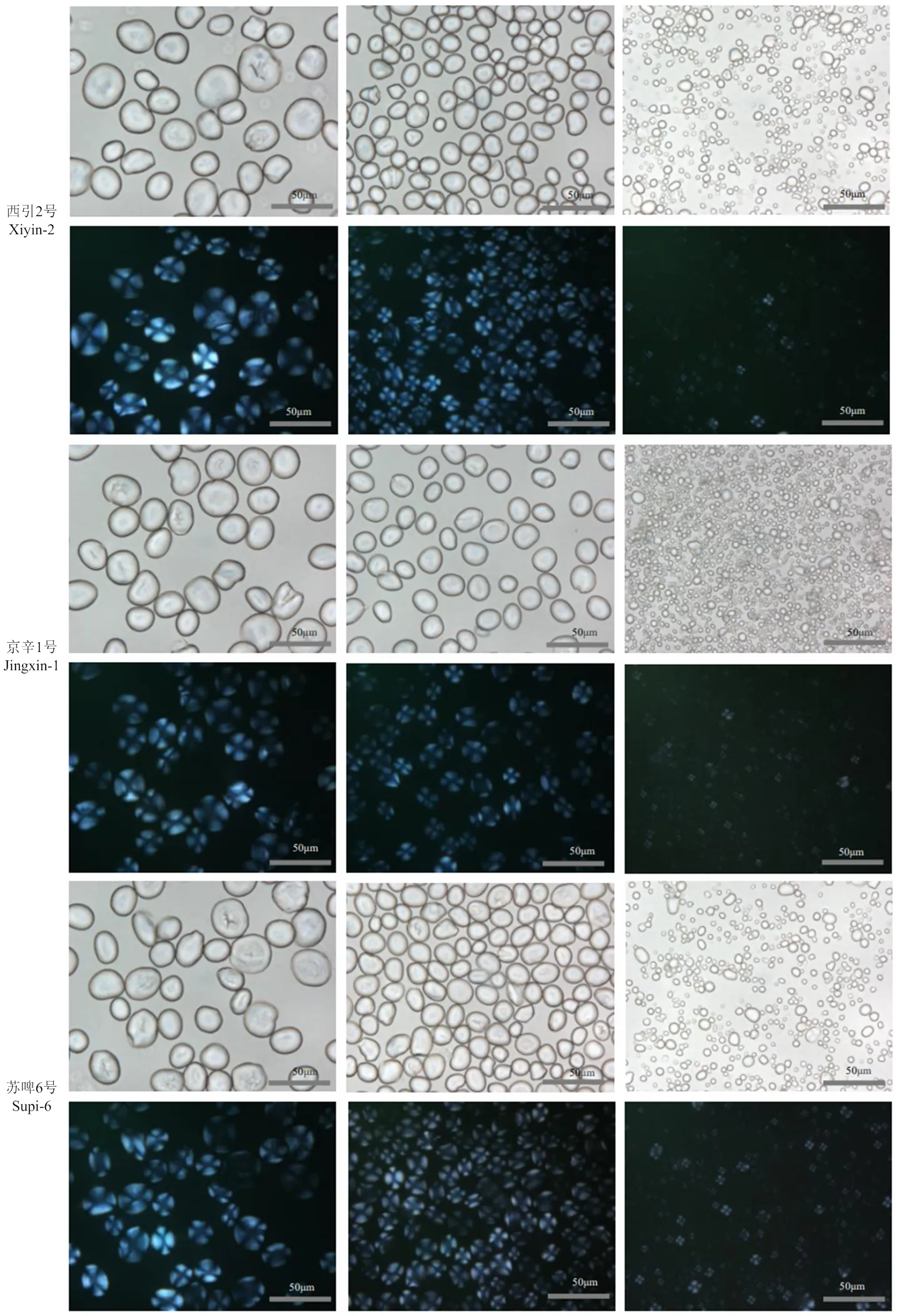
图1 大麦淀粉的常规光学显微镜图和偏光十字图

A、B、C:西引2号大麦淀粉,分别放大500倍、1000倍、5000倍;D、E、F:京辛1号大麦淀粉,分别放大500倍、1000倍、5000倍;G、H、I:苏啤6号大麦淀粉,分别放大500倍、1000倍、5000倍
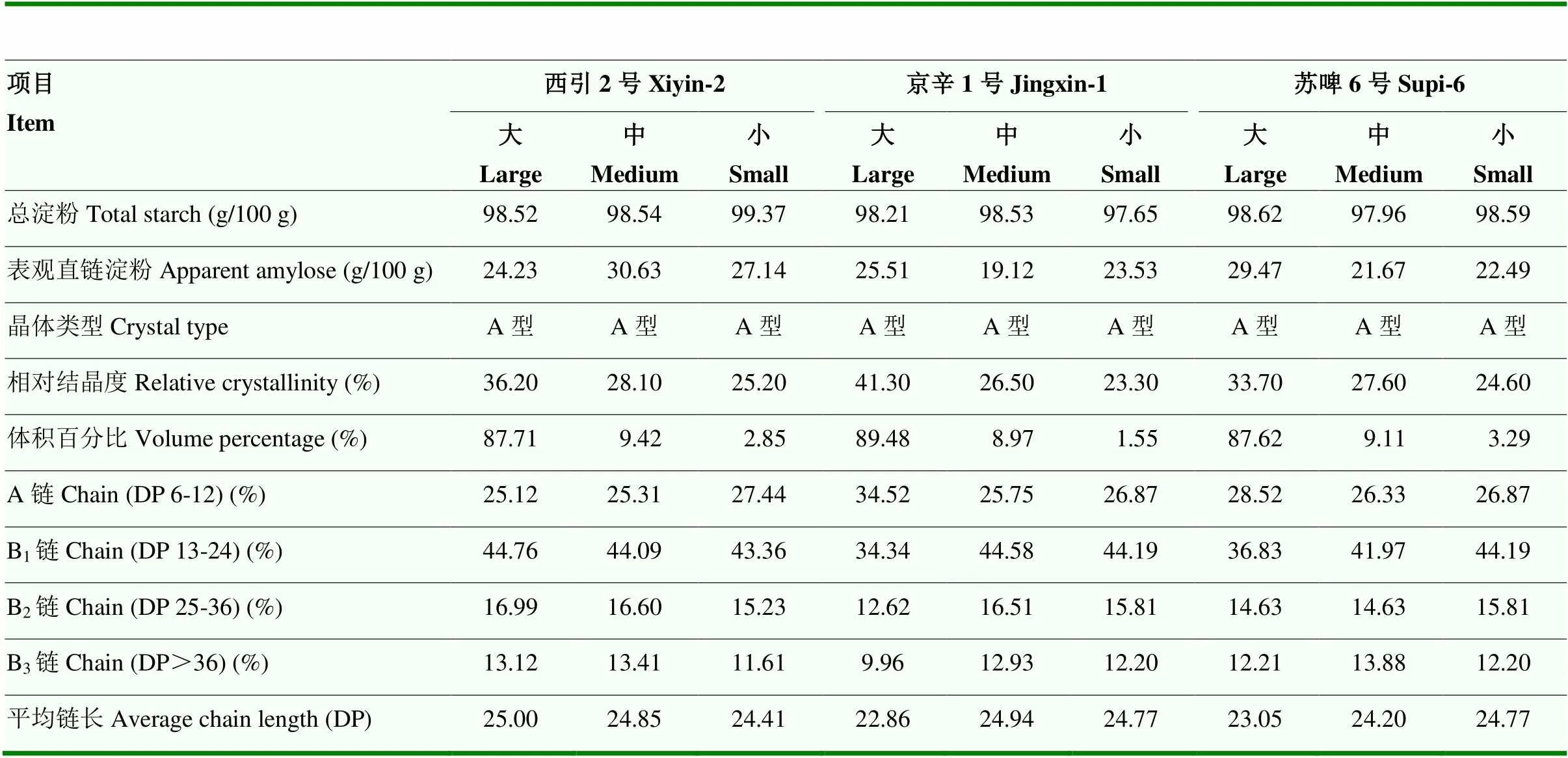
表2 大麦大、中、小淀粉颗粒的性质
XLS、XMS、XSS:西引2号大麦大、中、小淀粉颗粒;JLS、JMS、JSS:京辛1号大麦大、中、小淀粉颗粒;SLS、SMS、SSS:苏啤6号大麦大、中、小淀粉颗粒。下同
2.5 不同粒径大麦淀粉的结晶特性
由图4可知,3种大麦淀粉的大、中、小颗粒淀粉均呈现出典型的A型淀粉衍射特征,在15°和23°有强特征峰,在17°和18°出现双峰[25]。所有粒径的大麦淀粉在=20°的位置上有V型直链淀粉-脂类包合物的特征峰。西引2号淀粉的中、小颗粒还在=13°呈现V型特征峰。结合表2,3个品种大麦淀粉的相对结晶度呈现粒径差异性,大颗粒的相对结晶度最大,中等颗粒的次之,小颗粒的最小。其中,京辛1号淀粉的大、小颗粒的相对结晶度差值最大(相差18%),而苏啤6号淀粉的大、小颗粒的相对结晶度差值最小(相差9.1%)。
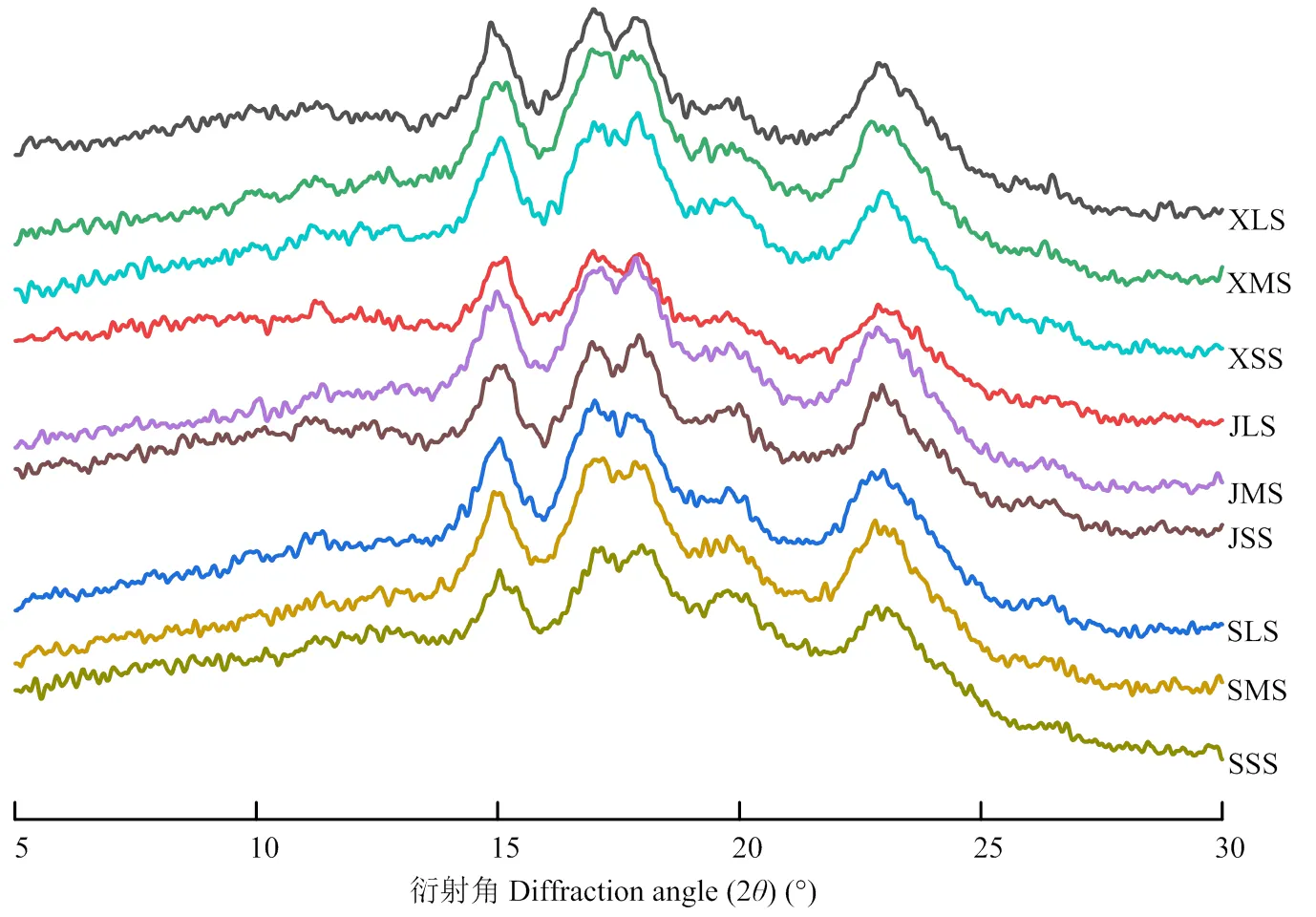
图4 不同粒径的大麦淀粉X-射线衍射图
2.6 不同粒径大麦淀粉的热特性
对于3个品种的大麦淀粉,起始糊化温度(o)随着淀粉粒径的减小而降低,而峰值糊化温度(p)和终值糊化温度(c)随着淀粉粒径的减小而增大。这使小颗粒淀粉具有最大的糊化温度区间(∆)。结果表明,京辛1号的小颗粒淀粉o(60.1℃)最小,而p(67.0℃)和c(72.9℃)具有最高值。另外,糊化焓(∆)随着淀粉粒径的增加而增大。其中,西引2号大颗粒淀粉的∆最大(7.55 J·g-1)(表3)。
2.7 不同粒径大麦淀粉的水合特性
大、中颗粒大麦淀粉的溶解性和膨胀力如图5所示。随着温度上升,大、中、小颗粒淀粉的溶解性和膨胀力均随之增加。就膨胀力而言,京辛1号大、中颗粒淀粉在65℃—95℃区间的膨胀力高于其他大麦淀粉样品(图5-B)。
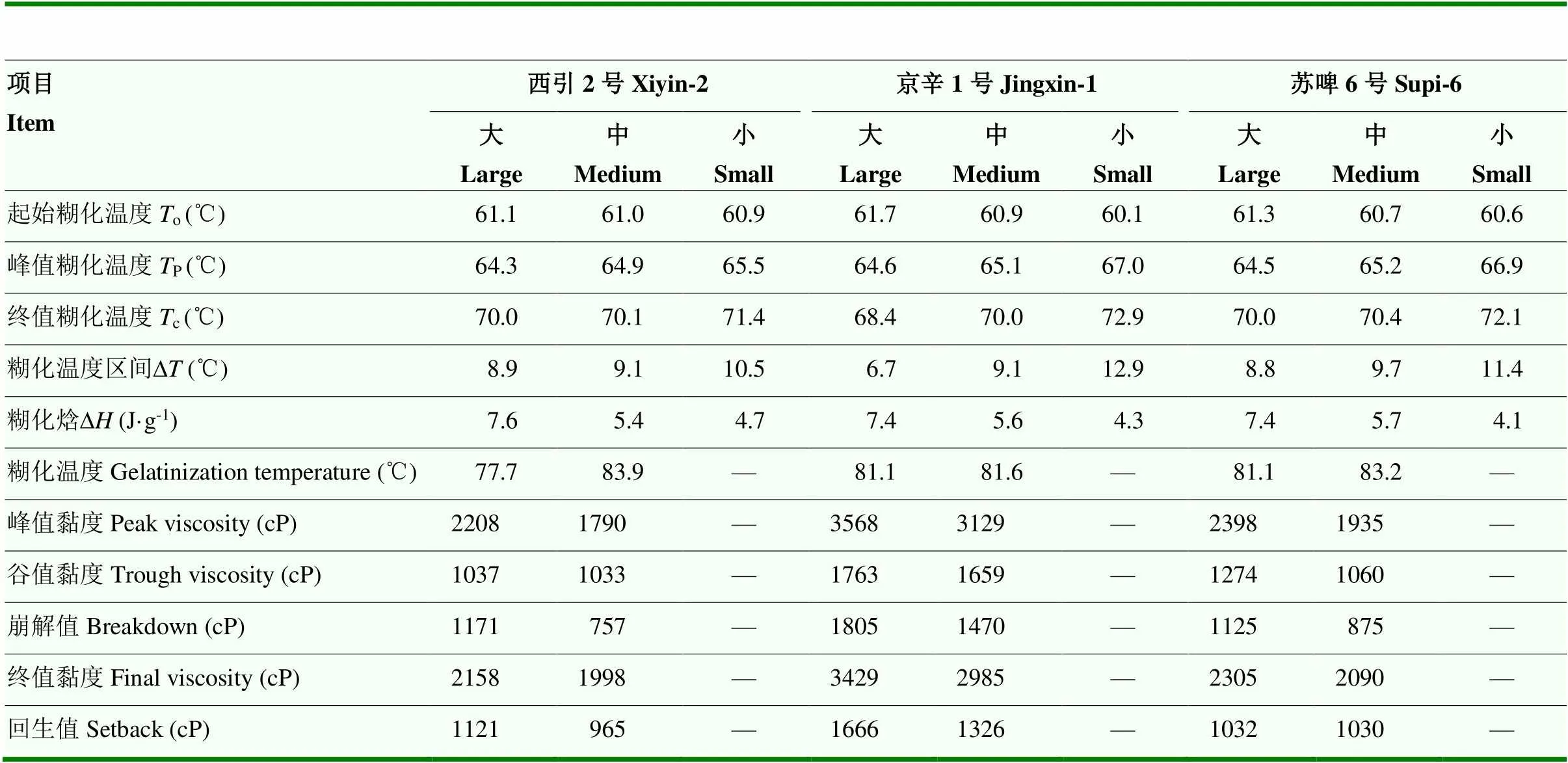
表3 大、中、小大麦淀粉的热特性和糊化特性
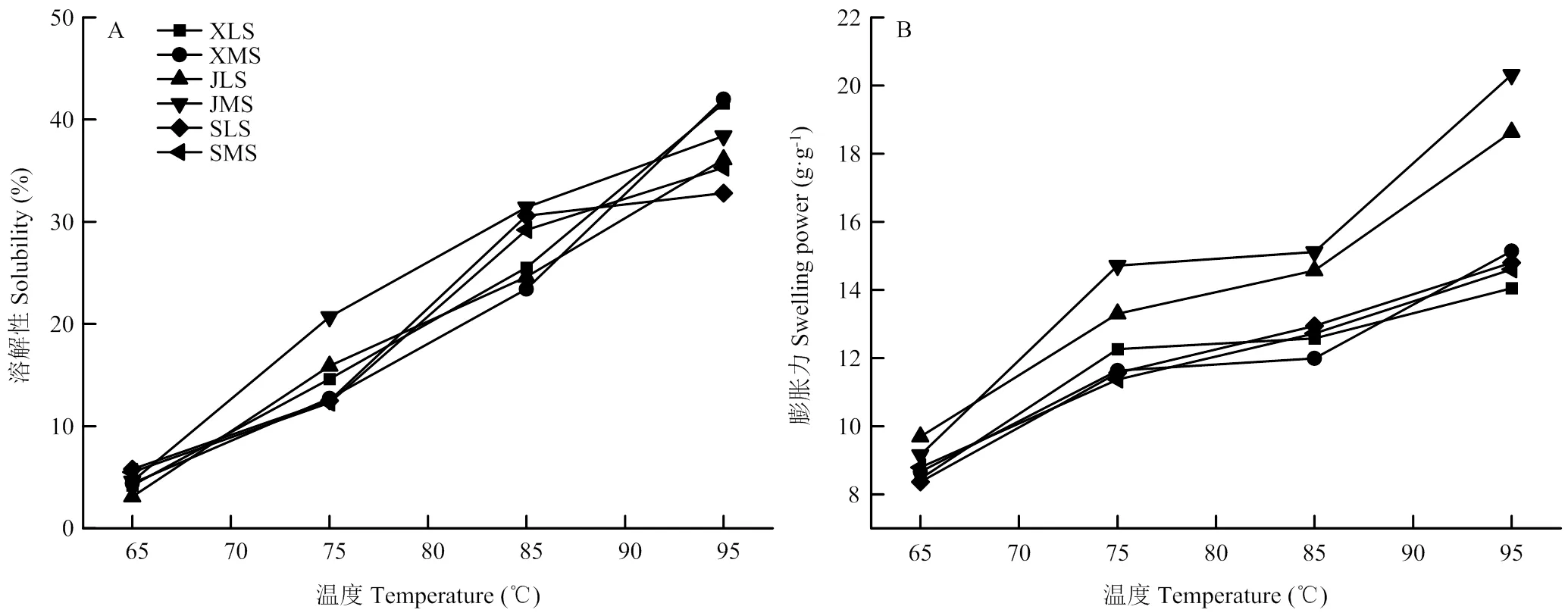
图5 不同粒径的大麦淀粉的溶解性和膨胀力曲线
2.8 不同粒径大麦淀粉的糊化特性
如图6所示,粒径对大麦淀粉糊化特性的影响呈现品种特异性。对于西引2号淀粉,中颗粒的峰值黏度和最终黏度低于大颗粒的,但谷值黏度未受到粒径影响;对于京辛1号大麦淀粉,峰值黏度、谷值黏度和最终黏度均是大颗粒的大于中等颗粒;而对于苏啤6号大麦淀粉,大、中颗粒淀粉之间糊化特性差异主要在峰值黏度上。总体而言,京辛1号大颗粒淀粉具有最大的峰值黏度和最终黏度,而西引2号中颗粒淀粉具有最小的峰值黏度和最终黏度。中等颗粒淀粉比大颗粒淀粉具有更高的糊化温度(表3)。其中,西引2号中颗粒淀粉的糊化温度最高(83.9℃)。但是,西引2号中颗粒淀粉的峰值黏度最低(1 789cP),其膨胀力较差[26],从图5的结果也可以得到验证。
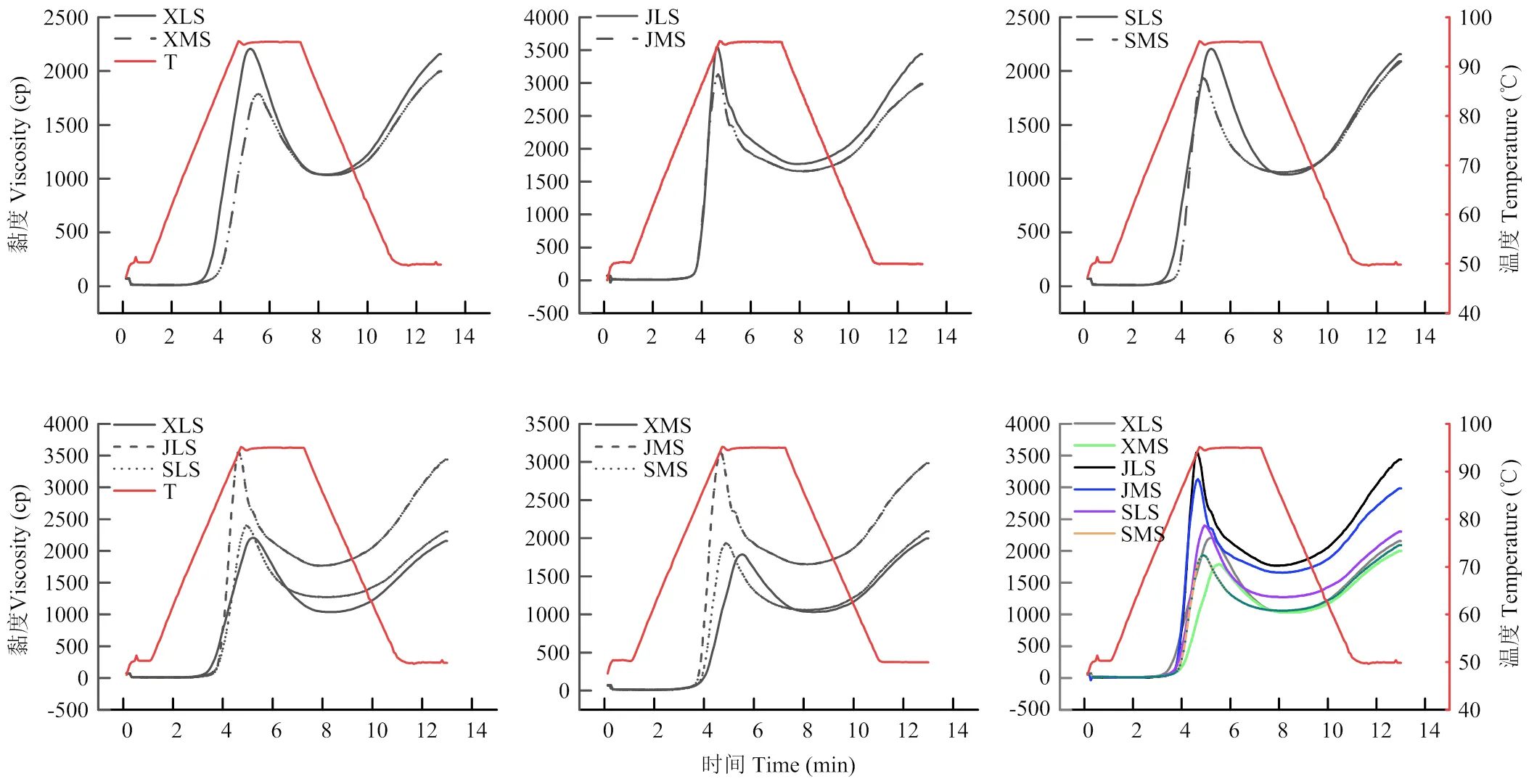
图6 大麦淀粉糊化特性曲线
2.9 不同粒径大麦淀粉的快消化淀粉、慢消化淀粉与抗性淀粉含量
由表4可知,不同粒径大麦淀粉的RDS、SDS和RS含量呈现显著性差异(<0.05)。3种大麦淀粉中,小颗粒淀粉的RDS含量最高,其次是中颗粒,最后是大颗粒。对于西引2号和京辛1号,大、中颗粒的SDS含量高于小颗粒淀粉,苏啤6号则是中、小颗粒淀粉的SDS含量高于大颗粒淀粉。总体而言,3种大麦淀粉的RS含量低于RDS和SDS。淀粉颗粒尺寸对于RS含量影响并无规律性。其中,西引2号大颗粒淀粉的RS含量最高(26.81%),苏啤6号小颗粒淀粉的RS含量最低(6.90%)。
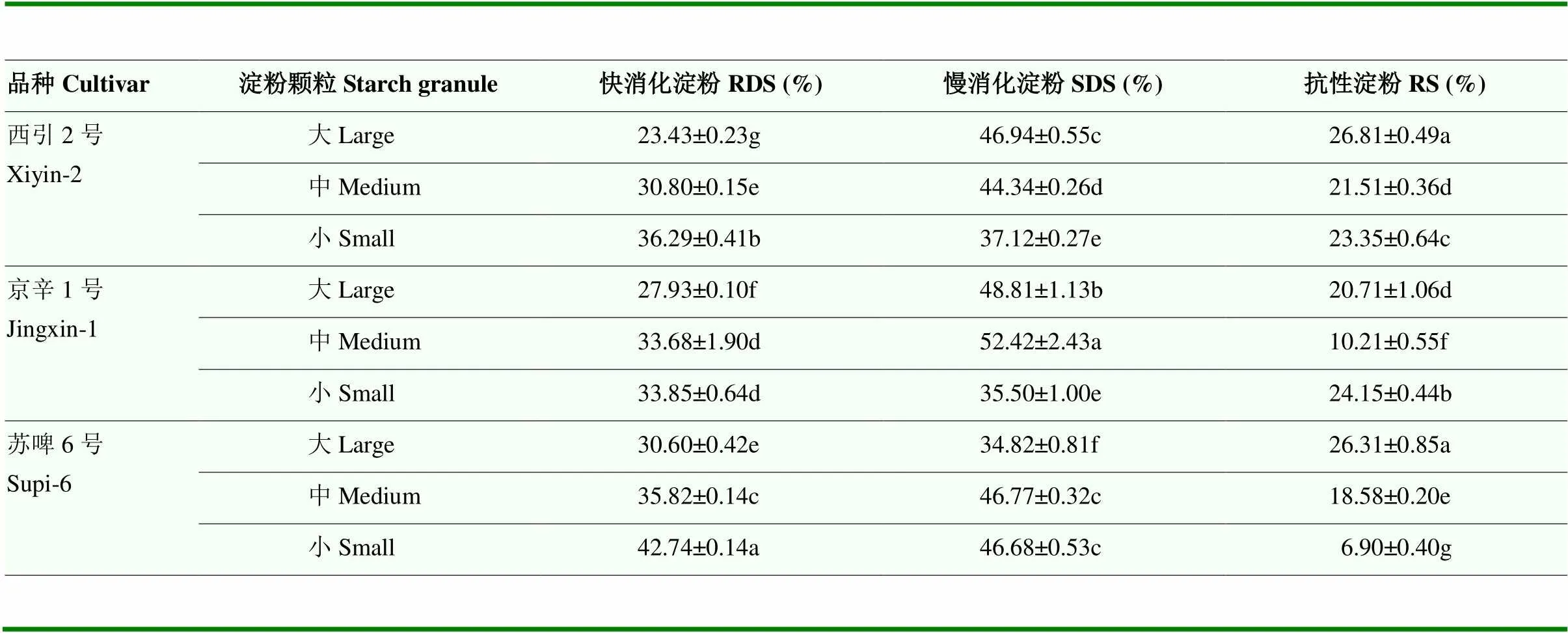
表4 大麦籽粒中大中小淀粉颗粒的快消化淀粉、慢消化淀粉与抗性淀粉的含量
同列不同字母表示差异显著(<0.05)
Different letters in the same column indicate significant differences (<0.05)
3 讨论
3.1 粒径对大麦淀粉化学组成的影响
在本研究中,3个品种大麦淀粉的蛋白质含量为1.02—1.54 g/100 g,高于GAO等[27]测得6种大麦淀粉的蛋白质含量(0.04—0.30 g/100 g),也高于NAGULESWARAN等[9]测得的蜡质、普通及高直链大麦淀粉的蛋白质含量(0.20%—0.42%)。造成这种差异的原因可能在于淀粉提取过程,不同方法对蛋白质脱除程度的差异。此外,3个品种大麦淀粉的直链淀粉含量为22.37—27.60 g/100 g。这与TAKEDA等[7]报道日本大麦中直链淀粉含量(25.0 g/100 g)以及NAGULESWARAN等[9]报道加拿大大麦淀粉中(23.6 g/100 g)的结果相近。3个品种大麦淀粉经分级分离后,得到大、中、小颗粒,分级处理对总淀粉含量影响不大,这与NAGULESWARAN等[9]的结果一致。不同粒径淀粉颗粒中直链淀粉含量存在差异。DHITAL等[28]研究发现对于玉米及马铃薯淀粉,直链淀粉含量均随着淀粉颗粒尺寸的增加而增加,KASEMWONG等[26]对芭蕉芋()淀粉分级分离后,发现大颗粒淀粉的直链淀粉含量为38.7 g/100 g,而小颗粒为29.2 g/100 g。本研究中粒径对大麦淀粉直链淀粉含量的影响缺乏一定规律。这可能是因为直链淀粉含量受品种、生长环境、测定方法的影响[7,9,12,29]。
3.2 粒径对大麦淀粉结构特性的影响
禾本科作物叶片通过光合作用产生蔗糖,并通过韧皮部运输到籽粒当中,经过淀粉合成酶的作用形成淀粉[30]。由于淀粉合成与积累关键酶的调控原因,在胚乳发育前期形成的淀粉粒最终成为大颗粒淀粉,在胚乳发育中期形成的则成为中等颗粒淀粉,小颗粒淀粉主要在胚乳发育后期形成[31-32]。本研究中,3个品种的大麦淀粉均以大颗粒为主,这与JAISWAL等[6]关于大麦淀粉的研究结果一致。WEI等[33]也发现Yangsimai-3大麦淀粉的大颗粒占绝对比例。
大麦淀粉不同粒径的颗粒具有不同的形态结构[7,9,15,34]。韦存虚等[4]报道啤酒大麦与饲用大麦都具有大、中、小3类淀粉粒,其中大颗粒淀粉多为盘状,而中、小淀粉颗粒为球形。WEI等[33]研究发现Yangsimai-3大麦淀粉的大、中颗粒呈球型或椭球型,而小颗粒呈球型、多角型或不规则型,有些中、小颗粒大麦淀粉甚至呈圆盘状。NAGULESWARAN等[9]则报道大颗粒大麦淀粉呈球形、盘状或似透镜镜片形状,而小颗粒淀粉呈现不规则型或球形。麦类作物淀粉在偏振光显微镜下会呈现偏光十字,偏光十字的交叉点即为淀粉颗粒的生长点。研究表明,偏光十字图的视觉强度大小与淀粉颗粒的有序性或结晶度密切相关[17]。本研究中,亮斑的强度随淀粉粒径的减小而减弱,这反映出大麦淀粉颗粒中的有序性随粒径减小而逐渐降低[1]。ZHANG等[1]在研究小麦A、B淀粉时发现,A淀粉的双折射强度大于B淀粉,这与A淀粉相对结晶度(31.95%)高于B淀粉(相对结晶度29.38%)及A淀粉的近程有序度高于B淀粉等结果一致。LI等[35]研究发现对于普通及蜡质小麦淀粉,A淀粉偏光十字的清晰程度高于B淀粉。本研究结果与上述报道一致。
大麦支链淀粉侧链分布的多样性与其基因、种植条件有关。前期研究发现,大麦支链淀粉的链长分布呈现双峰分布特征,其中主峰在DP 12,次峰在DP 48或DP 50,有些品种的大麦支链淀粉中还存在超长侧链(DP>67)[36]。KäLLMAN等[37]发现6个品种的大麦支链淀粉以DP 9—17侧链为主,其次是DP 22—37侧链。ZHAO等[38]发现10个品种的大麦支链淀粉以DP 8—14侧链为主,其次是DP 15—27侧链。TAKEDA[7]等研究发现大麦淀粉大、中、小颗粒的支链淀粉链长分布的主峰均在DP 12附近且峰形相似,但不同粒径之间各DP的相对含量有所不同。例如,大、小颗粒相比较,小颗粒淀粉具有更多的A及B1侧链(DP 6—9和DP 16—19),而大颗粒淀粉具有更丰富的长侧链(B2及B3侧链)。本研究的大麦淀粉中,DP>24的侧链比例高于ZHAO等[38]研究的大麦淀粉材料,但与KäLLMAN等[37]研究材料的这一侧链比例相当。有研究表明,支链淀粉的长侧链对淀粉的工艺学特性有显著影响。李春燕等[39]研究发现小麦淀粉中支链淀粉长侧链比例越高,小麦淀粉的冷糊黏度越大。LI等[40]研究发现对于糊化大米淀粉,其支链淀粉的中长侧链比例越高,越容易被淀粉葡萄糖苷酶水解,并认为增加支链淀粉短侧链比例有利于制备得到低升糖指数的大米淀粉基制品。
研究表明,大麦淀粉主要呈现A型结晶[9],在=17°和18°处出现双峰,在=15°、20°、23°为单峰。本研究的3种大麦淀粉也为A型结晶。一般认为,在为13°和20°处为V型峰,反映淀粉颗粒中存在直链淀粉-脂类包合物结构。V型结晶大约贡献了3%的相对结晶度[41]。但也有报道指出一些高直链大麦品种的淀粉为B型或B+V型结晶[42]。TANG等[15]将蜡质大麦籽粒从外层向内逐层剥离得到不同部位的级分,对每一级分进一步分级分离大、中、小颗粒的淀粉,发现蜡质大麦淀粉的相对结晶度呈现粒径差异,籽粒外层是中颗粒的相对结晶度最高,而籽粒内部淀粉的相对结晶度则随着粒径增加而增大。麦类作物淀粉的相对结晶度与支链淀粉结构、侧链平均链长和直链淀粉含量有关。研究表明,长侧链更容易形成双螺旋,从而赋予淀粉更高的结晶度[25]。
3.3 粒径对大麦淀粉理化特性的影响
淀粉颗粒的热特性反映淀粉结晶结构的热稳定性。多项研究表明[15,29,43],对于同一品种的大麦淀粉,大颗粒比小颗粒的糊化焓()更高。本研究结果与上述结论一致。大颗粒比小颗粒淀粉具有更大的原因可能是大颗粒淀粉的结晶度较大,其在糊化过程中破坏微晶束需要更多能量[43]。本研究中,大麦淀粉的糊化温度范围()最大值见于小颗粒淀粉,且随着粒径增加而减小。TANG等[15]报道无论是从大麦籽粒外层或内部分离得到的大麦淀粉,均是小颗粒淀粉的值最大,中等颗粒的次之,大颗粒的最小。这可能是因为小颗粒中的内源性脂质与淀粉互作使其难以糊化[21,43]。
淀粉颗粒的水合性质主要与淀粉的化学组成和颗粒特性有关。膨胀力反映淀粉颗粒中无定型区与结晶区淀粉链段相互作用的程度[36],这受直链淀粉含量、分子量分布、支链淀粉分支度及侧链分布等因素的影响。研究表明,较低的直链淀粉含量及较高比例的A淀粉(大颗粒)使软质小麦淀粉膨胀力高于硬质小麦淀粉;B淀粉(小颗粒)则水合性质较差[2]。本研究中,较大颗粒的大麦淀粉具有较高的膨胀力。淀粉的溶解力和膨胀力随温度的升高而增加,表明升高温度加快了直链淀粉组分的溶出,促进了水分子进入淀粉颗粒内部使其膨胀[21]。SHANG等[2]研究发现硬质小麦B淀粉比A淀粉的溶解性更大,这主要与前者含有较多蛋白质和可溶性碳水化合物有关。LI等[25]研究认为溶解性主要取决于直链淀粉的溶出,直链淀粉-脂质复合物结构存在或淀粉颗粒膨胀力弱都会造成淀粉颗粒的溶解性差。
淀粉的糊化曲线反映淀粉悬液在加热升温、热保温、降温及冷保温过程的黏度变化。本研究中,3个品种的大麦淀粉均是大颗粒级分具有较高的峰值黏度。KASEMWONG等[26]研究发现芭蕉芋淀粉中的大颗粒级分比小颗粒级分的峰值黏度大。Li等[35]研究发现无论是蜡质还是普通小麦,A淀粉的糊化曲线在B淀粉之上,即A淀粉的峰值黏度、谷值黏度、冷糊黏度均高于B淀粉。本研究结果显示所有不同粒径的大麦淀粉越过峰值黏度后呈现剪切变稀特性,较大颗粒淀粉具有更大的崩解值。DHITAL等[28]研究表明马铃薯淀粉的大颗粒比小颗粒的热糊稳定性差。此外,本研究还发现苏啤6号大麦淀粉达到峰值所需时间随着颗粒尺寸的减小而提前(图6)。MEI等[18]研究显示桄榔淀粉中的小颗粒组分比大颗粒组分达到峰值所需时间提前了近1 min。同时,3个品种大麦淀粉的大颗粒表现出较高的冷糊黏度,这一结果与前人报道的规律一致[44]。
淀粉颗粒的消化特性与多种因素有关。本研究中,3个品种大麦淀粉的RDS含量随着粒径减小而增加,即小颗粒淀粉更容易酶水解。DHITAL等[28]研究发现玉米和马铃薯淀粉颗粒的酶水解速率与其粒径呈负相关,即最小粒径颗粒的酶水解速率最大。与大颗粒淀粉相比,由于小淀粉颗粒的比表面积相对较大,更有利于酶的吸附,因此消化更快[13]。DE SCHEPPER等[11]研究发现在制麦芽过程中,所考察的3个品种酿造的大麦均表现出小颗粒淀粉比大颗粒淀粉的水解速度更快。但是,粒径对大麦淀粉颗粒SDS和RS含量的影响缺乏规律。对于苏啤6号大麦淀粉,RS含量随着粒径减小而下降,而西引2号和京辛1号淀粉的RS含量在中颗粒上出现最低值。LIN等[45]研究发现,对于高直链玉米淀粉,颗粒中RS含量随着粒径减小而增加,而对于普通玉米淀粉,粒径对RS含量的影响无显著性差异。这表明淀粉颗粒的酶解消化性不仅与粒径有关,而且与淀粉颗粒本身的性质或来源有关[46]。
4 结论
本研究选取3种大麦淀粉,采取沉降分离法得到大、中、小3个粒径的大麦淀粉颗粒。从体积百分比看,大颗粒淀粉占87.62%—89.48%,中颗粒淀粉占8.97%—9.42%,小颗粒淀粉占1.55%—3.29%。所有淀粉的结晶型均为A型,相对结晶度随着粒径增大而增加。大麦淀粉的表观直链淀粉含量在19.12—30.63 g/100 g,粒径对其含量的影响缺乏规律性。大麦支链淀粉的侧链分布呈现双峰模式,主峰在DP 12处,次峰在DP 38处。大麦支链淀粉平均链长为DP 22.86—25.00,以B1链比例最高,其次是A链。就热特性而言,小颗粒大麦淀粉的糊化温度区间(∆)最大,而糊化焓(∆)随粒径增加而增大。大麦淀粉的膨胀力存在品种间差异,京辛1号大麦淀粉具有较高的膨胀力。就糊化特性而言,大颗粒淀粉比小颗粒淀粉的峰值黏度、崩解值、冷糊黏度更高。大麦淀粉颗粒快消化淀粉含量随粒径减小而增加,而粒径对其慢消化淀粉和抗性淀粉含量的影响缺乏规律。不同粒径大麦淀粉的应用特性值得深入研究。
[1] ZHANG B J, LI X X, LIU J, XIE F W, CHEN L.Supramolecular structure of A- and B-type granules of wheat starch.Food Hydrocolloids, 2013, 31(1): 68-73.
[2] SHANG J Y, LI L, ZHAO B, LIU M, ZHENG X L.Comparative studies on physicochemical properties of total, A- and B-type starch from soft and hard wheat varieties.International Journal of Biological Macromolecules, 2020, 154: 714-723.doi: 10.1016/j.ijbiomac.2020.03.150.
[3] PUNIA S.Barley starch: Structure, properties anddigestibility-A review.International Journal of Biological Macromolecules, 2020, 155: 868-875.doi:10.1016/j.ijbiomac.2019.11.219.
[4] 韦存虚, 张静, 钟方旭, 周卫东, 许如根, 马雷.啤酒大麦与饲用大麦籽粒结构和淀粉粒的比较研究.麦类作物学报, 2006, 26(4): 133-138.
WEI C X, ZHANG J, ZHONG F X, ZHOU W D, XU R G, MA L.Comparison of the starch granule and kernel structure between feed and malt barley varieties.Journal of Triticeae Crops, 2006, 26(4): 133-138.(in Chinese)
[5] YU W W, TAN X L, ZOU W, HU Z X, FOX G P, GIDLEY M J, GILBERT R G.Relationships between protein content, starch molecular structure and grain size in barley.Carbohydrate Polymers, 2017, 155: 271-279.doi: 10.1016/j.carbpol.2016.08.078.
[6] JAISWAL S, MONICA B, GEETIKA A, ROSSNAGEL B G, CHIBBAR R N.Development of barley (L.) lines with altered starch granule size distribution.Journal of Agricultural and Food Chemistry, 2014, 62(10): 2289-2296.
[7] TAKEDA Y, TAKEDA C, MIZUKAMI H, HANASHIRO I.Structures of large, medium and small starch granules of barley grain.Carbohydrate Polymers, 1999, 38(2):109-114.
[8] MYLLRINEN P, AUTIO K, SCHULMAN A H, POUTANEN K.Heat-induced structural changes of small and large barley starch granules.Journal of the Institute of Brewing, 1998, 104: 343-349.
[9] NAGULESWARAN S, VASANTJAN T, HOOVER R, BRESSLER D.The susceptibility of large and small granules of waxy, normal and high-amylose genotypes of barley and corn starches toward amylolysis at sub-gelatinization temperatures.Food Research International, 2013, 51(2): 771-782.
[10] AHMED Z, TETLOW I J, FALK D E, LIU Q, EMES M J.Resistant starch content is related to granule size in barley.Cereal Chemistry, 2016, 93(6): 618-630.
[11] DE SCHEPPER C F, MICHIELS P, LANGENAEKEN N A, COURTIN C M.Accurate quantification of small and large starch granules in barley and malt.Carbohydrate Polymers, 2020, 227: 115329.doi: 10.1016/j.carbpol.2019.115329.
[12] LANGENAEKEN N A, DE SCHEPPER C F, DE SCHUTTER D P, COURTIN C M.Different gelatinization characteristics of small and large barley starch granules impact their enzymatic hydrolysis and sugar production during mashing.Food Chemistry, 2019, 295: 138-146.doi:10.1016/j.foodchem.2019.05.045.
[13] DE SCHEPPER C F, GIELENS D R S, COURTIN C M.A new method to isolate and separate small and large starch granules from barley and malt.Food Hydrocolloids, 2021, 120: 106907.
[14] GUO Q, HE Z H, XIA X C, QU Y Y, ZHANG Y.Effects of wheat starch granule size distribution on qualities of Chinese steamed bread and raw white noodles.Cereal Chemistry, 2014, 91(6): 623-630.
[15] TANG H J, ANDO H, WATANABE K, TAKEDA Y, MITSUNAGA T.Some physicochemical properties of small-, medium-, and large- granule starches in fractions of waxy barley grain.Cereal Chemistry, 2000, 77(1): 27-31.
[16] DHITAL S, SHRESTHA A K, GIDLEY M J.Relationship between granule size anddigestibility of maize and potato starches.Carbohydrate Polymers, 2010, 82(2): 480-488.
[17] XIAO H X, WANG S Y, XU W Z, YIN Y Q, XU D, ZHANG L, LIU G Q, LUO F J, SUN S G, LIN Q L, XU B C.The study on starch granules by using darkfield and polarized light microscopy.Journal of Food Composition and Analysis, 2020, 92: 103576.
[18] MEI J Y, ZHANG L, LIN Y, LI S B, BAI C H, FU Z.Pasting, rheological, and thermal properties and structural characteristics of large and smallstarch granules.Starch-Stärke, 2020, 72(11): 1900293.
[19] LIU T X, MA M X, GUO K, HU G L, ZHANG L, WEI C X.Structural, thermal, and hydrolysis properties of large and small granules from C-type starches of four Chinese chestnut varieties.International Journal of Biological Macromolecules, 2019, 137: 712-720.
[20] GAO L C, WANG H L, WAN C X, LENG J J, WANG P K, YANG P, GAO X L, GAO J F.Structural, pasting and thermal properties of common buckwheat (Moench) starches affected by molecular structure.International Journal of Biological Macromolecules, 2020, 156: 120-126.doi:10.1016/j.ijbiomac.2020.04.064.
[21] LIN L S, HUANG J, ZHAO L X, WANG J, WANG Z F, , WEI C X.Effect of granule size on the properties of lotus rhizome C-type starch.Carbohydrate Polymers, 2015, 134: 448-457.doi:10.1016/j.carbpol.2015.08.026.
[22] AL-ANSI W, MUSHTAQ B S, MAHDI A A, AL-MAQTARI Q A, AL-ADEEB A, AHMED A, FAN M C, LI Y, QIAN H F, LIU J X, WANG L.Molecular structure, morphological, and physicochemical properties of highlands barley starch as affected by natural fermentation.Food Chemistry, 2021, 356: 129665.doi: 10.1016/j.foodchem.2021.129665.
[23] 张慧, 洪雁, 顾正彪, 汪振炯.3种谷物全粉中淀粉的消化性及影响因素.食品与发酵工业, 2012, 38(11): 26-31.
ZHANG H, HONG Y, GU Z B, WANG Z J.Starch digestibility and the influence factors in three grain flours.Food and Fermentation Industries, 2012, 38(11): 26-31.(in Chinese)
[24] HANASHIRO I, ABE J, HIZUKURI S.A periodic distribution of the chain length of amylopectin as revealed by high-performance anion- exchange chromatography.Carbohydrate Research, 1996, 283(2): 151-159.
[25] LI C Y, ZHOU D D, FAN T, WANG M Y, ZHU M, DING J G, ZHU X K, GUO W S, SHI Y C.Structure and physicochemical properties of two waxy wheat starches.Food Chemistry, 2020, 318: 126492.doi: 10.1016/j.foodchem.2020.126492.
[26] KASEMWONG K, PIYACHOMKWAN K, WANSUKSRI R, SRIROTH K.Granule sizes of(edulis) starches and their reactivity toward hydration, enzyme hydrolysis and chemical substitution.Starch/Staerke, 2008, 60(11): 624-633.
[27] GAO J, VASANTHAN T, HOOVER R.Isolation and characterization of high-purity starch isolates from regular, waxy, and high-amylose hulless barley grains.Cereal Chemistry, 2009, 86(2): 157-163.
[28] DHITAL S, SHRESTHA A K, HASJIM J, GIDLEY M J.Physicochemical and structural properties of maize and potato starches as a function of granule size.Journal of Agricultural and Food Chemistry, 2011, 59(18): 10151-10161.doi:10.1021/jf202293s.
[29] TANG H J, ANDO H, WATANABE K, TAKEDA Y, MITSUNAGA T.Physicochemical properties and structure of large, medium and small granule starches in fractions of normal barley endosperm.Carbohydrate Research, 2001, 330(2): 241-248.
[30] JAMES M G, DENYER K, MYERS A M.Starch synthesis in the cereal endosperm.Current Opinion in Plant Biology, 2003, 6(3): 215-222.doi: 10.1016/s1369-5266(03)00042-6.
[31] CHEN G X, ZHU J T, ZHOU J W, SUBBURAJ S, ZHANG M, HAN C X, HAO P C, LI X H, YAN Y M.Dynamic development of starch granules and the regulation of starch biosynthesis in: Comparison with common wheat and.BMC Plant Biology, 2014, 14: 198.doi:10.1186/s12870-014-0198-2.
[32] CAO H, YAN X, CHEN G X, ZHOU J W, LI X H, MA W J, YAN Y M.Comparative proteome analysis of A- and B-type starch granule-associated proteins in bread wheat (L.) and.Journal of Proteomics, 2015, 112: 95-112.doi: 10.1016/j.jprot.2014.08.002.
[33] WEI C X, ZHANG J, ZHOU W D, CHEN Y F, XU R G.Development of small starch granule in barley endosperm.Acta Agronomica Sinica, 2008, 34(10): 1788-1796.
[34] KUMARI S, YADAV B S, YADAV R B.Effect of nano-conversion on morphological, rheological and thermal properties of barley starch.Journal of Food Science and Technology, 2022, 59(2): 467-477.doi: 10.1007/s13197-021-05029-0.
[35] LI W H, GAO J M, WU G, ZHENG J M, OUYANG S H, LUO Q G.Physicochemical and structural properties of A- and B-starch isolated from normal and waxy wheat: Effects of lipids removal.Food Hydrocolloids, 2016, 60: 364-373.
[36] SONG Y, JANE J.Characterization of barley starches of waxy, normal, and high amylose varieties.Carbohydrate Polymers, 2000, 41(4): 365-377.
[37] KÄLLMAN A, VAMADEVAN V, BERTOFT E, KOCH K, SEETHARAMAN K, ÅMAN P, ANDERSSON R.Thermal properties of barley starch and its relation to starch characteristics.International Journal of Biological Macromolecules, 2015, 81: 692-700.doi: 10.1016/j.ijbiomac.2015.08.068.
[38] ZHAO X, ANDERSSON M, ANDERSSON R.A simplified method of determining the internal structure of amylopectin from barley starch without amylopectin isolation.Carbohydrate Polymers, 2021, 255: 117503.doi: 10.1016/j.carbpol.2020.117503.
[39] 李春燕, 封超年, 王亚雷, 张容, 郭文善, 朱新开, 彭永欣.不同小麦品种支链淀粉链长分配及其与淀粉理化特性的关系.作物学报, 2007, 33(8): 1240-1245.doi: 10.3321/j.issn: 0496-3490.2007.08.004.
LI C Y, FENG C N, WANG Y L, ZHANG R, GUO W S, ZHU X K, PENG Y X.Chain length distribution of debranched amylopectin and its relationship with physicochemical properties of starch in different wheat cultivars.Acta Agronomica Sinica, 2007, 33(8): 1240-1245.doi: 10.3321/j.issn: 0496-3490.2007.08.004.(in Chinese)
[40] LI C, GONG B, HUANG T, YU W W.digestion rate of fully gelatinized rice starches is driven by molecular size and amylopectin medium-long chains.Carbohydrate Polymers, 2021, 254: 117275.doi:10.1016/j.carbpol.2020.117275.
[41] REGINA A, BLAZEK J, GILBERT E, FLANAGAN B M, GIDLEY M J, CAVANAGH C, RAL J P, LARROQUE O, BIRD A R, LI Z, MORELL M K.Differential effects of genetically distinct mechanisms of elevating amylose on barley starch characteristics.Carbohydrate Polymers, 2012, 89(3): 979-991.doi: 10.1016/j.carbpol.2012.04.054.
[42] MORELL M K, KOSAR-HASHEMI B, CMIEL M, SAMUEL M S, CHANDLER P, RAHMAN S, BULEON A, BATEY I L, LI Z.Barley sex6 mutants lack starch synthase IIa activity and contain a starch with novel properties.The Plant Journal, 2003, 34(2): 173-185.doi: 10.1046/j.1365-313x.2003.01712.x.
[43] TANG H J, WATANABE K, MITSUNAGA T.Structure and functionality of large, medium and small granule starches in normal and waxy barley endosperms.Carbohydrate Polymers, 2002, 49(2): 217-224.
[44] GEERA B P, NELSON J E, SOUZA E, HUBER K C.Composition and properties of A- and B-type starch granules of wild-type, partial waxy, and waxy soft wheat.Cereal Chemistry, 2006, 83(5): 551-557.
[45] LIN L S, GUO D W, HUANG J, ZHANG X D, ZHANG L, WEI C X.Molecular structure and enzymatic hydrolysis properties of starches from high-amylose maize inbred lines and their hybrids.Food Hydrocolloids, 2016, 58: 246-254.
[46] RAMADOSS B R, GANGOLA M P, AGASIMANI S, JAISWAL S, VENKATESAN T, SUNDARAM G R, CHIBBAR R N.Starch Granule size and amylopectin chain length influence starchenzymatic digestibility in selected rice mutants with similar amylose concentration.Journal of Food Science and Technology, 2019, 56(1): 391-400.doi: 10.1007/s13197-018-3500-8.
Effects of Starch Granule Size on the Physical and Chemical Properties of Barley Starches
XIAO LuTing1, LI XiuHong1, LIU LiJun1, YE FaYin1,2,3*, ZHAO GuoHua1,2,3
1College of Food Science, Southwest University, Chongqing 400715;2Chongqing Key Laboratory of Speciality Food Co-Built by Sichuan and Chongqing, Chongqing 400715;3Chongqing Engineering Research Center for Regional Foods, Chongqing 400715
【Objective】Barley, an important source of cereal raw material, is widely used in beer brewing, livestock feeding, and medicine and food healthcare, etc.Empirical evidences have showed that the granule size, composition and structure of starch in barley grain mainly determine its use.The present research was carried out to analyze the composition, structure and physicochemical properties of starch granules with different sizes from different barley varieties, which could help enhancing the utilization of barley starch from barley processing industries.【Method】The starch from selected barley varieties, Xiyin-2, Jingxin-1 and Supi-6, was extracted and fractionated into large, medium and small-sized fractions by using differential sedimentation methods.The effects of granular size on micromorphology, crystal structure, apparent amylose content, amylopectin side chain distribution, thermal properties, hydration properties, gelatinization properties, and digestibility properties of barley starch was investigated.【Result】The large-sized granules were mostly discal shape, while the medium-sized granules were oblate or oval spherical shape, and the small-sized granules were spherical or polygonal shape.All barley starch granules had a typical polarized cross under a polarized light microscope, and the polarized light spots enhanced as the granule size increased.The large-sized fraction had the highest percentages (87.62%-89.48%) in barley starch, followed by medium-sized fraction (8.97%-9.42%) and small-sized fraction (1.55%-3.29%).The apparent amylose content of barley starch ranged from 19.12 to 30.63 g/100 g.The effect of granule size on its content was not regular.All the samples were A-type crystals, and the relative crystallinity augmented with the increase of granule size.The side chain distribution of barley amylopectin presented a bimodal pattern, with the main peak at DP 12 and the secondary peak at DP 38.The highest content of amylopectin in barley starch was B1chain (34.34%-44.76%), followed by A chain (25.12%-34.52%).The average chain length of barley amylopectin was DP 22.86-25.00.The thermal characteristics of starch from barley varieties demonstrated that the gelatinization temperature range (∆) of small-sized granules was the largest, and the gelatinization enthalpy (∆) increased as the granule size increased.The swelling power of barley starch showed differences in varieties.All granule fractions of Jingxin-1 barley starch had higher swelling power.The results of pasting properties suggested that the small-sized granules had higher peak viscosity, breakdown and final viscosity of than the medium and small-sized granules.The results of digestibility characteristics showed that the rapidly digestible starch content of barley starch increased with the decrease of granule size, but the influence of granule size on its slowly digestible starch and resistant starch contents was not regular.【Conclusion】The granule size had a great influence on the structural characteristics of barley starch, such as the amylose content, the fine structure of amylopectin, and the relative crystallinity, thereby affecting the thermal properties, pasting properties, and digestibility characteristics of barley starch.The application characteristics of barley starch with different granule sizes were worthy of in-depth study.
starch granule size; barley starch; molecular structure; processing characteristics; digestibility characteristics
2021-06-17;
2021-09-08
国家自然科学基金面上项目(31871837)、国家自然科学基金青年基金(31601401)、2019年重庆市留学人员回国创业创新支持计划(cx2019071)、重庆市技术创新和应用发展专项重点项目(cstc2019jscx-dxtwBX0029)
肖璐婷,E-mail:xlt123456789@email.swu.edu.cn。通信作者叶发银,E-mail:fye@swu.edu.cn.
(责任编辑 赵伶俐)

