壮骨健膝方含药血清对脂多糖诱导兔膝滑膜巨噬细胞炎症反应的效应浓度研究
林 震,郭洁梅,陈 鹏,肖 艳,张 鹏,张英杰,苏友新*
(1.福建中医药大学康复医学院,福建 福州 350122;2.福建卫生职业技术学院,福建 福州 350101;3.福建中医药大学中医学院,福建 福州 350122)
90%膝骨关节炎(knee osteoarthritis,KOA)患者伴有不同程度的滑膜炎症,且滑膜炎症贯穿KOA发病的始终,其炎症进展与KOA的病情发展呈正相关[1]。课题组前期从动物组织层面展开了研究,发现具有“痹痿同治”功效的壮骨健膝方可有效抑制兔KOA滑膜炎症[2-4]。滑膜巨噬细胞作为KOA滑膜炎中的主要参与者[5],可用于壮骨健膝方抗炎功效的研究。血清药理学是以机体含药血清代替药物干预细胞的实验方法,被广泛应用于中药复方的机制研究[6]。然而不同浓度的含药血清对细胞的影响是多样的[7],高浓度血清在起效的同时可能会对细胞产生毒性作用,低浓度血清可能由于药效物质浓度较低,达不到起效浓度,从而出现假阴性结果。因此在开展含药血清干预细胞的相关研究时,有必要对效应浓度进行摸索。故本研究通过CCK8法和ELISA法研究壮骨健膝方含药血清干预LPS诱导兔膝滑膜巨噬细胞炎症反应的效应浓度,为后续相关实验提供依据。
1 实验材料
1.1 实验动物与细胞 3月龄普通级新西兰大白兔12只,体质量(2.0±0.25)kg,由上海市松江区松联实验动物场提供,许可证编号:SCXK(沪)2017-0008。委托福建中医药大学实验动物中心代购并饲养,许可证号:SYXK(闽)2014-0006。兔膝滑膜巨噬细胞由上海青旗生物技术发展有限公司提供,货号:BFN2101831。
1.2 实验药物 壮骨健膝方组成:骨碎补15 g,杜仲9 g,川牛膝12 g,生地黄15 g,独活6 g,鸡血藤15 g,秦艽9 g,徐长卿9 g,土鳖虫6 g。上述药材均购于福建中医药大学国医堂,并经福建中医药大学中西医结合研究院曾建伟副研究员鉴定,符合《中华人民共和国药典》要求。全方中药饮片置于600 mL水中浸泡20 min后,用武火煎煮至沸腾,然后转文火煎煮15 min,倒出药液。再次加水400 mL,煎煮30 min。将2次所煎得的药液混合,用旋转蒸发仪浓缩成含生药1 g/mL的壮骨健膝方药液备用。
1.3 实验试剂 DMEM培养基(美国HyClone公司,批号:AE29163339);胎牛血清(澳洲ExCell Bio公司,批号:11G362);乌拉坦(上海源叶生物科技有限公司,批号:Z28N10Y104506);脂多糖(中国Biosharp公司,货号:BS007);兔白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、基质金属蛋白酶-3(MMP-3)和MMP-13 ELISA试剂盒(江苏酶免实业有限公司,批号:2112023、2112015、2112030、2112033);CCK8试剂盒(武汉博士德生物工程有限公司,批号:16J29C60)。
1.4 实验仪器 ELX800型全自动酶标仪(美国Bio-Tek公司);IC-1000型Countstar细胞计数仪(上海睿钰生物科技有限公司);DMIL/DFC295型倒置相差显光学微镜(德国LEICA公司);TDZ4A-WS型低速离心机(湖南湘仪仪器有限公司);E163302型CO2培养箱(美国Thermo Scientific公司);RE-52AA型旋转蒸发仪(上海亚荣生化仪器厂)。
2 方法与结果
2.1 含药血清与空白血清制备 12只新西兰大白兔,随机分为壮骨健膝方组6只和空白组6只,根据前期研究并参照人与动物体质量折算的等效剂量[8],壮骨健膝方组按4.58 mL/(kg·d)予壮骨健膝方药液灌胃,空白组予等体积生理盐水灌胃,分上下午2次,持续3 d。于末次给药后1 h,应用20%乌拉坦(5 mL/kg)对兔进行腹腔注射麻醉,待角膜反射消失后行腹主动脉采血,全血静置于4℃冰箱4 h后,2 500 r/min离心30 min,分离血清,将同组血清混合,56℃水浴灭活30 min,用0.22μm过滤器过滤,分装即得。
2.2 不同浓度的血清完全培养液制备 取离心管,依次加入细胞培养液、壮骨健膝方含药血清、青霉素/链霉素双抗溶液,配制成5%、10%、15%、20%、25%壮骨健膝方含药血清完全培养液(以下简称含药完培),同法配制相同浓度空白血清完全培养液(以下简称空白完培)和10%胎牛血清完全培养液(以下简称普通完培),于-20℃冰箱保存备用。
2.3 统计学方法 采用SPSS 21.0统计软件进行统计分析,计量资料以(±s)表示,数据符合正态分布,多组间比较采用单因素方差分析,方差齐用LSD检验,方差不齐时采用Games-Howell检验,不符合正态分布,采用非参数检验。
2.4 CCK8法筛选含药血清干预浓度实验 取生长状况良好的兔膝滑膜巨噬细胞,按7×103个细胞/孔的密度接种于96孔板,随机分为对照组、空白血清组及含药血清组,分别采用普通完培、含药完培(5%、10%、15%、20%、25%)和空白完培(5%、10%、15%、20%、25%)培养24 h,弃去原培养液,加入10%CCK8溶液避光孵育2 h,使用酶标仪在450 nm处测定每孔的吸光度。实验结果显示,5%、10%、15%含药血清组细胞活性与同浓度下空白血清组比较,差异无统计学意义(P>0.05),故筛选出对细胞没有毒性的3个含药完培浓度(5%、10%、15%)作为后续实验的干预浓度,见表1。
表1 不同血清培养液干预后兔膝滑膜巨噬细胞活性比较(±s)
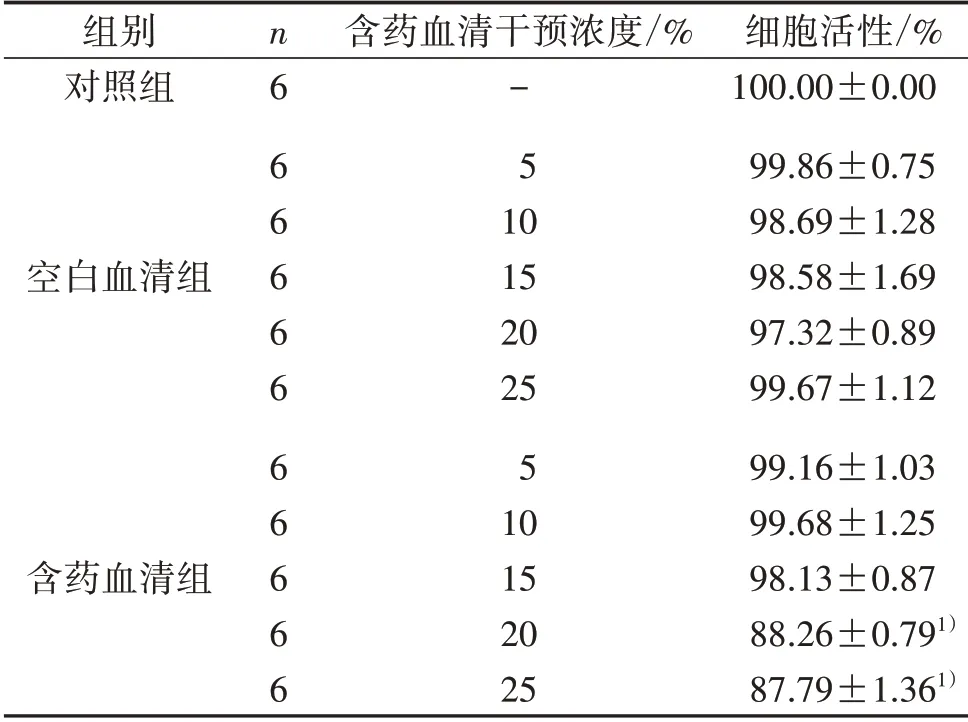
表1 不同血清培养液干预后兔膝滑膜巨噬细胞活性比较(±s)
注:与同浓度空白血清组比较,1)P<0.05。
组别对照组空白血清组含药血清组n6 66666 66666含药血清干预浓度/%-5 10 15 20 25 5 10 15 20 25细胞活性/%100.00±0.00 99.86±0.75 98.69±1.28 98.58±1.69 97.32±0.89 99.67±1.12 99.16±1.03 99.68±1.25 98.13±0.87 88.26±0.791)87.79±1.361)
2.5 筛选LPS诱导兔膝滑膜巨噬细胞致炎时间实验 兔膝滑膜巨噬细胞以1×105个细胞/孔的密度接种于24孔板,随机分为空白组和LPS组。空白组加入普通完培,LPS组加入含1.0μg/mL的LPS培养液,分别培养12、24、36、48 h后,收集各组细胞上清液,ELISA法检测IL-1β、TNF-α含量。结果表明各组别上清液中于各检测时间点均可见IL-1β、TNF-α的分泌。与空白组比较,LPS组各时间点的兔膝滑膜巨噬细胞上清液中IL-1β、TNF-α的含量均明显升高(P<0.05);LPS组内各时间点比较,刺激12 h后滑膜巨噬细胞上清液中IL-1β、TNF-α的含量最高(P<0.05),见表2。结合文献[9],以IL-1β、TNF-α含量较高的12 h作为后续实验LPS诱导兔膝滑膜巨噬细胞致炎的时间。
表2 空白组和LPS组不同时间干预后细胞上清液IL-1β、TNF-α含量比较(±s)
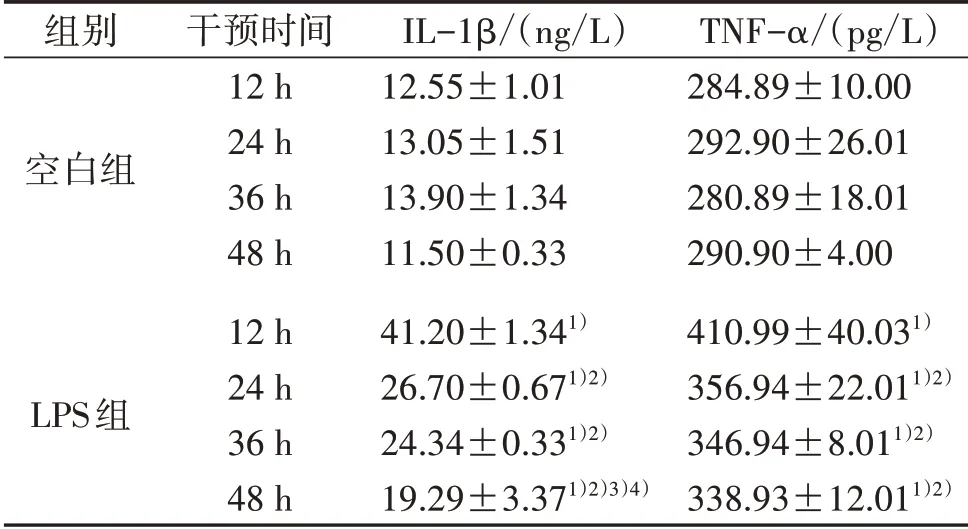
表2 空白组和LPS组不同时间干预后细胞上清液IL-1β、TNF-α含量比较(±s)
注:与相同时间的空白组比较,1)P<0.05;与12 h LPS组比较,2)P<0.05;与24 h LPS组比较,3)P<0.05;与36 h LPS组比较,4)P<0.05。
组别空白组LPS组干预时间12 h 24 h 36 h 48 h 12 h 24 h 36 h 48 h IL-1β/(ng/L)12.55±1.01 13.05±1.51 13.90±1.34 11.50±0.33 41.20±1.341)26.70±0.671)2)24.34±0.331)2)19.29±3.371)2)3)4)TNF-α/(pg/L)284.89±10.00 292.90±26.01 280.89±18.01 290.90±4.00 410.99±40.031)356.94±22.011)2)346.94±8.011)2)338.93±12.011)2)
2.6 ELISA法检测各组细胞上清中IL-1β、TNF-α、MMP-3、MMP-13含量 兔膝滑膜巨噬细胞以1×105个/孔接种于6孔板,随机分为空白组、模型组和5%、10%、15%含药血清组,空白组添加10%空白完培,模型组和5%、10%、15%含药血清组经1.0μg/mL的LPS培养液致炎12 h后,模型组添加10%空白完培,5%、10%、15%含药血清组分别添加5%、10%、15%含药完培,24 h后收集各组细胞上清液,ELISA法检测各组上清中IL-1β、TNF-α、MMP-3、MMP-13含量。结果显示,各组均可见IL-1β、TNF-α、MMP-3、MMP-13的分泌,与空白组比较,模型组IL-1β、TNF-α、MMP-3、MMP-13含量明显升高(P<0.05);与模型组比较,10%、15%含药血清组IL-1β、TNF-α、MMP-3、MMP-13含量均明显降低(P<0.05)。见表3。
表3 各组兔膝滑膜巨噬细胞上清液IL-1β、TNF-α、MMP-3及MMP-13含量比较(n=3,±s)
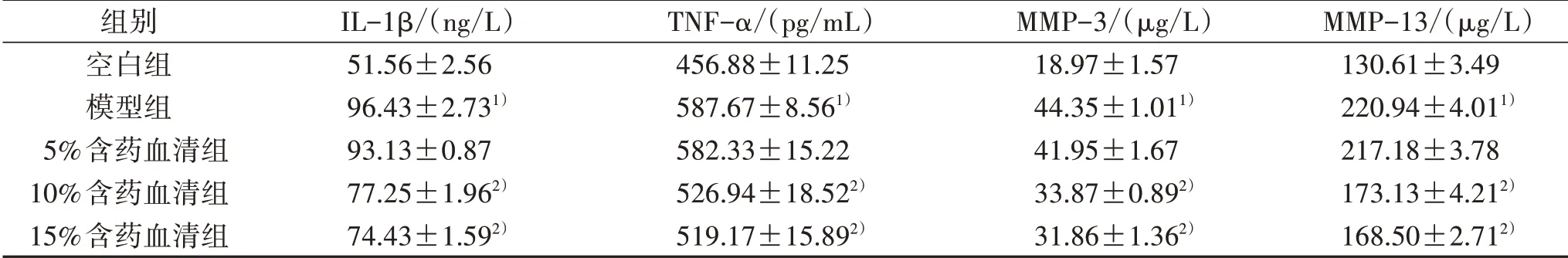
表3 各组兔膝滑膜巨噬细胞上清液IL-1β、TNF-α、MMP-3及MMP-13含量比较(n=3,±s)
注:与空白组比较,1)P<0.05;与模型组比较,2)P<0.05。
组别空白组模型组5%含药血清组10%含药血清组15%含药血清组IL-1β/(ng/L)51.56±2.56 96.43±2.731)93.13±0.87 77.25±1.962)74.43±1.592)TNF-α/(pg/mL)456.88±11.25 587.67±8.561)582.33±15.22 526.94±18.522)519.17±15.892)MMP-3/(μg/L)18.97±1.57 44.35±1.011)41.95±1.67 33.87±0.892)31.86±1.362)MMP-13/(μg/L)130.61±3.49 220.94±4.011)217.18±3.78 173.13±4.212)168.50±2.712)
3 讨论
KOA的发病虽以关节软骨退变为主,但其病理变化并不仅限于软骨局部[10-11]。越来越多的研究发现,滑膜炎症与KOA的发生和发展密切相关,滑膜炎症过程中各种因素反复刺激滑膜组织,促使炎症因子、基质金属蛋白酶等被大量释放,它们在加重滑膜炎症反应的同时,又反复刺激关节软骨,造成软骨的损害,进一步加剧KOA的进展[12-14]。
壮骨健膝方是苏友新教授根据KOA“痹痿同病”病机特点所创立的效验方,该方由骨碎补、杜仲、川牛膝等药物组成,具有补肝肾、强筋骨、祛风湿、止痹痛之功用,临床疗效显著[2-3]。本研究采用血清药理学的方法,通过LPS诱导兔膝滑膜巨噬细胞炎症反应,研究壮骨健膝方含药血清抑制滑膜炎症的效应浓度。结果发现5%、10%、15%壮骨健膝方含药血清对兔膝滑膜巨噬细胞无毒性作用。进一步研究发现,10%、15%壮骨健膝方含药血清可有效抑制LPS诱导的兔膝滑膜巨噬细胞炎性因子IL-1β和TNF-α以及基质金属蛋白酶MMP-3和MMP-13的生成,发挥抑制滑膜炎症的功效,为该方含药血清的效应浓度,且二者抗炎作用相当。而5%壮骨健膝方含药血清无显著的抗炎作用,推测可能是血清浓度较低,血清中的有效成分浓度尚未达到起效水平所致。
综上所述,本实验结果表明10%、15%壮骨健膝方兔含药血清为干预LPS诱导兔膝滑膜巨噬细胞炎症反应的效应浓度,由于二者抗炎作用相近,为节约血清成本,故建议后续研究采用10%含药血清更为适宜。

