肝细胞癌骨转移中APEX1和JAG1的表达及意义
方雪婷 张丽 蔡素琴 王声耀 吴春林
原发性肝细胞癌(hepatocellular carcinoma,HCC)是消化道系统常见的恶性肿瘤,在全球恶性肿瘤死因中位居第4位,复发和转移是导致患者死亡的主要原因。大多数患者在疾病晚期被诊断出来,5年生存率4.7%~32.8%[1]。此外,肝外转移很常见,最常见的肝外转移部位是肺,其次是骨、淋巴结和肾上腺。文献报道,肝细胞癌骨转移(hepatocellular carcinoma bone metastasis,HCC-BM)的发生率为3%~20%[2]。脱嘌呤/脱嘧啶核酸内切酶1(apurinic/apyrimidinic endonuclease-1,APEX1)具有DNA损伤修复功能以及氧化还原功能,可以调节多种转录因子,与细胞的增殖活化及部分肿瘤的转移进展有关[3]。本研究小组前期实验发现APEX1和Notch受体配体之一JAG1基因在肝细胞癌中的过表达具有相关性[4]。现有的关于HCC-BM的报道较少,APEX1和JAG1基因是否促进HCC-BM尚不清楚。本研究收集福建医科大学附属第一医院及第二医院近年收治的HCC-BM病例,并采用免疫组化同时分析APEX1和JAG1在HCC及HCC-BM中的表达,通过对其临床及病理特征的分析,探索肝细胞癌恶性进展新的治疗靶点。
1 资料与方法
1.1 病例筛选
收集2012年1月—2019年12月就诊于福建医科大学附属第一和第二医院的肝细胞癌和肝外转移患者进行资料分析。纳入标准:(1)手术后病理检查确诊为肝细胞癌;(2)病理检查确诊为骨转移。排除标准:(1)混合性肝细胞癌-胆管细胞癌患者;(2)原发灶为肝细胞癌,但骨转移为其他来源的恶性肿瘤转移(如肺癌骨转移、原发骨肿瘤等);(3)原发灶为肝细胞癌,可疑存在骨病变,但活体组织检查或切除标本未发现恶性成分(包括无法取得可以证实存在肝细胞癌骨转移标本的患者)。本次研究经过本院医学伦理委员会同意。
1.2 临床资料
一般资料包括患者性别、年龄等一般情况,骨转移部位等。病理资料包括:肝肿瘤病理学类型、骨转移灶病理学特征。
1.3 免疫组化染色
所有标本均经10%中性福尔马林固定,常规脱水,石蜡包埋,4 μm厚切片,进行HE及免疫组织化学Envision法染色,具体步骤根据说明书进行。APEX1、JAG1抗体购自英国abcam公司。JAG1阳性定位于细胞质,APEX1阳性定位于细胞质和/或胞核内,本研究将胞质的表达和胞核的表达分开评分。细胞着色强度评分:无色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分[5]。根据阳性细胞所占的百分比分为:无着色细胞为0分,阳性细胞数≤25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。总染色评分=染色强度评分×阳性细胞百分比分数。<4分定义为低表达,≥4分为高表达[5]。
1.4 统计学方法
采用SPSS 19.0软件进行统计学分析。计量资料以(±s)表示,采用t检验,免疫组化结果等计数资料以率(%)表示,采用χ2检验,相关性分析采用Spearman秩相关分析;P<0.05为差异有统计学意义。
2 结果
2.1 临床资料分析及骨转移的部位及特点
2012年1月—2019年12月在福建医科大学附属第一和第二医院接受治疗的肝细胞癌和肝外转移患者共464例,79例发生骨转移;其中男性71例,女性8例,患者男女比例8.9∶1;年龄30~86岁,平均年龄(55.20±16.23)岁,中位年龄53岁。本研究共纳入HCC-BM患者79例,其发生率为17.02%(79/464)。单发骨转移灶者73例(92.40%),多发骨转移灶者6例(7.59%);其中5例发生2处骨转移,1例发生3处骨转移。单处骨转移的发生率明显高于多处骨转移。最常见的骨转移部位为脊柱59例(72.0%,含颈椎、胸椎、腰椎),其次为下肢骨转移者9例(11.0%),上肢骨转移者7例(8.5%);少数患者亦可发生颌骨、胸骨、肩胛骨等部位,见表1。

表1 患者HCC-BM的分布
2.2 APEX1、JAG1蛋白在HCC及HCC-BM中的表达
APEX1蛋白在HCC中细胞核阳性率为55.7%(44/79),在HCC-BM中细胞核阳性率为65.8%(52/79);两者相比,APEX1蛋白在细胞核上的表达差异无统计学意义(χ2=1.699,P=0.192)。APEX1蛋白在HCC中细胞质阳性率为46.8%(37/79),在HCC-BM中,细胞质阳性率为63.3%(50/79);两者相比差异有统计学意义(χ2=4.323,P=0.038)。JAG1在HCC-BM中的阳性率为62.0%(49/79),在HCC中的阳性率为41.8%(33/79),两组相比差异有统计学意义(χ2=6.490,P=0.011)。因此,在HCC-BM中APEX1蛋白、JAG1蛋白的表达均高于HCC。
2.3 APEX1、JAG1蛋白表达与HCC-BM临床病理特征的关系
APEX1、JAG1蛋白与临床病理参数关系的结果显示,JAG1蛋白在HCC-BM中表达水平与患者性别、年龄、乙肝表面抗原、原发灶数目等参数无关(P>0.05),而与肿瘤分化程度、是否合并骨外转移有关(P<0.05);APEX1胞质的表达与患者性别、年龄、乙肝表面抗原、骨转移数目、是否合并骨外转移无关(P>0.05);而与肿瘤的分化程度、原发灶的数目有关(P<0.05),见表2。
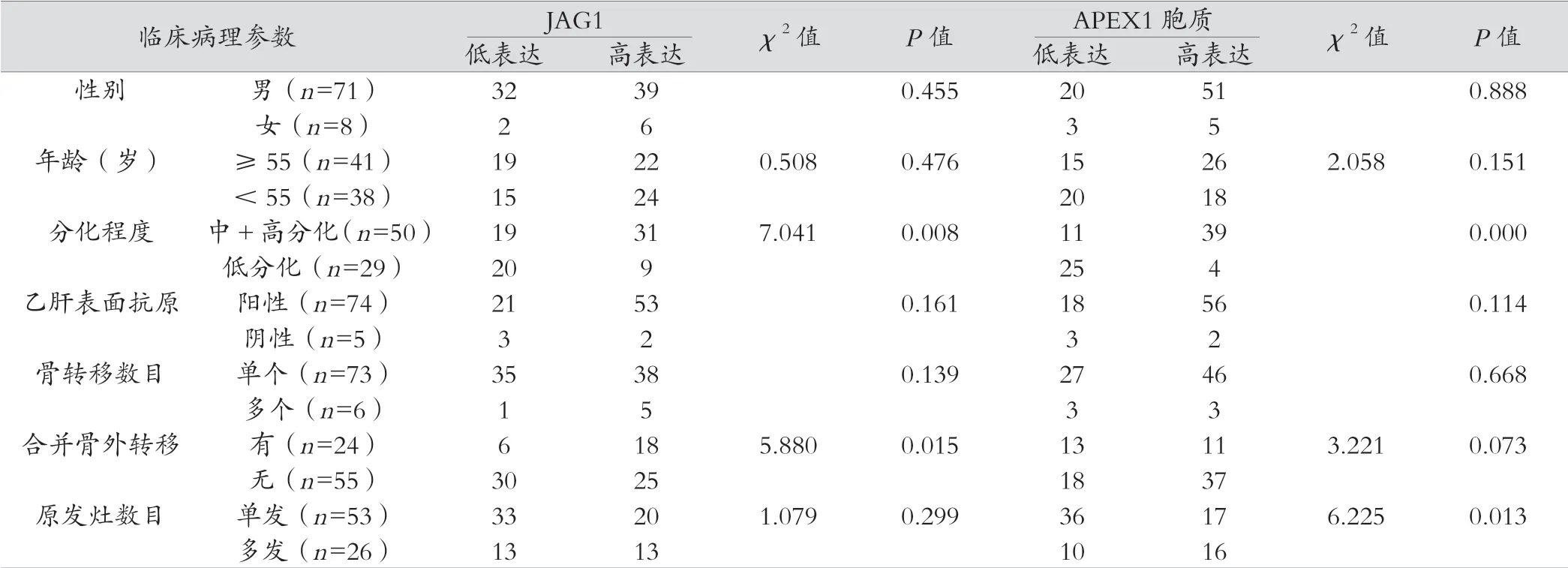
表2 APEX1 和JAG1的表达与肝细胞癌骨转移临床病理特征的相关性
2.4 HCC-BM中APEX1、JAG1蛋白表达的相关性分析
在HCC-BM中,APEX1细胞核的阳性率65.8%,细胞质阳性率63.3%,JAG1阳性率62.0%;Spearman秩相关分析显示APEX1细胞质表达高低与JAG1表达高低呈正相关(r=0.237,P=0.035)。
3 讨论
HCC是消化系统常见的恶性肿瘤之一,随着临床诊疗水平的不断进步,HCC患者的总生存时间获得延长,但是HCCBM发生率则显著升高,HCC骨转移的筛查与诊治已成为全球性热点与难点问题。目前认为血管形成和上皮-间质转化是HCC骨转移的主要致病机制,因此明确HCC骨转移的致病机制有助于临床肿瘤筛查及诊疗手段的提高[6]。
本研究收集的HCC-BM病例中,性别比例8.9∶1;中位年龄53岁,提示中老年男性患者发生骨转移的概率更大。由于HCC-BM少见,结合文献结果报道,HCC-BM的发生率为13%~38.5%[7-8]。本研究共纳入HCC-BM患者79例,其发生率为17.06%,与部分报道结果相近[8]。本研究显示最常见的骨转移部位为脊柱(72.0%,含颈椎、胸椎、腰椎),其次为下肢骨转移者9例(11.0%),上肢骨转移者7例(8.5%);少数患者亦可发生颌骨、胸骨、肩胛骨等部位,与既往报道一致[9]。
索拉非尼是治疗晚期HCC患者的主要化疗药物,但其疗效受到耐药的影响。有研究显示APEX1的高表达与HCC患者对索拉非尼治疗的耐药性相关。APEX1在索拉非尼耐药的HCC患者中的表达明显高于索拉非尼敏感的HCC患者[10]。APEX1参与DNA损伤反应,并在多种人体组织中表达。APEX1的异常表达会破坏多种生理过程,包括细胞氧化还原稳态、平滑肌细胞迁移、细胞周期、细胞凋亡和mRNA稳定性[11]。同时,APEX1的表达与骨肉瘤患者的预后呈正相关,且APEX1与骨肉瘤发生顺铂耐药密切相关。研究表明线粒体APEX1的高表达可以通过降低Rac1(p-Rac1)的磷酸化来降低ROS的产生,从而进一步促进骨肉瘤对顺铂的耐药[12]。血清APEX1水平作为胆管癌诊断和预后的潜在生物标志物,在胆管癌患者中,有转移的患者血清APEX1水平明显高于无转移的患者。血清APEX1水平越高,患者生存时间越短。血清APEX1水平可能是诊断和预后的生物标志物;并且APEX1的高表达与胆管癌的化疗耐药相关[13]。这些发现表明APEX1是HCC的潜在生物标志物,同时是肿瘤对化疗敏感的潜在治疗靶点。本实验应用免疫组化方法检测APEX1蛋白在79例HCC和HCC-BM中的表达情况,结果显示在HCCBM中APEX1蛋白在细胞质中的表达高于肝细胞癌组织。分析APEX1的表达与临床病理特征的关系发现,在HCC-BM中APEX1胞质的表达与患者性别、年龄、乙肝表面抗原、骨转移数目、是否合并骨外转移无关(P>0.05);而与肿瘤的分化程度、原发灶的数目有关(P<0.05)。结合本课题组前期工作[4],发现APEX1胞质表达在肝细胞癌中较癌旁肝组织增加,而且在HCC-BM中的表达较肝细胞癌中增加,且APEX1的表达与肿瘤的分化程度、原发灶数目密切相关,说明APEX1的表达参与肝细胞癌转移侵袭过程。
JAG1是5个细胞表面配体之一,主要在高度保守的Notch信号传导途径中发挥作用。JAG1在癌症生物学的多个方面发挥作用,包括肿瘤血管生成、肿瘤细胞生长、癌症干细胞、上皮-间质转化和转移过程[14]。在乳腺癌中,JAG1-Notch1-Zeb1-VEGFA介导的血管内分泌信号哺育乳腺癌干细胞[15]。在结肠癌中,JAG1介导APEX1促进肿瘤发生功能[3]。本组前期关于JAG1与HCC的研究中发现,JAG1在肝细胞癌中的表达增高,并且其表达与肿瘤术前AFP水平、分化程度、转移、复发密切相关,JAG1可能为HCC潜在的独立预后因子之一。本组结果表明JAG1在HCC-BM中的表达高于HCC,JAG1蛋白在HCC-BM中表达水平与患者性别、年龄、乙肝表面抗原、原发灶数目等参数无关(P>0.05),而与肿瘤分化程度、是否合并骨外转移有关(P<0.05)。
在结肠癌中,APEX1异常表达并激活Notch信号通路[3]。在乳腺癌中,JAG1促使Notch1依赖性的Zeb1的上调,从而增加了血管内皮生长因子(VEGFA)的产生,并以旁分泌的方式相互诱导内皮细胞JAG1,强调针对血管内分泌的JAG1-Notch1-Zeb1-VEGFA信号通路可以降低乳腺癌的侵袭性[15]。Sun等[16]提出,DNA修复基因APEX1能够促进一系列细胞因子、生长因子和蛋白酶的产生,其中包括VEGF,从而促进血管生成。APEX1在骨肉瘤中的高表达与通过缺氧诱导因子-1α的激活而上调的VEGF有关,降低APEX1的表达会导致VEGF表达的明显下降[12]。在膀胱癌中,APEX1的表达也与VEGFA的表达和CD163+肿瘤相关巨噬细胞浸润增加呈正相关[17]。APEX1在索拉非尼耐药的HCC患者中的表达明显高于索拉非尼敏感的HCC患者[10]。因此笔者猜想APEX1可能通过JAG1-Notch1-VEGFA信号通路调控肿瘤的发生发展过程。本组通过分析对比APEX1和JAG1在HCC-BM中的表达,发现HCC-BM中APEX1、JAG1的表达显著增强,进一步统计分析发现APEX1与JAG1蛋白的表达之间呈正相关。在本课题组前期及本次结果显示在组织学上APEX1和JAG1之间存在正相关,提示两者在HCC的侵袭转移中可能发挥作用,其具体机制尚需细胞学水平进一步验证及补充,为HCC-BM的诊治提供更多的理论基础。

