溶瘤病毒联合PD-1/PD-L1抑制剂的研究进展
甘兹颖,唐 慧
(1.昆明理工大学 医学院; 2.昆明理工大学附属医院 云南省消化内镜临床医学中心昆明市肿瘤分子与免疫防治重点实验室, 云南 昆明 650032)
在肿瘤微环境中,阻断程序性死亡受体1(programmed cell death 1, PD-1)和程序性死亡受体-配体1(programmed cell death-Ligand 1, PD-L1)通路,使T细胞重新激活或扩增,从而增强其对肿瘤细胞的免疫应答,是目前较成功的肿瘤免疫治疗经典案例之一。这种免疫正常化疗法能够恢复肿瘤微环境中由肿瘤所引发的免疫缺陷,矫正人体中缺陷的免疫机制,使机体免疫恢复至正常水平[1]。然而,这种免疫正常化治疗仅对10%~30%的患者起效[2],究其原因在于这10%~30%的患者,其肿瘤微环境中浸润了大量的T细胞,并且肿瘤细胞本身表达较高水平的PD-L1。因此这种治疗策略在很大程度上依赖于肿瘤微环境中是否浸润有内源性的T细胞,然而,大多数实体瘤的肿瘤微环境缺乏免疫T细胞[3-4],根据患者肿瘤微环境中浸润T细胞数量的不同,将肿瘤划分为“热肿瘤”与“冷肿瘤”[5-6], 现阶段,免疫治疗的一大挑战在于如何将免疫治疗应用于“冷肿瘤”。目前, 治疗“冷肿瘤”的策略主要有放射治疗、化学药物治疗、靶向疗法、基于DNA修复、CAR-T细胞、溶瘤病毒、肿瘤疫苗或T细胞免疫调节因子等疗法[7]。其中,溶瘤病毒在联合PD-1/PD-L1免疫检查点抑制剂抗肿瘤治疗中获得了喜人的进展,是能够重塑肿瘤微环境并增强PD-1/PD-L1免疫检查点抑制剂的研究热点之一。
1 溶瘤病毒
溶瘤病毒(oncolytic viruses,OVs)是天然(如呼肠孤病毒、新城疫病毒等)或经过遗传修饰(如单纯疱疹病毒、腺病毒、麻疹病毒以及牛痘病毒等)的可裂解肿瘤细胞的一类病毒,具有选择性感染肿瘤细胞并在肿瘤细胞中复制扩增、可释放肿瘤相关抗原以及调节肿瘤微环境等特点[8-9],使得其在治疗肿瘤中显示极大的优势。目前,溶瘤病毒联合PD-1/PD-L1抑制剂治疗肿瘤主要有两种方式,一种为PD-1/PD-L1抑制剂联合基因重组修饰以及天然弱毒性的溶瘤病毒,另一种则是携带PD-1/PD-L1抗体基因的基因重组溶瘤病毒,但无论是何种方式,溶瘤病毒都重塑了肿瘤的微环境,并极大地增强了PD-1/PD-L1免疫检查点抑制剂的治疗效果。
1.1 溶瘤病毒联合PD-1/PD-L1抑制剂
OVs能够导致肿瘤细胞的直接裂解,也能够激活T细胞并促进其向肿瘤部位浸润,从而通过间接诱导全身抗肿瘤免疫效应来发挥其抗肿瘤作用,但OVs单独使用具有一定的局限性,如缺乏持久的免疫响应,并可引起感染局部和T细胞上PD-L1与PD-1的异常高表达,最终导致肿瘤细胞的免疫耐受[10-11],因此将溶瘤病毒与PD-1/PD-L1抑制剂联合使用,可解决肿瘤细胞的免疫耐受并实现溶瘤病毒与肿瘤免疫相关细胞的双重抗癌功效。在对黑色素瘤患者的治疗中[10],研究者使用溶瘤病毒Talimogene laherparepvec (T-vec)对患者进行局部注射以及静脉注射PD-1抑制剂后,患者肿瘤部位中的PD-L1表达升高,肿瘤微环境中的CD8+T细胞也显著性增加,溶瘤病毒联合PD-1抑制剂治疗改善了肿瘤微环境,对转移性黑素瘤联合治疗的总有效率为62%,完全有效率为33%,且该联合治疗的应答不依赖于肿瘤中CD8+T细胞浸润。此外,在被认为免疫原性较差或“冷”的黑色素瘤小鼠模型中[12],新城疫病毒联合放疗与检查点抑制剂(PD-1或CTLA4靶向单抗)联合用药较之单独使用检查点抑制剂治疗组,其肿瘤完全消退率要好得多。在目前的研究中,溶瘤病毒联合PD-1/PD-L1抑制剂在小鼠结肠癌、卵巢癌、肺癌模型以及高级四肢啮齿等动物模型中均取得很好的治疗效果[11,13-14],成功地逆转了肿瘤的“冷”环境,这些基础研究结果显示出联合用药的安全性以及有效性,临床研究多以溶瘤病毒联合用药为主,溶瘤病毒联合其他药物代表着其在肿瘤免疫治疗中的发展趋势[15-16]。
在溶瘤病毒联合PD-1/PD-L1抑制剂的临床试验中(表1),黑色素瘤、乳腺癌以及肠道癌是目前进行临床试验最多的适应证,其中,痘病毒、腺病毒、单纯疱疹病毒以及呼肠孤病毒是联合PD-1/PD-L1抑制剂最多的临床试验病毒类型。其他病毒,如新城疫病毒、麻疹病毒以及马拉巴病毒也在进行临床治疗招募或者计划中。目前,与溶瘤病毒联合治疗进展最快的药物是PD-1/PD-L1抑制剂[17],两者联合治疗可大幅提升癌响应率[10],且溶瘤病毒联合免疫检查点抑制剂的联合疗法比单一疗法更加有效且安全,使之成为目前肿瘤免疫治疗领域的研究热点。
1.2 携带PD-1/PD-L1抗体基因的溶瘤病毒
抗PD-1/PD-L1疗法可增强多种实体瘤的抗肿瘤免疫反应,但在针对胶质母细胞瘤(glioblastoma,GBM)的晚期临床试验结果中,使用免疫检查点抑制剂并未产生明显的治疗益处[18],部分原因是抗肿瘤药物不能通过血脑屏障,基于现有研究,突破血脑屏障的方法主要有将抗体包装成纳米药物以及使溶瘤病毒携带抗体基因[19-21],前者无疑加大了治疗费用以及其他不确定因素,而后者则是一项成熟的重组溶瘤病毒构建方式,因此,对于克服血脑屏障,构建包含抗体基因的溶瘤病毒无疑是一种很好的办法。
在一项研究中[20],研究人员设计了一种基于1型单纯疱疹病毒(herpes simplex virus type 1, HSV-1)的新型溶瘤病毒(NG34scFvPD-1),这种病毒能够表达针对PD-1蛋白分子的单链片段可变抗体(scFvPD-1),在体外,研究人员成功地利用NG34scFvPD-1感染小鼠和人GBM细胞,并使之表达scFvPD-1。在体内实验中,接受NG34scFvPD-1的GBM小鼠的中位生存期显著性地延长,NG34scFvPD-1可在小鼠体内产生持久的免疫应答,使小鼠生存延长,并诱导产生抗肿瘤记忆反应。但在这项研究中也同时显示出这种工程化溶瘤病毒的scFvPD-1表达时间短以及复制效率低下的弊端,因此,需进一步构建稳定表达PD-1抗体的溶瘤病毒,提高病毒在GBM中的抗肿瘤能力。
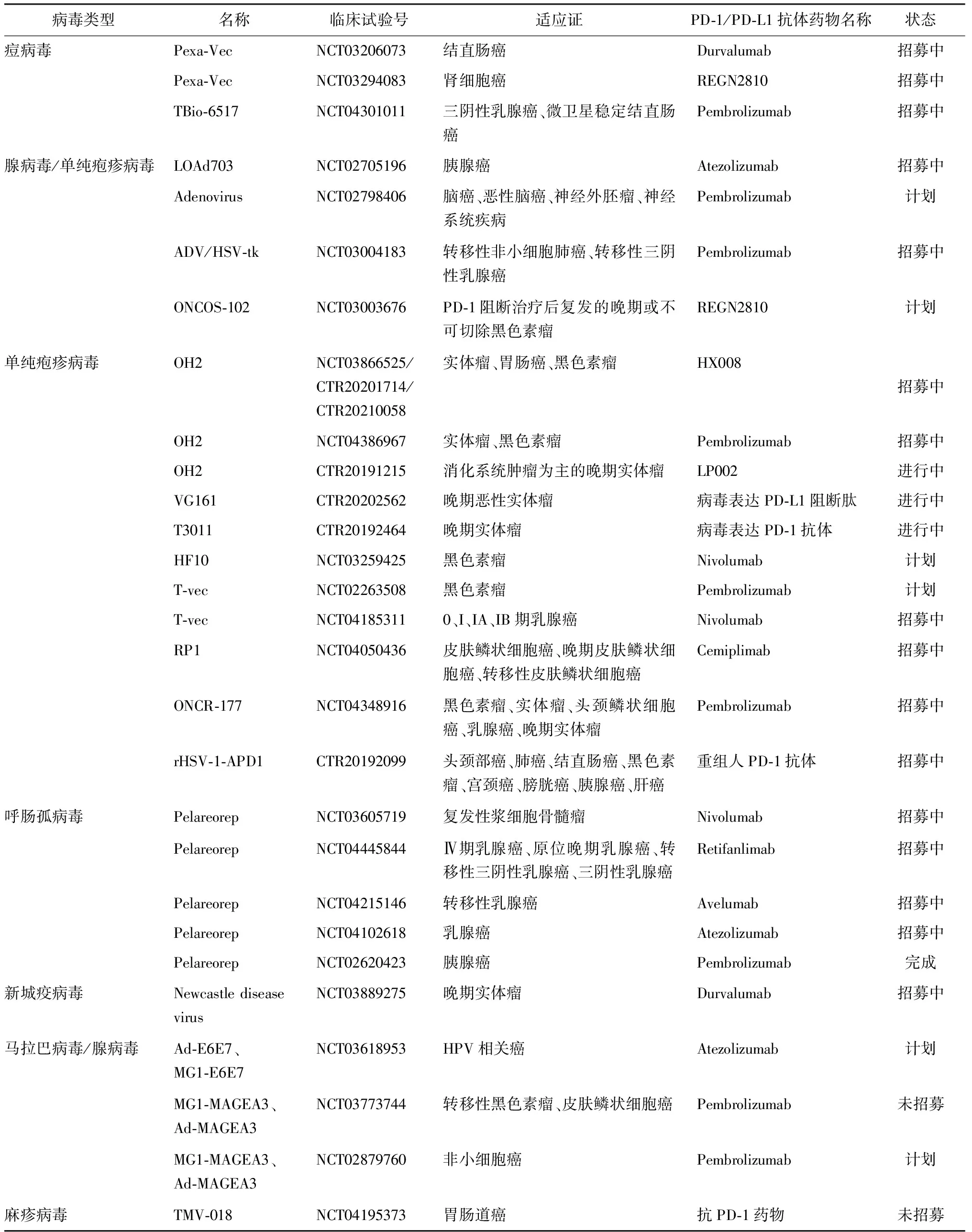
表1 溶瘤病毒联合PD-1/PD-L1抗体药物临床试验汇总Table 1 Summary of clinical trials of oncolytic virus combined with PD-1/PD-L1 drugs
数据来源于NIH临床试验政府网(https://ClinicalTrials.gov)以及药物临床试验登记与信息公示平台(http://www.chinadrugtrials.org.cn),数据统计于2021年1月28日截止.
在一项临床前研究报告中[21],研究者构建了一种能够稳定表达PD-1抗体的新型溶瘤疱疹病毒,并在插入编码PD-1抗体基因后显著性地增强了该病毒的溶瘤活性,在该研究中,IL-12基因同时被插入病毒基因组中,这种病毒能分泌IL-12以及PD-1抗体并使之在瘤内大量产生并累积,产生持久的抗肿瘤反应,并且,该病毒在多种肿瘤中起到治疗疗效。溶瘤病毒选择性靶向感染并裂解肿瘤细胞,编码表达的IL-12能够刺激免疫因子产生,而PD-1抗体则阻断PD-1与PD-L1之间的相互作用,这些都可极大地增强肿瘤免疫相关细胞对肿瘤的杀伤作用。
此类溶瘤病毒能够在肿瘤部位感染肿瘤细胞,并在肿瘤细胞内表达免疫检查点抗体,可激活并协助免疫细胞杀伤肿瘤,使得这种携带PD-1/PD-L1抗体基因的溶瘤病毒有望成为治疗GBM的新策略,也有望为其他难治性肿瘤提供新选择。
2 展望
在肿瘤免疫治疗中,虽然阻断PD-1/PD-L1间的相互作用能够恢复机体的免疫水平,但PD-1/PD-L1的表达受多种因素影响,即使在同一种肿瘤类型中,其表达水平也存在较大的异质性,在部分患者中,使用PD-1/PD-L1抑制剂后并不能获得预期收益,其有限的治疗效果严重的限制了该类药物的临床应用。
据报道,在新冠疫情期间,一例患了恶性淋巴瘤肿瘤患者在感染了新冠病毒后,其肿瘤几乎消失了,其可能的原因是新冠病毒刺激了患者本身的固有免疫,使免疫细胞在对抗病毒的期间,对“非我”的肿瘤细胞也一并被识别清除,除此以外,溶瘤病毒在难治性肿瘤中的成功治疗,都提示着溶瘤病毒在治疗肿瘤方面的独特优势,即能够重塑肿瘤微环境,促进免疫细胞浸润至肿瘤微环境,极大地提高了癌的治疗效果,将溶瘤病毒与PD-1/PD-L1等免疫检查点抑制剂联合进行肿瘤治疗,有望通过对肿瘤患者固有免疫和获得性免疫的共激活,达到协同作用的效果,从而提高联合疗法的抗肿瘤疗效。溶瘤病毒与免疫检查点抑制剂联合疗法代表着肿瘤免疫治疗今后的发展趋势。
目前,限制着溶瘤病毒的治疗效果除了单药总体疗效有限,另一限制是给药方式局限于瘤内注射,大量的研究证明了联合用药的安全以及有效性,所以,未来研究需解决溶瘤病毒静脉注射的难关,使用携带了抗体基因或联合免疫检查点抑制剂的溶瘤病毒,使发生了肿瘤转移的患者也能够受益于溶瘤病毒治疗。

