下调lncRNA-H19表达促进人瘢痕疙瘩成纤维细胞凋亡和自噬
黄 云,许喜生,陈 凯,何 秀
(1.郴州市第一人民医院 烧伤整形外科,湖南 郴州 423000; 2.郴州市第一人民医院儿童医院 儿童呼吸内科,湖南 郴州 423000)
瘢痕疙瘩(keloid)俗称疤痕疙瘩,属于皮肤良性肿瘤的一种,也是困扰皮肤及伤口正常愈合的主要问题之一[1]。Keloid发病机制复杂且不明确,目前研究发现,成纤维细胞异常增殖及胞外基质异常沉积是keloid形成的主要病理表现[2],抑制成纤维细胞过度增殖并促进其凋亡,对缓解keloid形成发展有一定的临床意义[3]。自噬在细胞凋亡、存活过程中发挥重要的调控作用[4],其过度自噬及自噬不足,均可影响细胞的功能稳态而参与细胞凋亡及存活过程[5]。但自噬在keloid成纤维细胞(keloid fibroblasts,KFs)异常增殖中扮演怎样的角色,也一直存在争议[6]。长度大于200的非编码RNA(long non-coding RNA,lncRNA)可广泛参与细胞增殖、分化、衰老、凋亡、周期调控及X染色体印迹等多种生物学过程[7],而受到临床研究的重视。已有研究发现lncRNA-H19在keloid组织表达中异常增高,且下调lncRNA-H19能抑制KFs增殖[8],但lncRNA-H19下调是否能通过调控自噬,促进KFs凋亡,来缓解keloid病理进程,还不甚清楚。本研究体外培养KFs细胞,对此进行探讨,以期阐明lncRNA-H19在KFs自噬、凋亡中的靶向调控机制,为keloid的治疗提供实验参考。
1 材料与方法
1.1 材料
细胞及主要试剂:人类瘢痕成纤维细胞系(KFs)(上海细胞研究所);健康人皮肤成纤维细胞系(human dermal fibroblasts,HDFs)(上海朗生科技有限公司);DMEM培养基[舜冉(上海)生物科技有限公司];反转录试剂盒(上海研卉生物科技有限公司);Ad-mTOR和ad-eGFP(规格200μL,腺病毒滴度为2×109PFU/mL,感染效率大于85%)(南京善本生物科技有限公司);lncRNA-H19F低表达腺病毒(si-lncRNA-H19)及不含si-lncRNA-H19的空病毒载体(si-eGFP)[汉恒生物科技(上海)有限公司];Caspase3及PARP、自噬标记蛋白-LC3Ⅱ、Atg7、mTOR及磷酸化mTOR(p-mTOR)和ULKl抗体(均Abcam公司);吖啶橙(Ao)荧光染色试剂盒(北京伊塔生物科技有限公司)。
1.2 方法
1.2.1 细胞培养及分组处理:取KFs及HDFs细胞系常规复苏后,用含10%胎牛血清的DMEM培养基,在恒温培养箱中常规贴壁传代培养。
取对数期KFs及HDFs细胞,按6×104个/孔接种于6孔板内,并设置为HDFs组、KFs组、si-lncRNA-H19+KFs组、si-eGFP+KFs组,每组设置6个复孔。HDFs组及KFs组不做任何处理正常培养,si-lncRNA-H19+KFs组及si-eGFP+KFs组待KFs细胞汇合度达50%~60%时,采用腺病毒向KFs细胞感染lncRNA-H19低表达序列及空载体,记为si-lncRNA-H19+KFs组及si-eGFP+KFs组。各感染组于感染后24 h,取细胞进行后续试验,用qRT-PCR法检测各组细胞感染效果。
取KFs细胞,按1×105个/孔接种于96 孔板内,并设置为:KFs组(未感染组)、si-lncRNA-H19+Ad-mTOR组、si-eGFP+Ad-mTOR组、si-lncRNA-H19+Ad-eGFP组、si-eGFP+Ad-eGFP组,si-lncRNA-H19+Ad-mTOR组感染lncRNA-H19低表达腺病毒(si-lncRNA-H19)及mTOR过表达腺病毒(Ad-mTOR);si-eGFP+Ad-mTOR组感染lncRNA-H19空载体腺病毒(si-eGFP)及Ad-mTOR,si-lncRNA-H19+Ad-eGFP组感染si-lncRNA-H19及mTOR空载体(Ad-eGFP);si-eGFP+Ad-eGFP组感染si-eGFP及Ad-eGFP,各组均于感染后24 h,取细胞按1.2.6方法检测细胞凋亡与自噬相关蛋白表达。
1.2.2 qRT-PCR检测不同细胞系中lncRNA-H19相对表达水平:取对数期KFs及HDFs细胞,用RNA试剂盒提取总RNA,反转录试剂盒反转录得到cDNA,以cDNA为模板,按照qRT-PCR试剂盒进行PCR反应(反应体系:上下游引物各0.5 μL,H2O 8 μL,2×SYBR mix 10 μL,10×cDNA模板1 μL。反应条件:95 ℃预变性10 min,95 ℃变性20 s,60 ℃退火55 s,50个循环,72 ℃延伸15 min)。lncRNA-H19(上游引物:5′-TCCTTCATTCCACCGGAGTCTG-3′,下游引物:5′-CGGAAGTAAGGTGGCTAGACC-3′)以GAPDH为内参,用2-ΔΔCt算法,计算lncRNA-H19表达水平。
1.2.3 流式细胞测量术检测细胞凋亡率:细胞用胰蛋白酶消化6 min,1 000 r/min离心5 min,1 mL磷酸缓冲溶液重悬后合并沉淀物制成单细胞悬液,按annexinV-EGFP/PI双染试剂盒说明书方法进行,染色孵育后,在流式仪上进行上机检测。
1.2.4 透射电镜及吖啶橙(Ao)荧光染色观察细胞自噬:取细胞,沿培养皿壁加入戊二醛固定、包埋并制成切片后,置于透射电镜下观察细胞自噬小体及自噬溶酶体形成情况。
取细胞,制成单细胞悬液,用4%多聚甲醛固定10 min后,加入终浓度为5 μg/mL的Ao试剂,避光孵育10 min后,置于荧光显微镜下观察自噬泡形成情况。
1.2.5 免疫组化法检测细胞mTOR阳性表达:取细胞,制成单细胞悬液,用4%多聚甲醛固定10 min后,加入一抗抗体(mTOR,1∶500)4 ℃孵育6 h,加入辣根过氧化物酶标记二抗(1∶1 000)室温孵育30 min后,用DAB显色,苏木精复染后,置于显微镜下观察拍照。
1.2.6 Western blot检测细胞蛋白表达:取细胞,用蛋白提取试剂盒提取蛋白,BCA法测定细胞蛋白浓度后,取50 μg蛋白样品行上样、电泳、转膜反应,加入一抗caspase3、PARP、mTOR、p-mTOR、ULKl抗体(1∶1 500),内参抗体GAPDH(1∶2 000),4 ℃孵育过夜,加入辣根过氧化物酶二抗(1∶3 000),室温下孵育4 h。显影曝光后,用化学发光成像分析系统拍照并分析灰度值。每组试验重复3次。
1.3 统计学分析
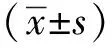
2 结果
2.1 不同细胞系中lncRNA-H19表达变化
瘢痕成纤维细胞系(KFs)中lncRNA-H19表达为(2.06±0.13),显著高于正常皮肤成纤维细胞系(HDFs)的(1.09±0.08)(P<0.05)。
2.2 下调lncRNA-H19表达后对KFs细胞lncRNA-H19表达的影响
与HDFs组比较,KFs组细胞lncRNA-H19表达升高(P<0.05);与KFs组相比,si-lncRNA-H19+KFs组细胞lncRNA-H19表达降低(P<0.05)(表1)。

表1 细胞lncRNA-H19表达比较
2.3 下调lncRNA-H19表达后对KFs细胞凋亡的影响
与KFs组细胞相比,si-lncRNA-H19+KFs组细胞凋亡率升高(P<0.05)(图1,表2)。
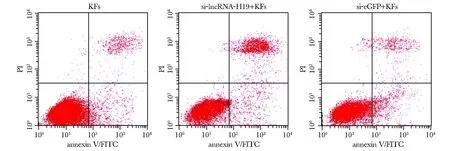
图1 各组细胞流式凋亡图Fig 1 Flow cytometric diagram of cell apoptosis in each group
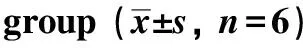
表2 各组细胞凋亡率比较
2.4 下调lncRNA-H19表达后对细胞自噬的影响
HDFs组细胞粗面内质网及高尔基体丰富、线粒体结构正常,偶见个别线粒体肿胀及自噬小体和自噬溶酶体出现;KFs组及si-eGFP+KFs组可见多个粗面内质网肿胀、扩张,内含大量胶原蛋白,线粒体大量肿胀,胞质内有大量细胞器残体;si-lncRNA-H19+KFs组可见大量双层膜囊泡样结构的自噬小体包绕胞质或细胞器,大量单层膜结构的自噬溶酶体内含部分尚未分解的内质网、线粒体等细胞器残体(图2)。
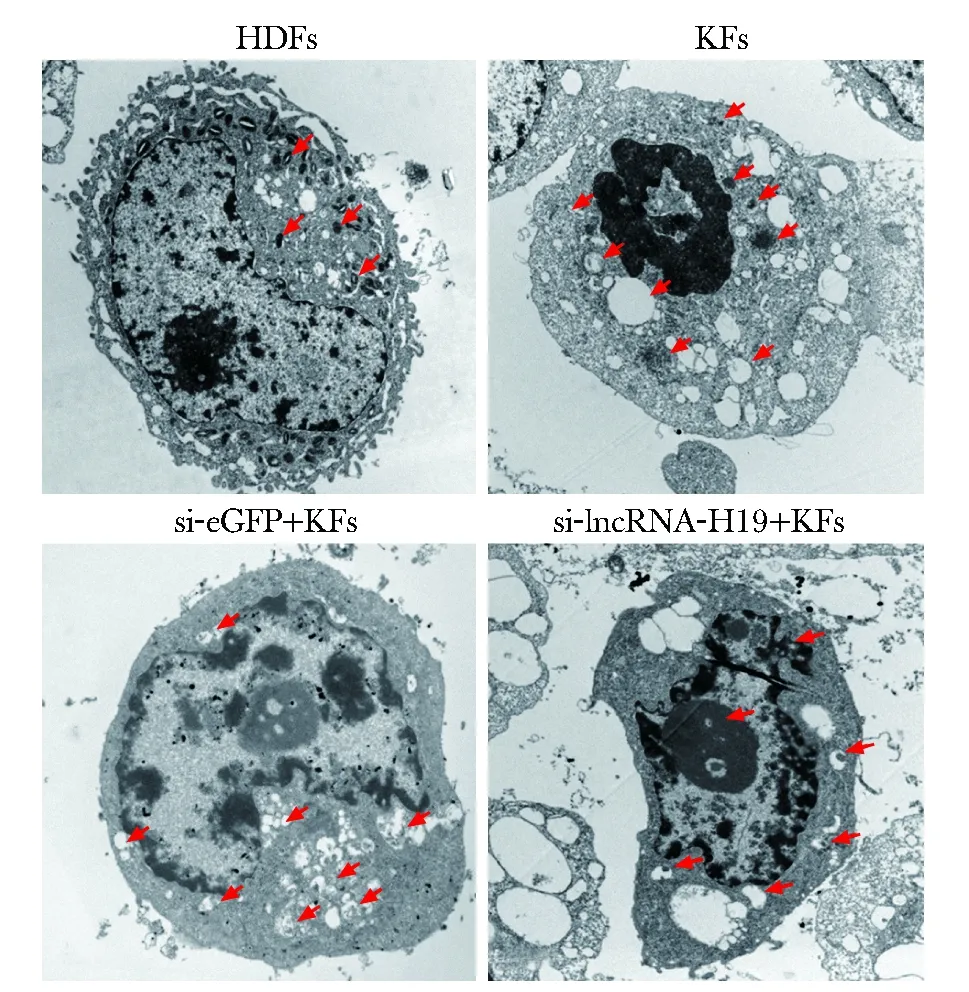
→indicate autophagosome and auto lysosome图2 细胞电镜观察图Fig 2 Electron microscope observation of cells (×80 00)
2.5 下调lncRNA-H19表达后对细胞自噬泡形成数目的影响
与HDFs组比较,KFs组细胞自噬泡形成数目降低(P<0.05),mTOR阳性表达升高(P<0.05);与KFs组细胞相比,si-lncRNA-H19+KFs组细胞自噬泡形成数目升高(P<0.05),mTOR阳性表达降低(P<0.05)(图3,表3)。
2.6 下调lncRNA-H19表达后对细胞凋亡及自噬相关蛋白表达的影响
与HDFs组比较,KFs组细胞caspase3、PARP、LC3Ⅱ、Atg7、ULKl蛋白表达降低(P<0.05),p-mTOR/mTOR蛋白表达升高(P<0.05);与KFs组细胞相比,si-lncRNA-H19+KFs组细胞caspase3、PARP、LC3Ⅱ、Atg7、ULKl蛋白表达升高(P<0.05),p-mTOR/mTOR蛋白表达降低(P<0.05)(图4,5)。
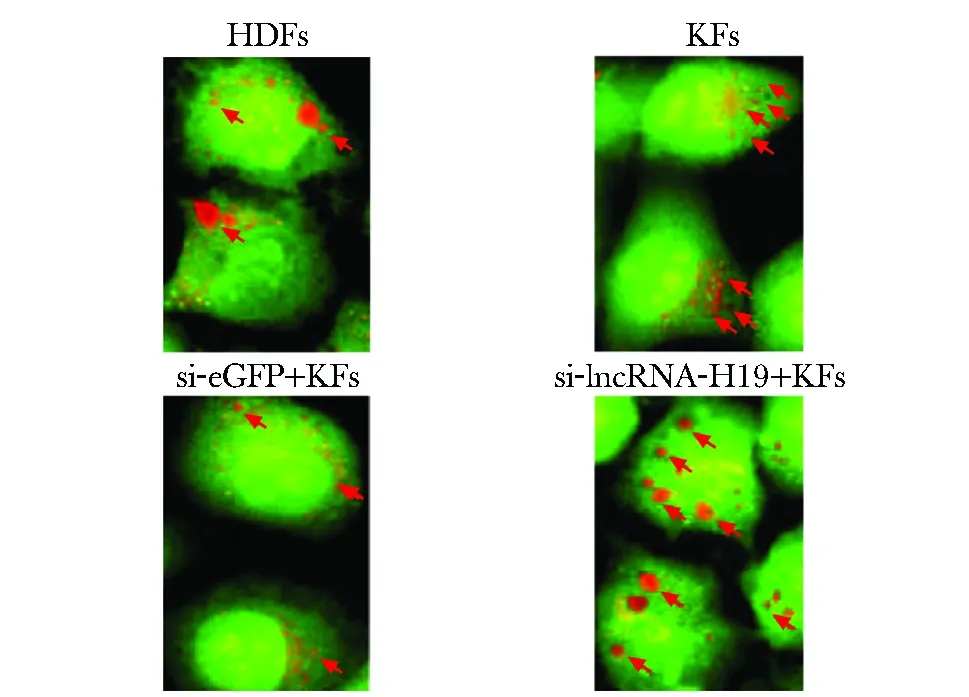
→indicate autophastc vesicles图3 各组细胞Ao染色图Fig 3 Ao staining image of cells in each group (×400)
表3 各组细胞自噬泡形成数目比较
2.7 si-lncRNA与Ad-mTOR共感染后对细胞凋亡及自噬相关蛋白表达的影响
与KFs组比较,si-eGFP+Ad-mTOR组细胞caspase3、LC3Ⅱ、ULKl蛋白表达降低(P<0.05),p-mTOR/mTOR蛋白表达升高(P<0.05);si-lncRNA-H19+Ad-eGFP组细胞caspase3、LC3Ⅱ、ULKl蛋白表达升高(P<0.05),p-mTOR/mTOR蛋白表达降低(P<0.05)。与si-lncRNA-H19+Ad-eGFP组相比,si-lncRNA-H19+Ad-mTOR组caspase3、LC3Ⅱ、ULKl蛋白表达降低(P<0.05),p-mTOR/mTOR蛋白表达升高(P<0.05)(图6,7)。
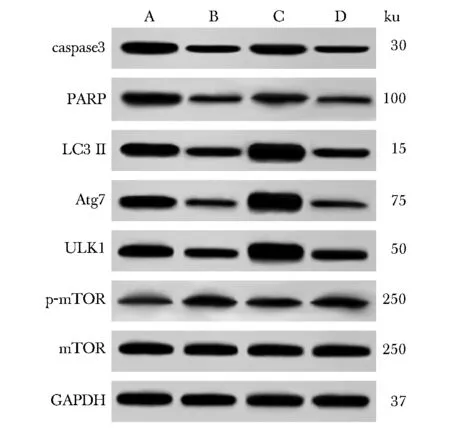
A.HDFs;B.KFs;C.si-lncRNA-H19+KFs;D.si-eGFP+KFs图4 各组细胞凋亡及自噬相关蛋白表达免疫印迹图Fig 4 Immunoblotting diagram of apoptosis and autophagy-related protein expression in each group

*P<0.05 compared with HDFs group;#P<0.05 compared with KFs group图5 各组细胞中凋亡及自噬相关蛋白表达水平比较Fig 5 Comparison of the expression levels of apoptosis and autophagy-related proteins in each group of cells
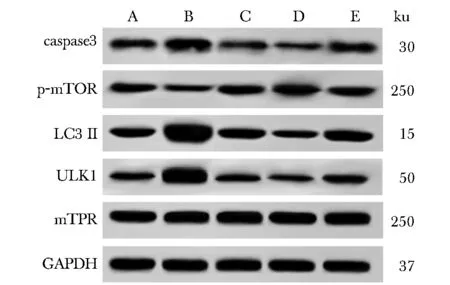
A.KFs;B.si-lncRNA-H19+Ad-eGFP;C.si-lncRNA-H19+Ad-mTOR;D.si-eGFP+Ad-mTOR;E.si-eGFP+Ad-eGFP图6 各组细胞凋亡及自噬相关蛋白表达免疫印迹图Fig 6 Immunoblotting diagram of apoptosis and autophagy-related protein expression in each group
3 讨论
Keloid好发于10~30岁的健康人群,约有86%keloid患者产生难以控制的瘙痒症状,并在很大程度上给患者造成心理自卑及社交障碍[9]。Keloid发生机制不明,临床上仍无特殊有效的方法延缓并根治keloid。KFs异常增生和胞外基质过度沉积被认为是keloid形成的主要病理表现,寻找抑制KFs增生、促进KFs凋亡的有效方法,是临床研究keloid的重点方向。lncRNA-H19能通过调控原癌基因表达、编码生长因子及相关受体表达, 来参与细胞增殖及分化过程[10]。lncRNA-H19在keloid组织中表达异常升高,敲低lncRNA-H19后,可降低lncRNA-H19对相关RNA调控作用,达到抑制KFs增殖、促进KFs凋亡的目的,并认为lncRNA-H19可能是keloid治疗的潜在靶点[11]。本研究发现敲低lncRNA-H19后,KFs凋亡异常升高,证实下调lncRNA-H19表达可促进KFs凋亡,影响KFs存活。
自噬与肿瘤细胞凋亡关系密切。肿瘤早期,自噬激活可通过自噬性死亡的方式发挥抑制肿瘤增殖作用,而在后期,自噬激活却能通过分解、吸收、回收利用代谢物质的方式,满足肿瘤对能量和营养的需求,促进肿瘤细胞存活[12]。但自噬在keloid过程中扮演怎样的角色,也一直存在争议。在自噬调控过程中,Atg7可与LC3结合形成泛素链参与自噬泡的形成,且LC3Ⅱ或LC3Ⅱ/LC3Ⅰ的变化可判断自噬处于自噬激活还是抑制状态[13]。另外,mTOR通路也是自噬调控的核心通路之一,大量研究发现,mTOR中的mTORC1磷酸化激活后,可影响自噬基因ULKl复合体形成,抑制自噬泡的生成,且mTOR通路活化与keloid形成机制有关[14]。本研究发现,KFs细胞中mTOR活性升高的同时,KFs细胞自噬处于抑制状态,提示mTOR通路活化介导的自噬抑制,可能与KFs凋亡降低关系密切。lncRNA-H19可激活mTOR途径,诱导细胞自噬激活[15]。本研究发现,敲低lncRNA-H19后,KFs细胞mTOR活性降低,细胞自噬及凋亡活性显著升高。但敲低lncRNA-H19的同时, 促进mTOR活性, lncRNA-H19低表达发挥的抑制mTOR活化、促进KFs细胞自噬及凋亡作用被明显减弱。
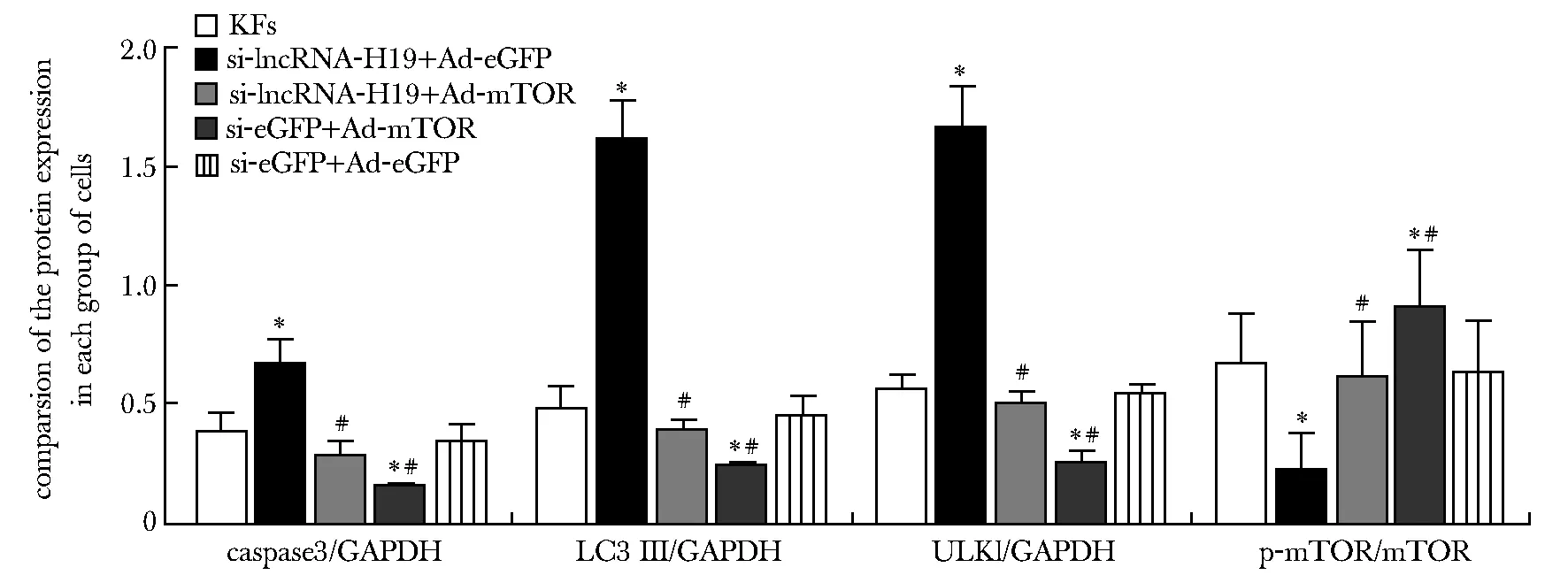
*P<0.05 campared with KFs; #P<0.05 campared with si-lncRNA-H19+Ad-eGFP图7 各组细胞中凋亡及自噬相关蛋白表达比较Fig 7 Comparison of apoptosis and autophagy-related protein expression in cells of each group
综上所述,下调lncRNA-H19表达,可抑制mTOR途径活化,促进KFs细胞自噬及凋亡。这为阐明keloid病理发生发展机制提供一定理论依据,但细胞凋亡与自噬关系复杂,涉及多个RNA及靶蛋白的调控,lncRNA-H19与mTOR及自噬等的靶向调控作用,还有待进一步探究。

