脓毒症早期BMP-2和BMP-4的变化
温 燕,林金灿,黄颖泓,肖文彪,张民伟,林建东*
(1.福建医科大学附属第一医院 重症医学科, 福建 福州 350005; 2.厦门大学附属第一医院 重症医学科,福建 厦门 361003)
脓毒症(sepsis)定义为,由感染引起的机体反应失调所致的危及生命的器官功能障碍[1]。在脓毒症的病理过程中,血管内皮细胞(vascular endothelial cell,VEC)是病原体及其毒素的主要靶点。已证实内皮功能障碍早期参与了脓毒症的发生发展[2]。因此,早期评估脓毒症内皮细胞损伤,可为脓毒症诊断和治疗提供有价值的信息。
研究表明,骨形态发生蛋白(bone morphogenetic protein,BMP)家族的不同亚型与血管生物学有关。BMP信号主要由BMP-2/4/6/9/10触发,其中BMP-2和BMP-4存在于人微血管内皮细胞(microvascular endothelial cells,MECs)中,调节EC的迁移和毛细血管的形成[3-4],BMP-2和BMP-4表达上调可诱导内皮促炎表型,增强白细胞与内皮的间黏附[5-7]。这表明,BMP-2/4信号级联反应可影响内皮细胞生物学行为,BMP-2/4信号通路可能成为内皮细胞损伤修复的潜在靶点。
然而,目前关于BMP-2/4信号通路的研究多集中于大血管内皮细胞,BMP-2/4在脓毒症微血管内皮功能障碍中的作用尚未明确。因此,本研究旨在探讨BMP-2和BMP-4在脓毒症早期的变化及可能机制。
1 材料与方法
1.1 材料
1.1.1 受试者:根据2016年脓毒症国际指南诊断脓毒症[1]。入选自2017年5月1日至2020年5月1日入住厦门大学附属第一医院重症监护病房(intensive care unit,ICU)和福建医科大学附属第一医院 ICU 的脓毒症患者(脓毒症组)和非脓毒症患者(非脓毒症组)。招募18岁以上的健康志愿者作为对照组。脓毒症组的入选标准:1)年龄>18周岁;2)确诊脓毒症;3)脓毒症的上游疾病为细菌性肺部感染或腹腔感染。非脓毒症组的入选标准:1)年龄>18周岁;2)轻型肺部细菌感染患者或因腹部器官非感染性疾病入住ICU的患者;3)ICU住院期间无新发感染。脓毒症组和非脓毒症组的排除标准为:1)自身免疫性疾病;2)肿瘤活动期;3)骨修复期;4)肺血管疾病如肺动脉高压、肺栓塞等。健康对照组的排除标准为:1)入组前1个月内患有细菌或病毒感染;2)入组前1个月内接受过抗生素治疗。该研究经福建医科大学附属第一医院医学伦理委员会批准[闽医大附一伦理医研(2021204)]。所有受试者或其法定监护人需签署知情同意书。该研究符合1975年赫尔辛基宣言的伦理准则。
收集所有受试者的一般信息,及脓毒症组和非脓毒症组的感染性指标。
1.1.2 试剂及试剂盒:BMP-2、BMP-4和内皮素-1(endothelin-1,ET-1)酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)试剂盒(博士德生物技术有限公司),总 RNA 纯化试剂盒、辣根过氧化物酶(horseradish peroxidase, HRP)结合的山羊抗兔 IgG 抗体和 DAB 显色液(上海生工生物技术有限公司);PrimeScriptTMRT Master Mix试剂盒和TaqMan探针(TaKaRa公司);脂多糖(lipopolysaccharide,LPS)(Sigma-Aldrich公司);抗BMP-2抗体、抗磷酸化 Smad1/5(phosphorylated Smad1/5,pSmad1/5)抗体和抗BMP受体Ⅱ(BMP receptor Ⅱ,BMPRⅡ)抗体(Cell Signaling Technology公司)。
1.1.3 细胞:原代大鼠肺微血管内皮细胞(rat pulmonary microvascular endothelial cells,RPMECs)(武汉普诺赛生命科技有限公司)。
1.2 方法
1.2.1 采集血样:收集脓毒症组(24例)和非脓毒症组(25例)患者入住 ICU 24 h 内及健康志愿者(对照组,24例)的空腹外周静脉血标本,离心获得血清,将血清样品等分后,-20 ℃ 保存。
1.2.2 ELISA定量检测BMP2、BMP-4和 ET-1:按照试剂盒说明书,测定血清 BMP-2、BMP-4和 ET-1浓度。用酶标仪在波长450 nm处测定吸光度(A)值。
1.2.3 RPMECs 的培养和处理:于37 ℃含5% CO2的培养箱培养原代 RPMECs。第2~3代的 RPMECs 用于实验。用梯度浓度的 LPS(0、10、100和1 000 ng/mL)孵育 RPMECs[8],3 h 后收集 RPMECs,提取总蛋白和总 RNA。
1.2.4 免疫印迹法检测BMP-2、pSmad1/5和 BMPRⅡ:用1.2.3中的 RPMECs 总蛋白,按文献报道[8]的方法进行免疫印迹分析;用Image J软件分析蛋白质的相对表达量。
1.2.5 RT-qPCR检测 BMP-2 mRNA和 BMPRⅡ mRNA:用1.2.3中的 RPMECs总 RNA,按PrimeScriptTMRT Master Mix 试剂盒说明进行反转录。用 LightCycler480系统和 Taqman 探针进行 qPCR。引物序列如表1所示。
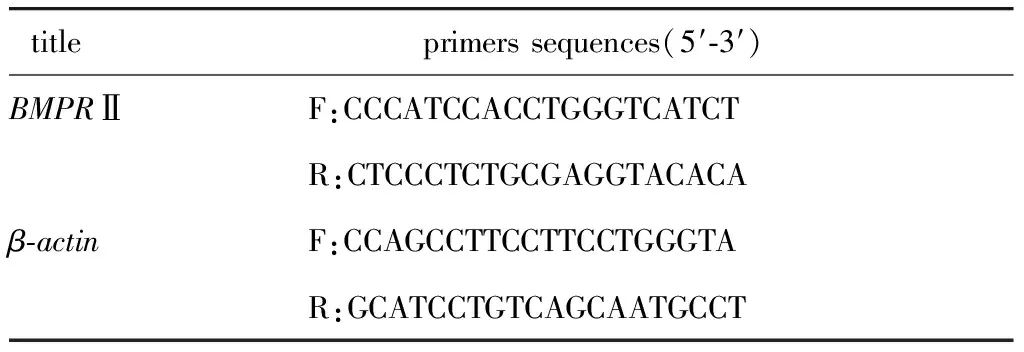
表1 RT-qPCR引物序列Table 1 Primer sequences for RT-qPCR
1.3 统计学分析
2 结果
2.1 受试者一般特征
最终入选24例脓毒症患者(脓毒症组,n=24)、25例非脓毒症患者(非脓毒症组,n=25)及24例健康志愿者(对照组,n=24)。与非脓毒症组相比,脓毒症组患者入ICU后24 h 内的感染性标志物水平显著较高,包括血小板(platelet,PLT)、C反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)和白介素(interleukin,IL)-6(P<0.05);脓毒症组死亡率显著较高,有更多的患者合并有多器官功能衰竭综合征(multiple organ dysfunction syndrome,MODS)、需要机械通气,且机械通气时间显著较长(P<0.05)。
2.2 脓毒症患者中血 BMP-2和 BMP-4的浓度显著升高
脓毒症组早期血清 BMP-2 和 BMP-4 水平显著较高于对照组(P<0.05),且脓毒症组 BMP-2水平显著高于非脓毒症组(P<0.01)(图1)。

There were significant differences on BMP-4(F=3.79,P=0.03) and BMP-2(F=6.36,P=0.003) between the three groups; *P<0.05 compared with control; #P<0.05 compared with non-sepsis图1 脓毒症组、非脓毒症组和对照组间BMP-2、BMP-4和ET-1的比较Fig 1 Comparisons of BMP-2, BMP-4 and ET-1 between sepsis group, non-sepsis group and control group
2.3 BMP与脓毒症相关的生物标志物之间的相关性
Pearson相关性分析显示,脓毒症组患者入住 ICU 24 h 内的 BMP-2 水平与 PCT(r=0.45,P<0.01)、乳酸(r=0.66,P<0.01)、以及 IL-6(r=0.59,P<0.01)呈显著正相关,且其BMP-4 与 ET-1(r=0.57,P<0.01)和 CRP(r=0.54,P<0.05)间亦呈显著正相关;而非脓毒症组仅 BMP-4 与 CRP(r=0.66,P<0.01)呈显著正相关。
2.4 BMP-2具有良好的脓毒症诊断性能
ROC 曲线分析 BMP-2 对脓毒症与健康志愿者诊断价值,结果显示出良好诊断性能(AUC=0.94,cutoff 值:50.40 pg/mL,灵敏度:87.50%,特异性:95.83%);且BMP-2在区分脓毒症患者与ICU非脓毒症患者时(AUC=0.85,cutoff 值: 54.66 pg/mL,灵敏度:87.50%,特异性: 76.00%)也显示出良好诊断性能。本研究中所有ROC 曲线分析均未显示BMP-4对脓毒症的良好诊断性能。
2.5 LPS 对RPMECs的SMAD信号通路蛋白表达的影响
2.5.1 LPS处理的RPMECs的BMP-2表达的变化:LPS可诱导 RPMECs的BMP-2表达增加,且该效应具有LPS浓度依赖性(图2A,B)。当 LPS 浓度≥100 ng/mL 时,经 LPS 处理的 RPMECs 的 BMP-2 表达显著高于对照组(P<0.05,图2A,B)。
2.5.2 LPS对RPMECs 的 BMP/Smad1/5/8信号通路的影响:LPS 可显著降低 RPMECs 的pSmad1/5和 BMPRⅡ 表达,且降低程度均与LPS浓度呈剂量依赖关系(P<0.05)(图3A~C),另外BMPRⅡ mRNA的表达显著降低(P<0.05)(图3D)。
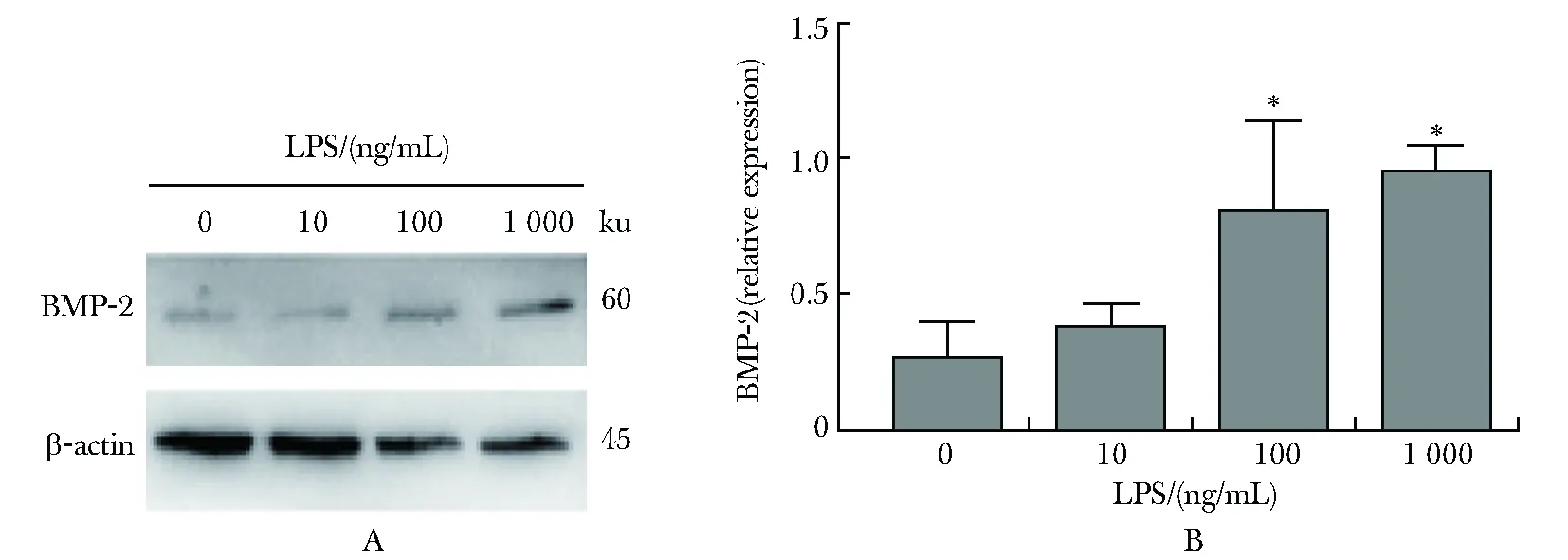
A.expression of BMP-2 detected by Western blot; B.relative expressions of BMP-2 of RPMECs grouped by concentrations of LPS; *P<0.05 compared with control group
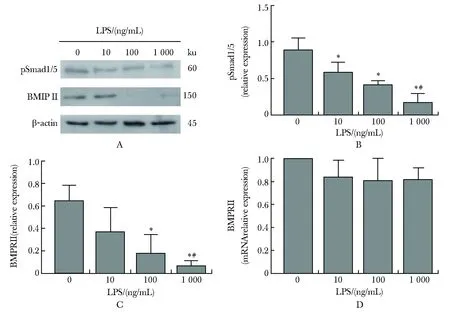
A-C.expressions of pSmad1/5 and BMPRⅡ in LPS-treated PMECs were lower than them in untreated PMECs; D.RT-qPCR showed mRNA expressions of BMPRⅡ in LPS-treated PMECs lower than them in untreated PMECs; *P<0.05 compared with group control; #P<0.05 compared with non-sepsis group
3 讨论
非感染性炎性研究表明,BMP-2/4在血管炎性反应中表达显著上调,是血管壁中的促炎和促动脉粥样硬化因子[5-6,9-10]。这提示BMP可参与人体炎性反应。尽管研究表明,经LPS处理的小鼠肺部BMP-2表达显著升高[7],但极少有研究报道BMP在临床感染性疾病中变化。本研究经临床观察首次证实脓毒症早期BMP-2/4水平显著升高,且BMP-2对感染性炎性反应更加敏感,并对脓毒症有良好的诊断功能,可能在早期脓毒症的诊断中起重要作用。
内皮细胞炎性是脓毒症的关键病理生理特征,主要表现为肺微血管完整性受损和内皮功能障碍[1,2]。通过细胞模型,本研究发现经LPS处理的RPMECs的BMP-2的表达明显更高,这进一步证实了上述临床发现。既往研究表明,BMP-2可促进白细胞黏附内皮细胞,这将诱导细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)和核因子-κB的表达升高,从而引起内皮细胞炎性反应[7]。由BMP-2诱导产生的炎性因子又可下调BMP受体表达,进而经Smad1/5/8通路抑制BMP信号传导,从而增加内皮细胞中的ICAM表达和白细胞黏附[11-13]。本研究显示经LPS处理的肺微血管内皮细胞的磷酸化Smad1/5和BMPRⅡ表达显著受抑制。这表明在脓毒症早期,BMP-2在发挥促炎作用的同时,伴有Smad1/5/8信号通路抑制,这进一步加剧了促炎反应过程。
综上所述,本研究证实脓毒症早期BMP-2表达显著升高,LPS可抑制Smad1/5/8信号通路,两者共同驱动内皮细胞炎性反应。这表明BMP-2可能是潜在的脓毒症早期诊断标志物且在脓毒症早期起促炎作用。

