虫草素抑制哮喘大鼠支气管上皮细胞间充质转化
汤丽萍,闫 瑾,范 芳,王 浩,黄 娜*
(1.空军军医大学西京医院 儿科, 陕西 西安 710032; 2.西安医学院 医学技术学院, 陕西 西安 710021)
哮喘(asthma)是最常见的慢性呼吸道疾病,以气道炎性反应、重塑、阻塞和高反应性为特征[1]。气道重塑是哮喘的关键病理特征,与哮喘症状的持续和不良临床结局有关[2]。在气道重塑过程中,气道上皮屏障受损、上皮细胞黏附减少、上皮标志物减少以及间质标志物增多[2],这些病理改变提示气道上皮细胞可能通过上皮细胞间充质转化(epithelial-mesenchymal transition, EMT)参与气道重塑过程。EMT是上皮损伤后上皮细胞向间充质表型转化的高度可塑性过程。TGF-β1的释放和自分泌、氧化应激增强等因素均可诱导支气管上皮细胞发生EMT[3]。EMT的发展通常伴随着上皮标志物(例如E-cadherin)的丢失以及间充质标志物(例如N-cadherin、α-SMA和vimentin)的表达[4]。蛹虫草(Cordyceps militaris)是一种传统药用菌。虫草素(cordycepin,Cor)是从蛹虫草中分离得到的主要生物活性成分,具有抗缺氧、抗感染、免疫调节和抗肝纤维化等多种药理活性[5]。有研究显示,虫草素对慢性哮喘大鼠气道重塑有明显的抑制作用[6]。然而,目前还不清楚虫草素是否通过影响哮喘的EMT过程来改善气道重塑。为了验证这一推论,本研究使用了一种哮喘大鼠模型和人支气管上皮细胞来研究虫草素在哮喘中的作用以及这一过程中可能涉及的机制。
1 材料与方法
1.1 材料
1.1.1 材料:卵白蛋白(ovalbumin,OVA)、虫草素、0.9%氯化钠溶液(Sigma Aldrich公司);Wright-Giemsa、苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒、Masson三色染色试剂盒(北京索莱宝科技有限公司);E-cadherin一抗、c-Jun一抗、N-cadherin一抗、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMΑ)一抗、vimentin一抗、生物素标记的二抗、Alexa Fluor 555偶联二抗、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)二抗(Cell Signal Technology公司);转化生长因子-β1(transforming growth factor-β1,TGF-β1)(R&D公司);聚偏氟乙烯膜(Millipore公司);Smad3、p-Smad3、ERK1/2、p-ERK1/2和GAPDH一抗(Abcam公司);增强型化学发光试剂(Santa Cruz Biotechnology公司);细胞计数试剂盒-8(cell counting kit-8,CCK-8)(株式会社日本同仁化学研究所);Transwell小室(Corning公司);人支气管上皮样细胞系16HBE(ATCC细胞库)。
1.1.2 动物:40只SPF级4~6周龄雄性SD大鼠{空军军医大学第三附属医院[SYXK(陕)2020-004]},体质量为60~80 g。实验前,大鼠在标准实验室条件下(25 ℃、55%相对湿度、12 h光暗循环照明)适应性饲养1周,不限制食物和水。
1.2 方法
1.2.1 动物的分组及处理:将大鼠随机分为4组(n=10):对照组、模型组(哮喘模型大鼠,OVA组)、OVA+10 mg/kg Cor组和OVA+50 mg/kg Cor组(分别用10和50 mg/kg的虫草素治疗的哮喘大鼠)。分别于第0、7、14天对OVA组、OVA+50 mg/kg Cor组和OVA+200 Cor组大鼠腹腔注射1 mL含有100 mg OVA和100 mg氢氧化铝的0.9%氯化钠溶液进行致敏,第21天起用50 μL 1% OVA(溶于0.9%氯化钠溶液)滴鼻激发,连续7 d。另外,在第21天起,OVA+10 mg/kg Cor组和OVA+50 mg/kg Cor组大鼠在激发前2 h灌胃10 mg/kg和50 mg/kg的虫草素(溶于0.9%氯化钠溶液)。对照组用0.9%氯化钠溶液致敏、激发和灌胃,OVA组用0.9%氯化钠溶液灌胃。
1.2.2 收集支气管肺泡灌洗液(BALF)和计数细胞:最后一次激发24 h后,处死大鼠,用100 mL PBS冲洗肺,左气管插管收集支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),向肺内注入3 mL PBS,抽吸3次。将细胞悬液4 ℃ 1 000 r/min离心10 min,然后重悬于1 mL 0.9%氯化钠溶液中。对BALF中的白细胞进行Wright-Giemsa染色并计数。
1.2.3 组织学染色检测大鼠肺气道炎性反应和气道重塑:用10%多聚甲醛固定大鼠左肺,石蜡包埋,切成3 μm厚的切片。HE染色评价气道炎性反应和气道重塑程度。Masson三色染色检测上皮胶原沉积。检测方法严格按照试剂盒说明进行。
1.2.4 免疫组织化学染色检测大鼠肺组织E-cadherin和α-SMA的表达水平:将大鼠肺组织切片烤片、脱蜡和水化后,用3% H2O2消除内源性过氧化物酶,微波炉中进行10 min抗原修复。然后在37 ℃用山羊血清封闭30 min。将切片与E-cadherin和α-SMA一抗在4 ℃过夜孵育(1∶500稀释),PBS清洗后,切片与生物素标记的二抗37 ℃孵育30 min,再与过氧化物酶试剂37 ℃孵育30 min,DAB显色剂孵育37 ℃孵育5 min。苏木精复染核5 min,自来水冲洗反蓝,1%盐酸乙醇分化5 s。常规脱水、透明封片后,用ImageJ软件半定量测定E-cadherin和α-SMA的蛋白表达。
1.2.5 人支气管上皮样细胞系16HBE的培养和处理:将人支气管上皮样细胞16HBE培养在含8%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI1640培养基中,培养条件为37 ℃、5% CO2。TGF-β1用于诱导EMT发生。用5 ng/mL的TGF-β1和不同浓度的虫草素(10、20、40、80、160、320 μmol/L)处理16HBE细胞48 h。此外,将16HBE细胞分为3组,对照组(未处理的细胞)、TGF-β1组(5 ng/mL的TGF-β1处理的细胞)和TGF-β1+Cor组(5 ng/mL的TGF-β1和40 μmol/L虫草素处理的细胞)用于后续实验。
1.2.6 Western blot检测蛋白表达水平:从大鼠肺组织和16HBE细胞中提取总蛋白并定量,样品经8%、10%或12% SDS-PAGE分离并电转移到聚偏氟乙烯膜。在用5%脱脂牛奶封闭2 h后,将膜与E-cadherin(1∶3 000稀释)、N-cadherin(1∶1 000稀释)、α-SMA(1∶3 000稀释)、vimentin(1∶1 000稀释)、Smad3(1∶2 000稀释)、p-Smad3(1∶2 000稀释)、ERK1/2(1∶1 000稀释)、p-ERK1/2(1∶1 000稀释)和GAPDH(1∶3 000稀释)的一抗4℃过夜孵育。然后与HRP标记的山羊抗兔IgG二抗(1∶500稀释)室温孵育2 h。使用增强型化学发光试剂显影,GAPDH作为内参蛋白。
1.2.7 CCK-8法检测细胞增殖:将16HBE细胞按照2 000个细胞/孔(100 μL)加入96孔板中,用TGF-β1和虫草素培养细胞48 h。然后去除培养基,加入10 μL的细胞计数试剂盒-8 (CCK-8)和100 μL无血清培养基,37 ℃、5% CO2孵育1~4 h。用BioTek微板分光光度计检测450 nm处的吸光度值。
1.2.8 Transwell小室法检测细胞迁移:将Transwell上室中加入2×105个细胞和200 μL无血清培养液,下室加入800 μL含10%胎牛血清的完整培养液。37 ℃孵育24 h后,洗涤细胞并用4%多聚甲醛固定,下室细胞用结晶紫染色。在奥林巴斯荧光显微镜下计数迁移至下室的细胞。
1.2.9 免疫荧光染色检测16HBE细胞中c-Jun的表达:常规制作细胞玻片,用4%多聚甲醛固定20 min,室温下用0.1% Triton X-100渗透20 min。用牛血清白蛋白清洗和封闭后,将玻片与c-Jun一抗(1∶1 000稀释)在4 ℃孵育过夜。然后将载玻片与Alexa Fluor 555偶联二抗在室温下孵育2 h。滴加DAPI复染核5 min,用含荧光猝灭剂的封片液封片,置于显微镜下观察,用ImageJ软件计算图像平均荧光强度。
1.3 统计学分析
2 结果
2.1 虫草素对哮喘大鼠炎性反应和重塑的影响
与对照组相比,OVA组大鼠BALF的总细胞计数、嗜酸粒细胞、中性粒细胞、淋巴细胞和巨噬细胞显著增加(P<0.05)。与OVA组相比,OVA+10 mg/kg Cor组和OVA+50 mg/kg Cor组的上述细胞计数均减少(P<0.05)(表1)。对照组大鼠具有正常的肺组织形态,OVA组出现大量的炎性细胞浸润,而OVA+10 mg/kg Cor组和OVA+50 mg/kg Cor组的炎性细胞浸润减少(图1A)。对照组大鼠支气管周围无明显胶原沉积,OVA组可见大面积的支气管周胶原沉积,OVA+10 mg/kg Cor组和OVA+50 mg/kg Cor组大鼠胶原沉积较OVA组减少(图1A)。与OVA组相比,OVA+10 mg/kg Cor组和OVA+50 mg/kg Cor组的胶原纤维面积均减少,且呈剂量依赖性方式减少(P<0.05)(图1B)。
2.2 虫草素对哮喘大鼠气道EMT的影响
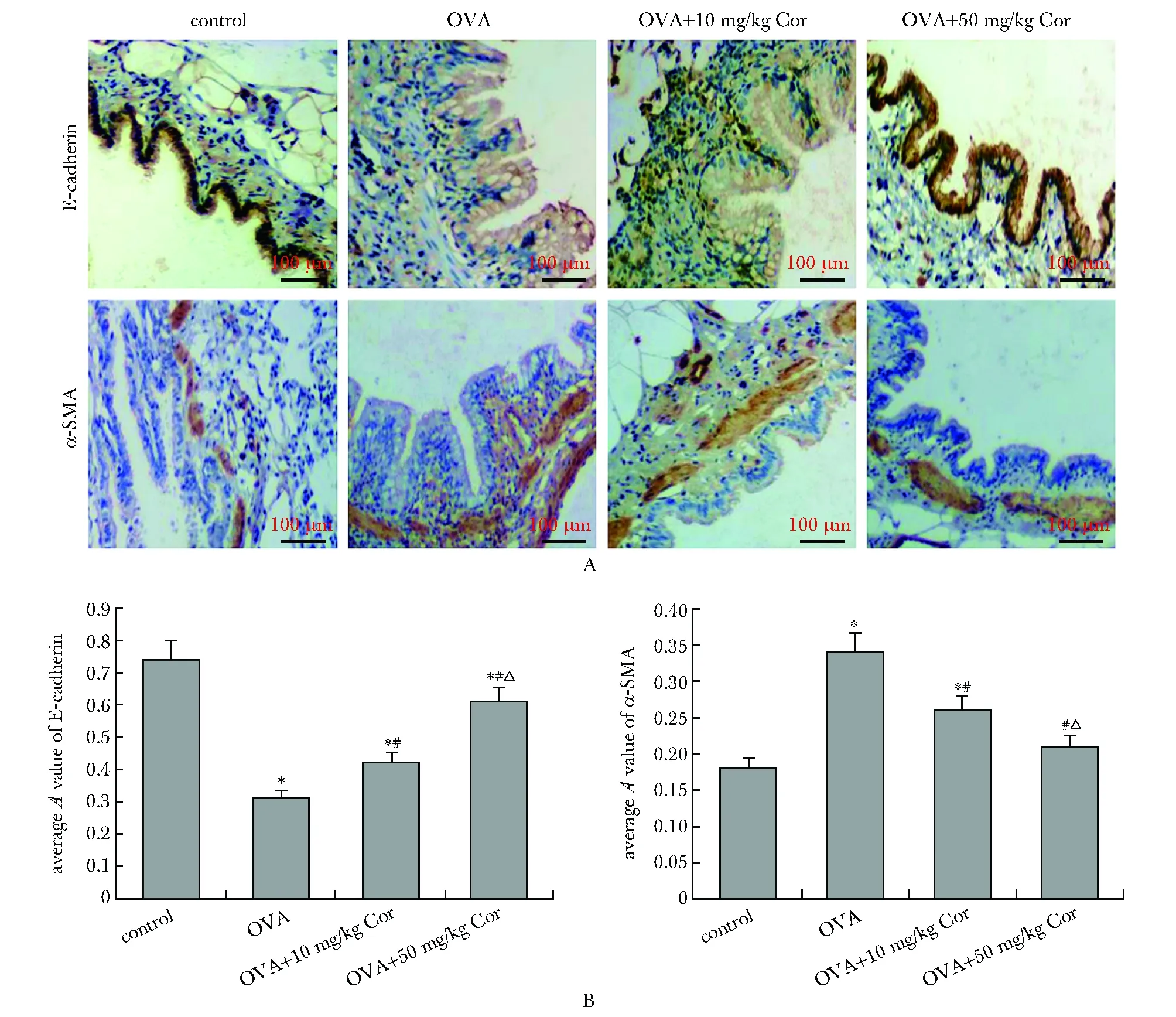
与对照组相比, OVA组大鼠肺组织中E-cadherin的染色程度降低, 而α-SMA的染色程度增加(P<0.05);与OVA组相比,OVA+10 mg/kg Cor组和OVA+50 mg/kg Cor组的E-cadherin的染色程度升高,而α-SMA的染色程度降低(P<0.05)(图2)。与对照组相比,OVA组大鼠肺组织中E-cadherin蛋白表达水平降低,而N-cadherin、α-SMA和vimentin蛋白表达水平升高(P<0.05)。与OVA组相比,OVA+10 mg/kg Cor组和OVA+50 mg/kg Cor组的E-cadherin蛋白表达水平升高,而N-cadherin、α-SMA和vimentin蛋白表达水平降低,且均呈剂量依赖性方式变化(P<0.05)(图3)。
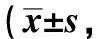
表1 大鼠BALF中的细胞计数Table 1 Count of cells in rat BALF n=3)

A.HE staining and Masson’s trichrome staining image; B.percentage of collagen fiber area in Masson’s trichrome staining; *P<0.05 compared with control group; #P<0.05 compared with OVA group; △P<0.05 compared with OVA+10 mg/kg Cor group
2.3 虫草素对TGF-β1诱导的人支气管上皮样细胞增殖和迁移的影响
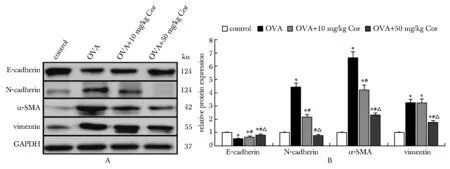
与0 μmol/L相比,当虫草素浓度达到80 μmol/L后,人支气管上皮样细胞16HBE细胞活力显著降低(P<0.05)(图4A)。因此,在后续实验中将虫草素浓度设为40 μmol/L。与对照组相比,TGF-β1组的细胞活力和迁移细胞数均升高(P<0.05);与TGF-β1组相比,TGF-β1+Cor组的细胞活力和迁移细胞数均降低(P<0.05)(图4B~D)。
A.E-cadherin and α-SMA immunohistochemical staining image; B.average A value of E-cadherin and α-SMA; *P<0.05 compared with control group; #P<0.05 compared with OVA group; △P<0.05 compared with OVA+10 mg/kg Cor group
A.Western blot; B.relative protein expression; *P<0.05 compared with control group; #P<0.05 compared with OVA group; △P<0.05 compared with OVA+10 mg/kg Cor group
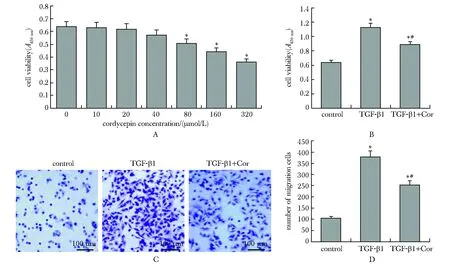
A.16HBE cell viability after treatment with different concentrations of cordycepin (CCK-8 method), *P<0.05 compared with 0 μmol/L; B.cell viability of 16HBE treated with 40 μmol/L cordycepin and TGF-β1 (CCK-8 method); C.migrating cells in the Transwell experiment; D.number of migrating cells; *P<0.05 compared with control group; #P<0.05 compared with TGF-β1 group
2.4 虫草素对TGF-β1诱导的人支气管上皮样细胞EMT的影响
与对照组相比,TGF-β1组16HBE细胞中E-cadherin蛋白表达水平降低,而N-cadherin、α-SMA和vimentin蛋白表达水平升高(P<0.05);与TGF-β1组相比,TGF-β1+Cor组的E-cadherin蛋白表达水平升高,而N-cadherin、α-SMA和vimentin蛋白表达水平降低(P<0.05)(图5)。
2.5 虫草素对TGF-β1诱导的人支气管上皮样细胞中Smad3、ERK1/2和c-Jun表达的影响
与对照组相比,TGF-β1组16HBE细胞中p-Smad3和p-ERK1/2蛋白表达水平升高(P<0.05);与TGF-β1组相比,TGF-β1+Cor组的p-Smad3和p-ERK1/2蛋白表达水平降低(P<0.05)。各组的Smad3和ERK1/2蛋白表达水平均无显著变化(P>0.05)(图6)。与对照组相比,TGF-β1组16HBE细胞中c-Jun的相对荧光强度升高(P<0.05);与TGF-β1组相比,TGF-β1+Cor组的c-Jun的相对荧光强度降低(P<0.05)(图7)。
3 讨论
据报道,虫草素可降低OVA致敏哮喘小鼠气道壁厚度、抑制促炎细胞因子、减少BALF中的嗜酸粒细胞和中性粒细胞数[6]。在哮喘小鼠中,虫草素通过抑制p38-MAPK和NF-κB信号通路来抑制Th2型反应,从而发挥平喘特性[7]。本研究结果也证实了虫草素对哮喘大鼠炎性反应和气道重塑的抑制作用。另外,本研究中,虫草素以剂量依赖性方式升高哮喘大鼠肺组织中上皮标志物E-cadherin蛋白表达水平,而降低间充质标志物N-cadherin、α-SMA和vimentin蛋白表达水平,这些结果表明虫草素抑制了哮喘大鼠EMT过程及气道重塑。
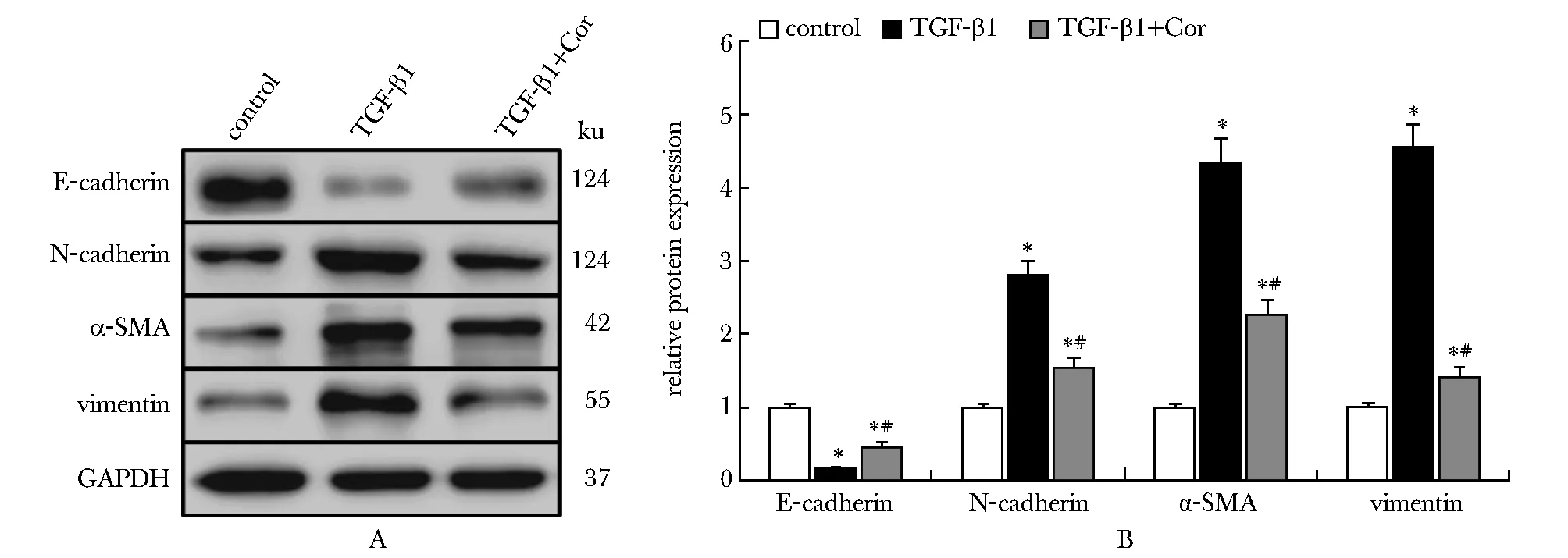
A.Western blot; B.relative protein expression; *P<0.05 compared with control group; #P<0.05 compared with TGF-β1 group
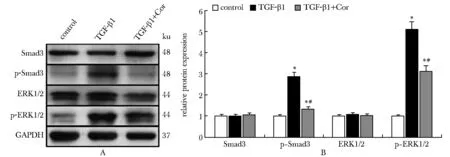
A.Western blot; B.relative protein expression; *P<0.05 compared with control group; #P<0.05 compared with TGF-β1 group
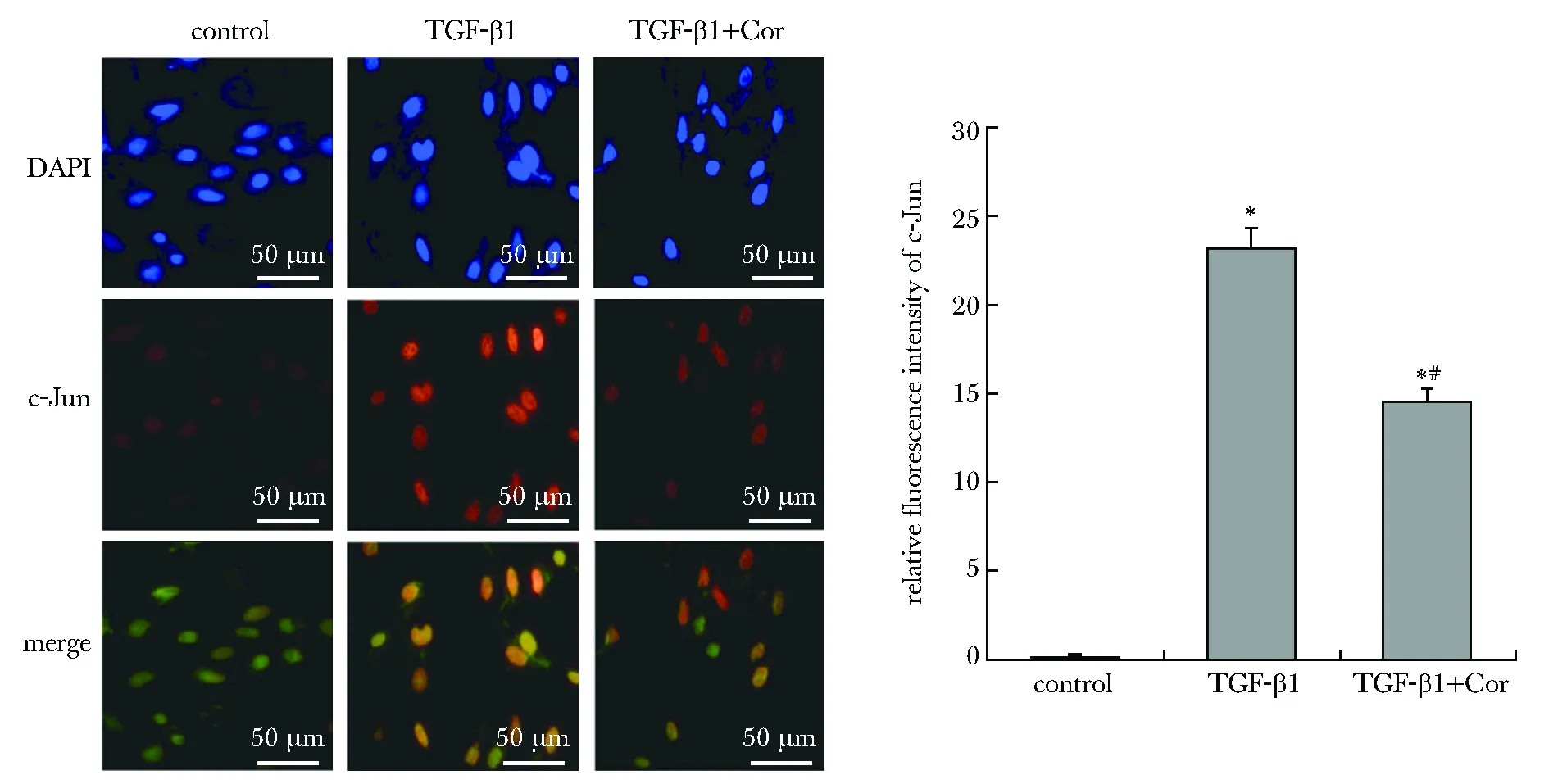
A.immunofluorescence staining image; B.relative fluorescence intensity of c-Jun; *P<0.05 compared with control group; #P<0.05 compared with TGF-β1 group
上皮细胞是哮喘发生过程中最具活性的分泌组织细胞之一,在哮喘气道重塑过程中,上皮细胞通过分泌多种生长因子或转化为肌成纤维细胞,从而加速EMT。EMT过程中,上皮细胞失去极性及细胞间的黏附作用,并通过细胞骨架的重组从而获得迁移能力,进一步加速气道重塑。TGF-β1是细胞存活和分化的重要调节因子,它可以促进上皮细胞和间质细胞纤维连接蛋白和胶原的产生[8]。目前,越来越多的证据表明TGF-β1是EMT的诱发因子[9]。因此,本研究使用TGF-β1培养人支气管上皮样细胞16HBE。结果显示,虫草素抑制了TGF-β1诱导的人支气管上皮样细胞的增殖、迁移及EMT,进一步证实了虫草素在哮喘中对EMT的抑制作用。
Smad蛋白是TGF-β调控系统的重要胞内效应器,可介导胞内信号传导,促进靶基因转录。TGF-β/Smad信号通路是哮喘潜在的治疗靶点[10]。抑制气道上皮细胞Smad3的产生可抑制TGF-β1诱导的EMT,从而治疗哮喘[11]。细胞外信号调节激酶(extracellular regulated protein kinases, ERK)1/2信号通路参与调节哮喘、慢性气道炎、气道高反应性等气道重塑过程[12]。在慢性哮喘大鼠模型中,ERK1/2高度激活[13]。c-Jun参与调节哮喘的气道炎性反应和重塑,c-Jun通过与c-fos结合形成异源二聚体(activator protein 1, AP-1)复合体调节Th2细胞下游因子的表达并加重哮喘[14]。本研究中,虫草素抑制了TGF-β1诱导的人支气管上皮样细胞中Smad3和ERK1/2信号通路的活化及c-Jun的表达,这可能是虫草素治疗哮喘的机制。
综上所述,本研究表明虫草素抑制哮喘中的EMT,其机制与对Smad3和ERK1/2信号通路及c-Jun的抑制有关。因此,虫草素在治疗哮喘方面具有较高的潜在应用价值。

