mTOR活化上调MGST1并增强细胞抗氧化能力
李 杰,浦 洋,张梦迪,张鹏举,许寅喆
(1. 中国医学科学院基础医学研究所 北京协和医学院基础学院 生理学系, 北京 100005;2.解放军总医院 第一医学中心 肝胆胰外科医学部 全军肝胆外科研究所 全军数字肝胆外科重点实验室,北京100853)
反应活性氧(reactive oxygen species, ROS)是一类含氧分子的高活性反应,是细胞氧耗和代谢的副产物。ROS产生过多导致的氧化还原稳态失衡,即细胞氧化应激,造成细胞内DNA、蛋白质和脂质的损伤并诱导细胞凋亡[1]。化疗、放疗等肿瘤治疗可以造成氧化应激诱导肿瘤细胞死亡,多项研究表明,肿瘤细胞抗氧化能力的增强促进其对放、化疗产生的耐药性[2]。
磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又称AKT)/雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路在调控细胞能量代谢和增殖等过程中起着至关重要的作用[3]。该通路中原癌基因PI3K和AKT功能获得性突变、抑癌基因磷酸酯酶与张力蛋白同源物(gene of phosphate and tension homology deleted on chromsome ten,PTEN)和结节性硬化症基因(tuberous sclerosis complex gene 1/2,TSC1/2)的失活突变会导致mTOR过度活化[4]。mTOR通路的异常激活促进细胞增殖和代谢重编程从而诱导肿瘤的发生发展[5]。研究表明,mTOR过度活化还可以增强肿瘤细胞的抗氧化能力导致其对肿瘤治疗耐受[6],但其具体机制有待阐明。
本研究利用氧化应激诱导剂处理野生型(WT)和TSC2敲除的小鼠胚胎成纤维细胞(tsc2-/-MEFs),并结合生物信息学和功能实验探讨mTOR过度活化增强细胞抗氧化能力的分子机制,对揭示mTOR活化介导的肿瘤细胞耐药具有重要意义。
1 材料与方法
1.1 材料
细胞裂解液、ROS试剂盒(上海碧云天生物技术公司);Bicinchoninic acid检测蛋白浓度试剂盒、细胞增殖毒性检测试剂盒、Hifair Ⅱ 1st Str和cDNA Synthesis 反转录试剂盒(上海翊圣生物科技有限公司);硝酸纤维素NC膜(思拓凡公司);DMEM高糖培养基(Corning公司);胰蛋白酶、胚胎牛血清(Gibco公司);β-actin抗体、磷酸化S6抗体(CST公司)、MGST1抗体(Abclonal公司);兔二抗-800通道、鼠二抗-800通道(LI-COR公司);PCR Mix(ABM公司);细胞总RNA提取试剂盒(上海奕杉生物科技有限公司);Lipo2000转染试剂盒(Invitrogen公司);无内毒素小提试剂盒(天根生化科技有限公司)。
1.2 方法
1.2.1 细胞的培养及干预:将57 mL胚胎牛血清和5.7 mL青链霉素双抗加到500 mL DMEM高糖培养基中用来培养WT和tsc2-/-MEFs,将细胞至于37 ℃、5% CO2孵箱中常规培养。细胞重悬并计数,铺200 000个细胞至6孔板内,待贴壁后加入亚精胺处理观察细胞的活力。
1.2.2 细胞ROS水平的检测:细胞接种至6孔板内,待贴壁后加入亚精胺处理细胞24 h,收集细胞利用DCFH-DA探针孵育30 min,之后用200 μL PBS重悬。将细胞过滤网制备成单细胞悬液并使用C6流式仪进行ROS-488通道的检测。
1.2.3 CCK8法检测细胞增殖和活力:将细胞至于96孔板内,4 000个细胞/100 μL。细胞按0、24、48和72 h时间培养,在规定时间点内在每个孔内加入10 μL CCK8试剂,培养箱孵育2 h。酶标仪检测450 nm处的吸光度值,观察细胞的增殖水平和活力。
1.2.4 生信数据的分析:利用R语言下载GEO数据库的芯片数据集GSE21755,limma包进行芯片数据的差异表达分析,clusterProfiler包进行基因集、通路富集分析,蛋白质互作网络分析使用Cytoscape软件进行分析。
1.2.5 实时荧光定量PCR检测细胞内基因表达量:利用细胞RNA提取试剂盒提取细胞的总RNA并测浓度,取1 μg进行反转录成cDNA。使用PCR mix配制相应的体系并利用实时PCR扩增仪进行实时荧光检测。内参基因使用ACTB。使用2-△△Ct值反映基因相对表达量。
1.2.6 Western blot检测细胞内蛋白的表达:使用细胞裂解液裂解细胞,将细胞至于150 μL裂解液中,冰上孵育30 min,期间振荡5次,离心并提取上清中总蛋白,使用BCA进行定量。配置15孔12.5%的SDS-PAGE蛋白胶,用蛋白量20~30 μg/孔进行电泳分离。利用电转仪,400 mA,1 h将蛋白转印至NC膜上,使用TBS配制5%脱脂牛奶,放置摇床缓慢摇动,室温封闭1 h。使用对应的一抗4 ℃孵育过夜后,加入荧光二抗室温孵育2 h。使用双色红外激光成像系统检测荧光二抗的强度以分析蛋白的表达情况。
1.2.7 ShRNA载体构建:通过https://www.sigmaal drich.cn/CN/zh/semi-configu--rators/shrna网站设计针对MGST1的短发夹干扰序列,MGST1-shRNA1:5′-C-C-CACCTGAATGATCTTGAAA-3′;MGST1-shRNA2:5′-CGCATTCCAGAGGAT-AACCAA-3′。干扰序列在擎科公司合成并进行退火形成双链,利用限制性内切酶EcorⅠ和AgeⅠ切pLKO.1载体37 ℃ 3 h,将退火片段与pLKO.1载体连接,提取质粒并进行测序验证shRNA的准确性。
1.2.8 慢病毒及细胞系的构建:使用Lipo2000转染试剂将包装质粒PMD2G、PSPAX2和目的载体pLKO.1以1∶2∶2转染进入293FT细胞,8 h后换液,48 h收集培养液上清,将上清0.45 μmol/L滤膜过滤后分装至1.5 mL EP管,-80 ℃保存。将1×105个细胞铺在6孔板内待贴壁后,将病毒液和新鲜全培养基以2∶1比例加入6孔板内感染细胞,同时加入1 000×凝聚胺增加感染效率。感染48 h后利用2 μg/mL的嘌呤酶素筛选含抗性的细胞,进行2代的筛选得到细胞系。
1.3 统计学分析
2 结果
2.1 tsc2-/- MEF的抗氧化能力增强
利用生物信息学对WT和tsc2-/-MEFs进行差异表达基因分析,发现有557个差异基因,其中273个为上调基因,284个为下调基因(图1A)。基因富集分析(GSEA)发现tsc2-/-MEFs的氧化还原通路上调(图1B)。对差异基因进行GO富集分析和KEGG信号通路分析发现多个上调的基因参与细胞还原通路(图1C,D),而下调的基因与细胞氧化还原通路无明显关系(图1E,F)。
2.2 mTOR高活性细胞的抗氧化能力更强
用于诱导细胞产生过量ROS的高剂量亚精胺(spermidine,SPD)[7]处理WT和tsc2-/-MEFs后,WT MEFs产生高浓度ROS,tsc2-/-MEFs的ROS水平则无明显变化(图2A)。不同浓度的亚精胺作用细胞后,与WT MEFs相比,tsc2-/-MEFs具有更高的细胞活力 (图2B),ROS清除剂乙酰半胱氨酸(acetylcysteine,NAC)可以恢复WT MEFs的细胞活力(图2C)。
2.3 mTOR活化促进MGST1的表达
通过富集分析选取与氧化还原通路相关的谷胱甘肽代谢通路,并对差异基因进行蛋白质相互作用网络构建,筛选出参与谷胱甘肽(GSH)代谢通路中的微粒体谷胱甘肽-S-转移酶(microsomal glutathione S-transferase 1,MGST1)基因(图3A)。基因芯片分析发现MGST1在tsc2-/-MEFs中显著上调(图3B),q-PCR和Western blot也验证了这一结论 (图3C,D)。mTOR抑制剂雷帕霉素处理tsc2-/-MEFs后,无论从mRNA水平还是蛋白水平,MGST1的表达均显著下降(图3E,F)。

A.differential gene analysis of WT and tsc2-/-MEFs; B.GSEA analysis of redox pathway; C,D.GO and KEGG analysis of upregulated genes; E,F.GO and KEGG analysis of down-regulated genes
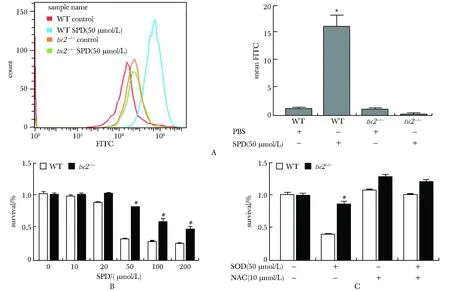
A.ROS level of WT and tsc2-/- MEFs by flow cytometry; B.effect of spermidine on WT and tsc2-/- MEFs viability; C.effect of spermidine combined with NAC on WT and tsc2-/- MEF viability; *P<0.05 compared with control group; #P<0.05 compared with WT MEFs group
2.4 下调MGST1降低tsc2-/-MEFs的抗氧化能力
构建MGST1敲低的tsc2-/-MEFs细胞系后,设计的两条位点特异shRNA均能显著抑制MGST1的表达水平(图4A,B),可用于后续功能实验研究。高剂量亚精胺处理后,MGST1敲低的tsc2-/-MEFs的细胞活力更低(图4C)。同时,MGST1的敲低可以显著抑制tsc2-/-MEFs的增殖(图4D)。对The Cancer Genome Atlas (TCGA)数据中的肝癌和黑色瘤患者进行生存分析,发现MGST1高表达的患者生存期低于低表达患者(图4E)。
3 讨论
mTOR作为细胞内能量代谢调节的枢纽,在多种癌中异常激活,并造成肿瘤细胞蛋白质合成、有氧糖酵解等代谢的增强[8-9]。ROS是细胞代谢过程中不可避免的代谢产物,肿瘤细胞往往表现出升高的ROS水平。高水平的 ROS 对肿瘤细胞的增殖、侵袭、转移和化疗耐药等具有重要意义,多项研究表明mTOR活化可以通过清除ROS抵抗药物诱导的细胞凋亡、自噬和铁死亡等死亡方式造成肿瘤细胞耐药[10],但具体的分子机制有待进一步阐明。本研究揭示mTOR的异常活化通过上调MGST1的表达增强细胞的抗氧化能力。
谷胱甘肽(glutathione,GSH)代谢通路是细胞内经典的抗氧化通路之一,还原型谷胱甘肽能够清除掉细胞内的氧自由基以维持细胞内氧化还原的平衡[11]。有研究报道,mTOR可以促进细胞内谷胱甘肽的合成[11]。本研究显示,与WT MEFs相比,谷胱甘肽代谢通路相关基因的表达在tsc2-/-MEFs普遍上调,进一步提示mTOR的活化通过促进谷胱甘肽代谢增强细胞的抗氧化能力。本研究通过对差异基因进行功能富集和蛋白质相互作用分析筛选出MGST1,该蛋白通过将还原型GSH连接到氧自由基,促进ROS的清除并维持细胞氧化还原稳态[12]。
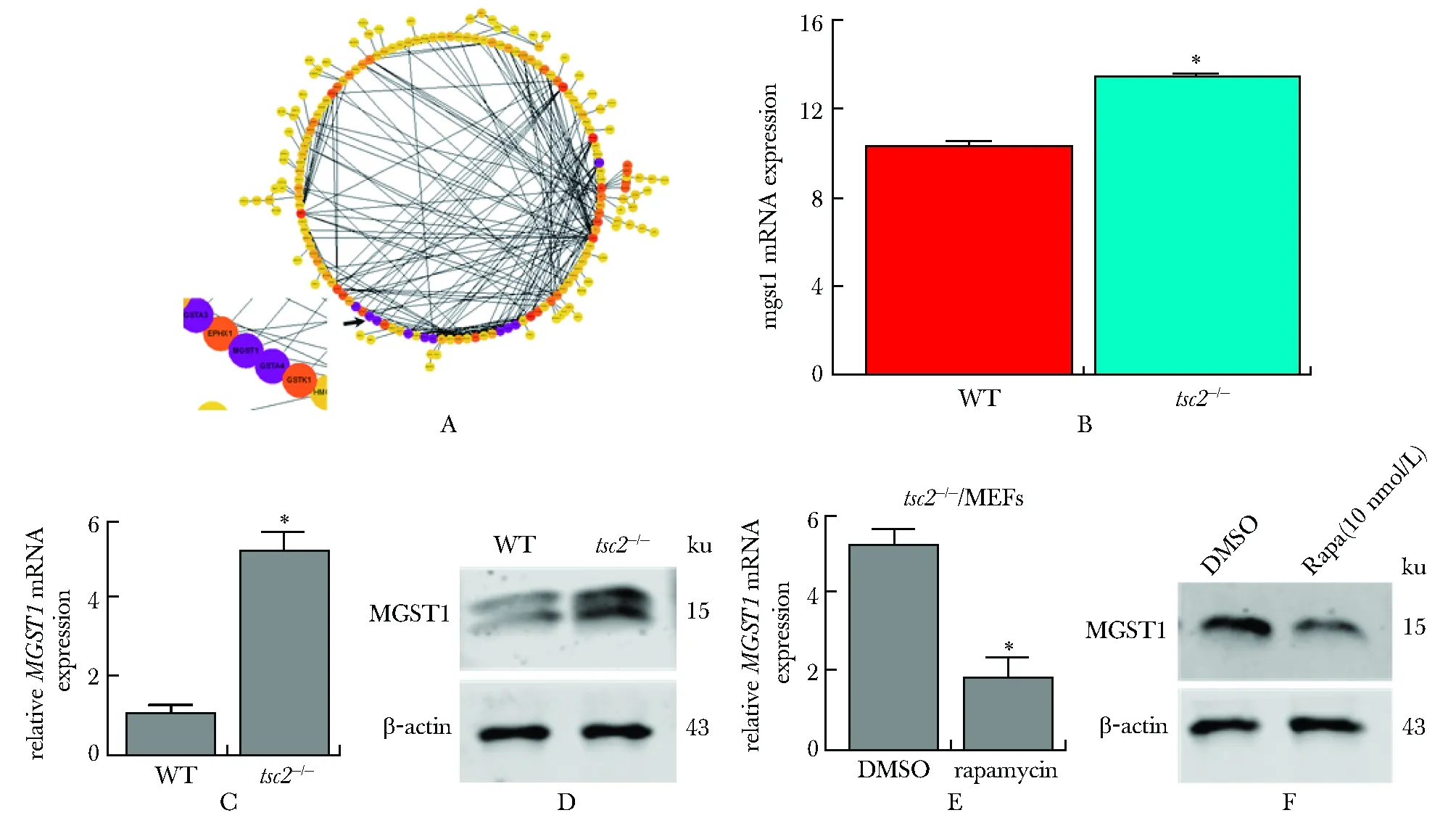
A.differentially expressed genes protein-protein interaction networks; B.expression of MGST1 in chip data; C, D.expression of MGST1 mRNA and protein in WT and tsc2-/- MEFs detected by fluorescence quantitative PCR and Western blot; E, F.expression of MGST1 mRNA and protein in tsc2-/- MEFs detected by fluorescence quantitative PCR and Western blot; *P<0.05 compared with control group
本研究发现,敲低该基因造成tsc2-/-MEFs对ROS诱导的细胞死亡更敏感,说明MGST1在mTOR高活性细胞的抗氧化防御过程中扮演着重要角色。
许多mTOR抑制剂已被批准用于治疗人类癌,比如晚期肾细胞癌一线药物坦罗莫司和肾癌二线药物依维莫司等。不幸的是,有效治疗几个月或几年后肿瘤就能对第一代mTOR抑制剂产生耐药性,而且很可能也会对第二代mTOR抑制剂产生耐药性[13]。本研究揭示了mTOR活化细胞的耐药新机制,指出MGST1有可能成为治疗mTOR活化耐药肿瘤的新靶点,为耐药肿瘤的治疗提供新的方向。

A, B.relative MGST1 mRNA and protein expression levels detected by fluorescence quantitative PCR and Western blot; C,D.viability and proliferation detected by CCK8 method; E.survival of mTOR high-expression patients with high or low MGST1 expression in melanoma from TCGA cancer data sets; *P<0.05 compared with control group

