Ni/de-ZSM催化剂的制备及其氨分解制氢性能
张后甫, 郝晓琼, 银凤翔, 李国儒, 何小波
(常州大学 石油化工学院, 江苏 常州 213164; 江苏省绿色催化材料与技术重点实验室(常州大学),江苏 常州 213164)
化石燃料的过度消耗引发的环境污染问题推动了清洁可再生能源的快速发展。氢能因其具有热值高和燃烧产物无污染等优势,被认为是最有希望的新能源之一[1]。在众多制氢工艺中,氨分解制氢是一种极具潜力的制氢技术[2-3]。NH3中氢的质量分数高达17.65%,体积能量密度为108 kg/m3,是一种有效储氢介质;并且NH3易液化,容易运输和储存[4]。氨分解制氢可以作为一种有前途的原位制氢方式为燃料电池提供氢燃料,由于氨分解制氢工艺是无碳的[5],可以有效避免燃料电池阳极催化剂中毒失活问题。氨分解制氢通常在催化剂存在的条件下进行,在已有研究中,钌基催化剂是最活泼的,但其储量稀缺、成本高昂,严重阻碍了其大规模商业化[6-8]。近年来,地球上丰富而廉价的过渡金属(如镍[9-11]、铁[12]、钴[13]等)已被广泛应用于氨分解制氢的研究中。其中,Fe,Ni是替代Ru作为氨分解活性组分的良好选择。但Fe会在低温条件下形成稳定的氮化物降低催化性能,而Ni不存在类似的问题[14],因此,镍基催化剂在氨分解研究中备受青睐。
研究表明,通过引入比表面积较大、易于在“金属-载体”间构建强相互作用的载体(如SiO2[15],Al2O3[16],CNTs[17],Ce0.8Zr0.2O2[18]),将镍基活性物质分散于载体上,使其更大程度地参与催化反应,有助于提高镍的催化剂活性,进而提高反应效率。GU等[16]以Al2O3为载体制备了Ni/Al2O3催化剂,其中Al2O3的高比表面积为Ni提供了更多的活性位点,使得Ni/Al2O3的氨分解性能较好;DENG等[18]以Ce0.8Zr0.2O2为载体制备了Ni/Ce0.8Zr0.2O2催化剂,得益于Ce0.8Zr0.2O2的介孔结构和高表面积,以及Ce和Zr的促进作用,氨分解性能很好。相较而言,ZSM分子筛是一种具有良好热稳定性、大比表面积和表面酸度可调的载体材料,可以作为高效分散纳米粒子的催化剂载体[19]。
以脱铝预处理后的ZSM(de-ZSM)作为催化剂载体,通过浸渍法制备了Ni/de-ZSM催化剂。采用XRD,TEM,BET,H2-TPR,XPS等多种技术对制备的Ni/de-ZSM催化剂的结构进行了表征,并详细研究了Ni/de-ZSM催化剂氨分解催化性能。
1 实验材料和方法
1.1 材 料
硅铝比为38的球形ZSM-5分子筛购自天津元立化工有限公司,Ni(NO3)2·6H2O(AR)和 HNO3(AR)购自阿拉丁(上海)试剂有限公司,高纯氢(99.999%)和液氨(99.999%)购自常州市武进华阳气体有限公司。
1.2 样品制备
将购买的ZSM-5浸泡于13 mol/L 的HNO3溶液中,并在80 ℃ 的水浴中搅拌12 h进行脱铝预处理,离心分离后120 ℃ 干燥24 h,将得到的粉末记为de-ZSM。称取2 g de-ZSM粉末置于坩埚中,然后加入一定量的 Ni(NO3)2·6H2O(Ni的质量分数分别为1%,3%,5%,7%,9%),加入少量去离子水浸渍。静置干燥后将样品放到马弗炉中进行分段焙烧,先在300 ℃ 焙烧1 h,然后再在600 ℃ 焙烧3 h,自然冷却后得到样品命名为xNi/de-ZSM(未还原)(x=1%,3%,5%,7%,9%)。
1.3 催化剂表征
采用X射线衍射仪(XRD,D/MAX2500,日本Rigaku公司)分析样品的晶相结构,以Cu K为辐射源,电压为40 kV,电流为40 mA,扫描范围2θ为5°~80°,步长为0.02°。通过透射电子显微镜(TEM,SUPRA 55,德国ZEISS公司)观察催化剂微观形貌。采用X-射线光电子能谱(XPS,ESCALAB 250,美国Thermo公司)分析样品中不同元素及价态,以Al Kα靶为射线源,步长为0.1 eV,所有元素的结合能均参照C 1s(284.8 eV)进行校正。采用吸附仪(CHEMBET-3000,美国Quanta Chorme 公司)测定样品的比表面积和孔径分布。采用BET算法计算样品的比表面积,采用NLDFT方法获得样品的孔径分布。测试前,样品在300 ℃ 下真空脱气3 h。采用程序升温还原(FINESORB-3010,浙江泛泰仪器有限公司)测试样品中Ni物种与载体de-ZSM之间的相互作用及其还原难易程度,催化剂先在120 ℃ 的Ar气氛下吹扫30 min,然后将气体切换为25 mL/min的10%H2/Ar混合气,再以10 ℃/min的升温速率从室温升至900 ℃ 进行程序升温还原性测试。
1.4 催化性能测试
采用固定床反应器在常压下对合成的催化剂进行氨分解性能评价。称取0.1 g催化剂(250~380 μm)置于内径为4 mm的石英管中,在600 ℃ 下,采用高纯H2(20 mL/min)对催化剂进行还原处理1 h(经过氢气还原后的样品记为 5%Ni/de-ZSM(还原))。然后温度降至300 ℃ 后将气体切换为NH3(50 mL/min,空速为30 000 mL/(h·g),吹扫30 min后,将温度调至测量温度(300~800 ℃)进行氨分解制氢性能评价。采用气相色谱(GC4000A,北京东西电子分析有限公司)在线分析各组分的含量,氨分解转化率按照式(1)计算
(1)
式中:X为NH3的转化率;A0为空白NH3峰面积;A1为催化反应后NH3的峰面积。氢气生成速率按照式(2)计算
(2)
式中:r为氢气生成速率;X为NH3的转化率。
氨分解反应活化能根据阿伦尼乌斯方程式(3)进行曲线拟合得到
(3)
式中:r为氢气生成速率;k0为指前因子;Ea为反应表观活化能;T为热力学温度;R为摩尔气体常量,8.314 J/(mol·K)。
2 实验结果与讨论
2.1 催化剂表征
图1是所制备催化剂的XRD图。图1(a)为不同负载量的Ni/de-ZSM的XRD图。所有XRD曲线均具有典型MFI(三维孔道)结构的特征衍射峰,表明Ni的负载对ZSM-5骨架结构影响不大。在图1(a)中可以发现在2θ为37.2°,43.3°,62.9° 处观察到3个不同于ZSM-5结构的新衍射峰,分别对应于NiO (JCPDS编号47-1049)的(111)(200)(220)晶面,表明NiO纳米颗粒成功地生长。同时随着Ni含量的增加,NiO峰的强度逐渐增加,说明随着Ni负载量的增加,NiO纳米颗粒的结晶度增加,尺寸增大。图1(b)为经过氢气还原前后的5%Ni/de-ZSM催化剂XRD图,其中5%Ni/de-ZSM(还原)不仅保持了ZSM结构,而且在2θ为44.5°,51.8°,76.3° 处观察到3个明显的衍射峰,它们分别对应于Ni(JCPDS 04-0850)的(111)(200)(220)晶面。经过氢气还原后,催化剂中的NiO峰均转变为Ni峰,这表明催化剂中的NiO被还原为Ni。与GU等[20]通过原位XRD得出的结论一致,在Ni基氨分解催化剂中起催化活性作用的是Ni,而不是NiO[21-23]。结合活性数据和H2-TPR结果[24],也可以得出同样结论。
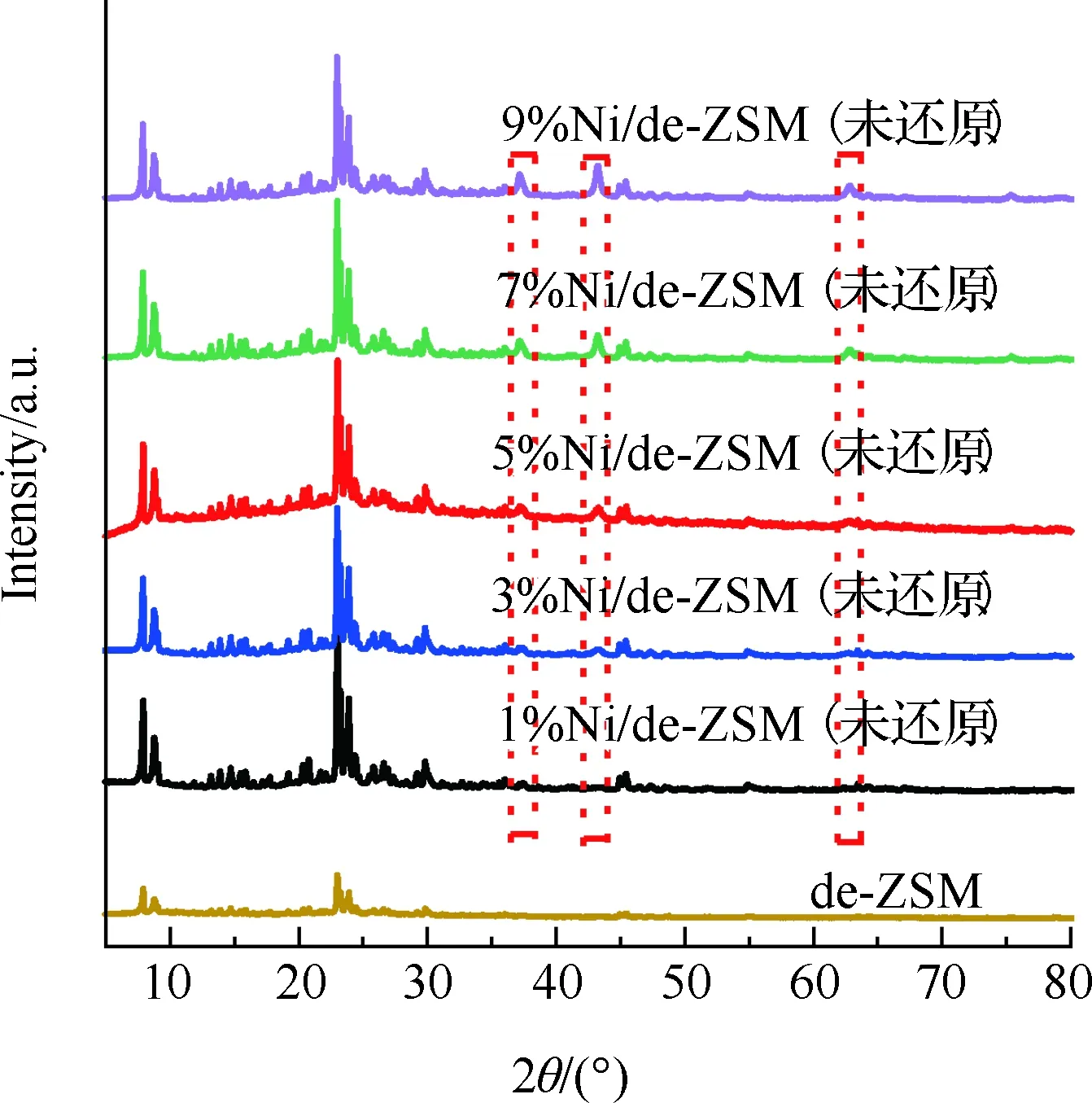
(a) de-ZSM及xNi/de-ZSM(未还原)
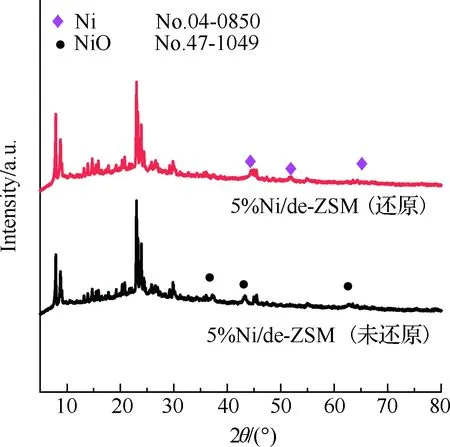
(b) 氢气还原前后5%Ni/de-ZSM催化剂
图2为催化剂的透射电镜图。从图2(a)~图2(c)可以看出,在5%Ni/de-ZSM(还原)催化剂中,Ni纳米颗粒粒径大约为9.65 nm,均匀分布在de-ZSM上。高分辨透射电子显微镜图片显示的晶格间距为0.20 nm,对应于Ni(111)晶面[25],进一步说明经过氢气还原后NiO纳米颗粒转化为Ni纳米颗粒。从图2(d)~图2(f)可以看出,在5%Ni/de-ZSM(未还原)催化剂中,NiO纳米颗粒粒径大约为16.67 nm,较为密集地分布在载体de-ZSM上。从高分辨透射电子显微镜图片中可以看到清晰的晶格条纹,晶格间距为0.24 nm,对应于NiO(111)晶面。从图2(g)~图2(i)可以看出,在3%Ni/de-ZSM(未还原)催化剂中,NiO纳米颗粒粒径大约为16.34 nm,较为密集地分布在载体de-ZSM上。从高分辨透射电子显微镜图片中可以看到清晰地晶格条纹,晶格间距为0.24 nm,对应于NiO(111)晶面。从图2(j)~图2(l)可以看出,在7%Ni/de-ZSM(未还原)催化剂中,NiO纳米颗粒粒径大约为17.27 nm,较为密集地分布在载体de-ZSM上。从高分辨透射电子显微镜图片中可以看到清晰的晶格条纹,晶格间距为0.24 nm,对应于NiO(111)晶面。
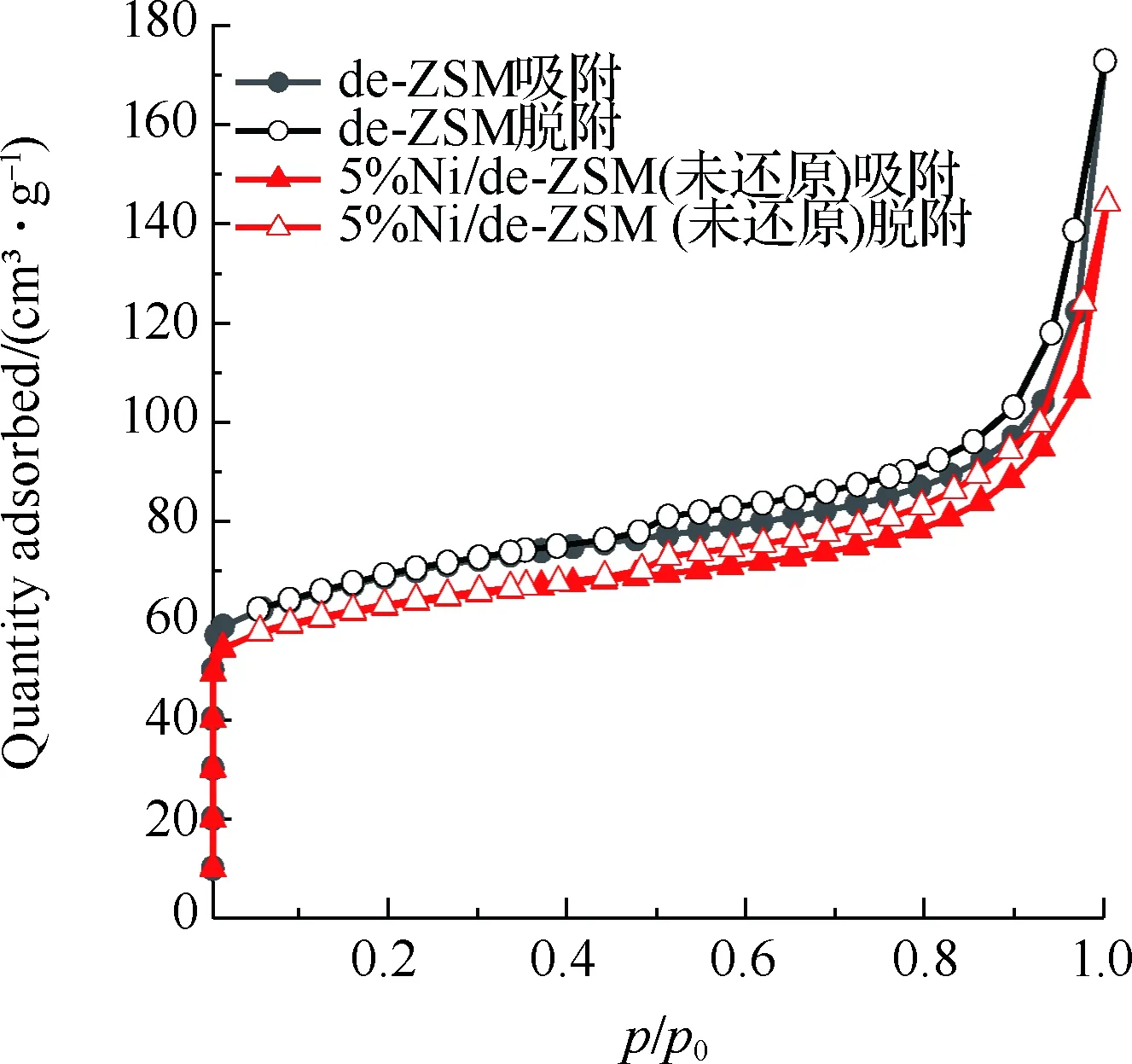
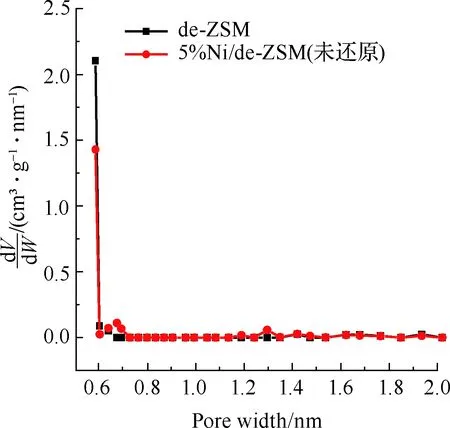
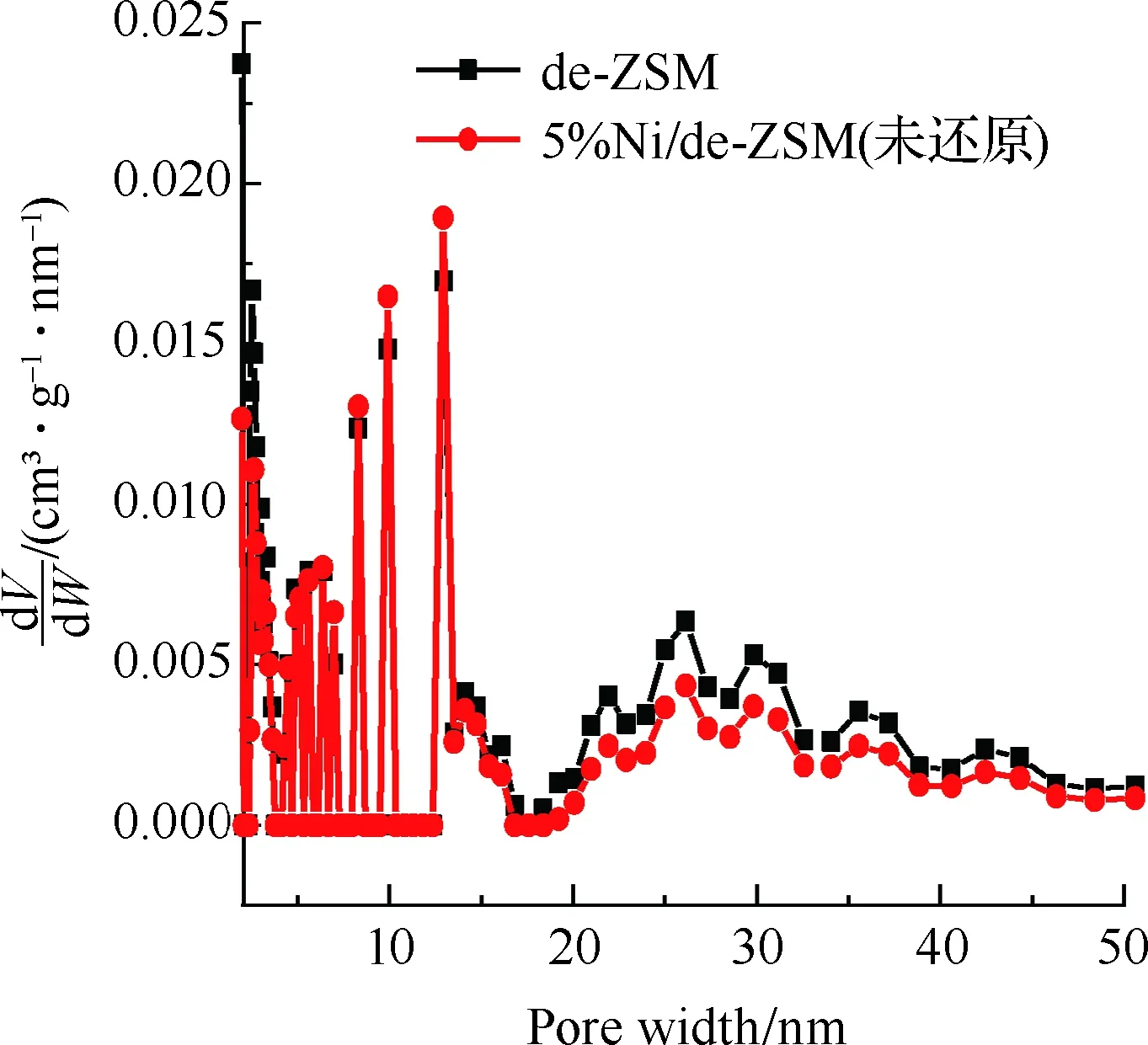
图3为催化剂的吸附等温线及孔径分布图,样品结构特性见表1。图3(a)为de-ZSM和5%Ni/de-ZSM(未还原)催化剂的吸附等温线。de-ZSM和5%Ni/de-ZSM(未还原)均为V型曲线,H3型迟滞回线,符合介孔和微孔复合结构的特征。图3(b)为de-ZSM和5%Ni/de-ZSM(未还原)催化剂的微孔孔径图,de-ZSM和5%Ni/de-ZSM(未还原)均在0.59 nm孔径处有个高峰,表明de-ZSM和5%Ni/de-ZSM(未还原)的微孔孔径集中分布于0.59 nm左右,属于微孔结构。图3(c)为de-ZSM和5%Ni/de-ZSM(未还原)催化剂的介孔孔径分布图,de-ZSM和5%Ni/de-ZSM(未还原)有着相似地介孔孔径分布,这与图3(a)的N2吸附等温线图结果相一致,表明de-ZSM和5%Ni/de-ZSM(未还原)催化剂中介孔/微孔多级孔共存。de-ZSM的比表面积为220 m2/g,孔体积为0.19 cm3/g,孔径大小为3.74 nm。负载金属Ni后,5%Ni/de-ZSM(未还原)催化剂的比表面积、孔体积和孔径都略有下降,分别为198 m2/g,0.15 cm3/g和3.51 nm。这是因为Ni负载在ZSM载体上,载体表面的Ni颗粒聚集致使比表面积下降[25-26]。

(a) 5%Ni/de-ZSM(还原)TEM

(b) 5%Ni/de-ZSM(还原)HRTEM

(c) 5%Ni/de-ZSM(还原)粒径分布图

(d) 5%Ni/de-ZSM(未还原)TEM

(e) 5%Ni/de-ZSM(未还原)HRTEM

(f) 5%Ni/de-ZSM(未还原)粒径分布图

(g) 3%Ni/de-ZSM(未还原)TEM

(h) 3%Ni/de-ZSM(未还原)HRTEM
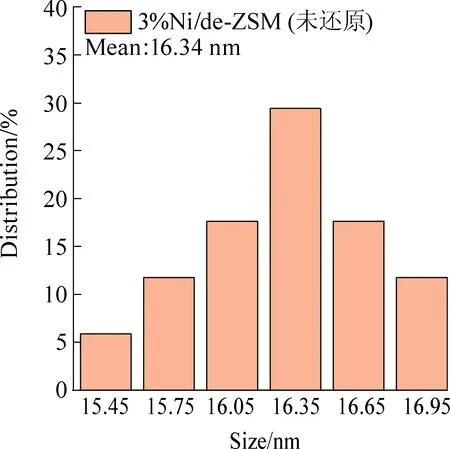
(i) 3%Ni/de-ZSM(未还原)粒径分布图
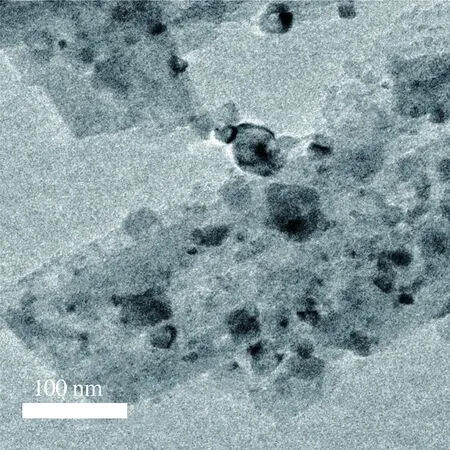
(j) 7%Ni/de-ZSM(未还原)TEM

(k) 7%Ni/de-ZSM(未还原)HRTEM

(l) 7%Ni/de-ZSM(未还原)粒径分布图
(a) N2等温吸附脱附图
(b) 微孔孔径分布图
(c) 介孔孔径分布图

表1 样品结构特性
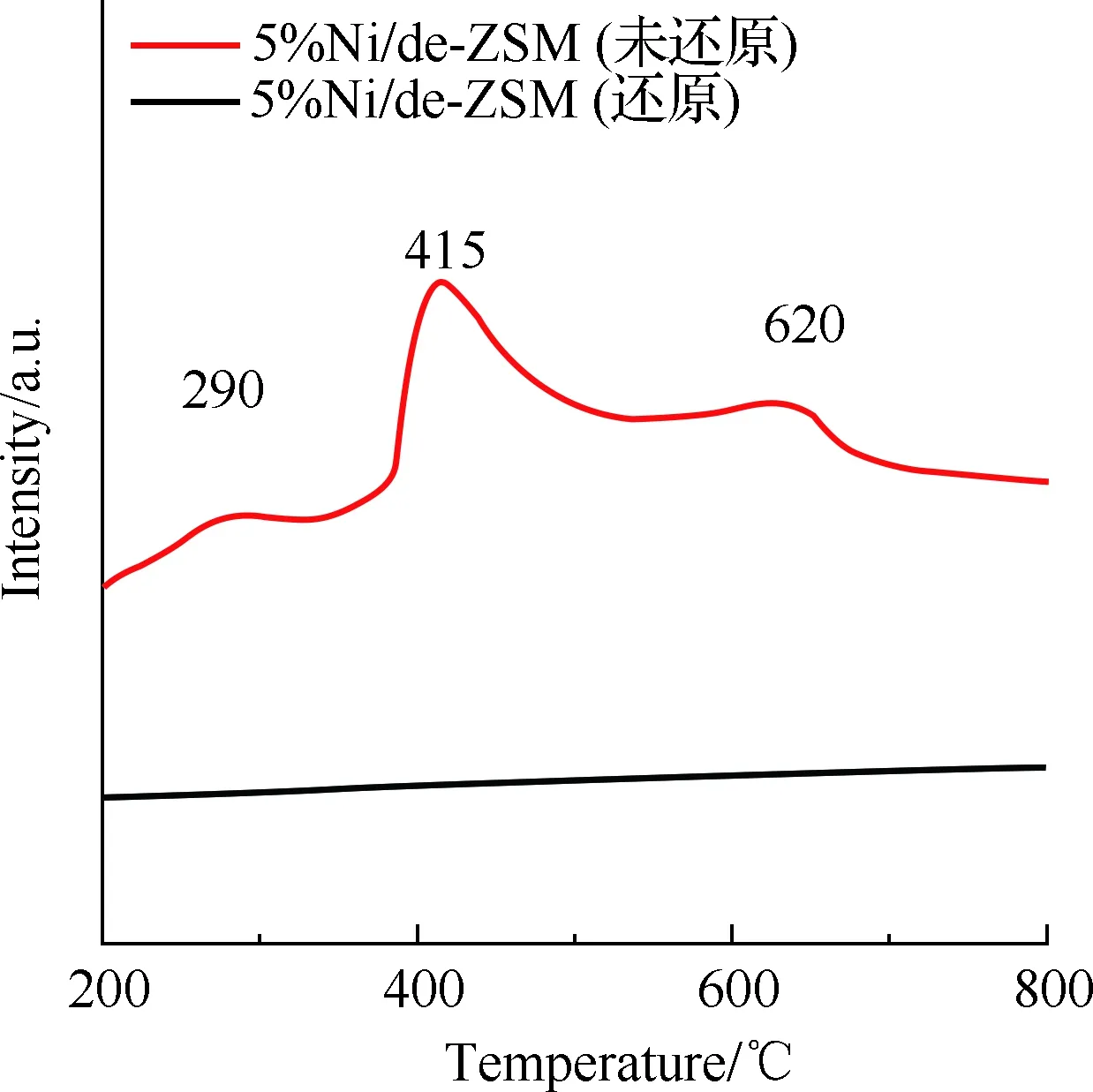
图4 5%Ni/de-ZSM催化剂H2-TPR图Fig.4 H2-TPR diagram of 5%Ni/de-ZSM catalysts
镍基金属和载体间相互作用可以由H2-TPR表征得到。图4为5%Ni/de-ZSM(还原)及5%Ni/de-ZSM(未还原)催化剂的H2-TPR图。5%Ni/de-ZSM(未还原)催化剂分别在290,415,620 ℃ 附近存在3个明显的还原峰。其中低温区290 ℃ 附近的氢气还原峰对应于高度分散的镍元素,说明金属组分与载体具有较弱的相互作用[14,27]。在中温区415 ℃ 附近的氢气还原峰对应于氧化镍纳米颗粒[28-29]。高温区620 ℃ 附近的还原峰对应与载体具有强相互作用的镍元素[18,30]。5%Ni/de-ZSM(还原)催化剂没有还原峰出现,表明该催化剂中金属氧化物-载体之间的相互作用不明显,这也证实了在氨分解反应中起作用的是游离镍而不是载体中的其他物质[24]。
XPS用于分析催化剂表面的化学成分以及检测催化剂表面物种的氧化状态。图5为de-ZSM和5%Ni/de-ZSM的XPS图。从图5(a)可以看出,5%Ni/de-ZSM样品表面具有明显的Ni 2p峰,表明Ni元素成功地负载在de-ZSM载体上。图5(b)是Ni 2p的高分辨率光谱,通过分峰拟合可以看到Ni/de-ZSM(还原)的Ni 2p3/2在852.5,855.7 eV处有2个峰,分别对应于Ni0和Ni2+[31]。而Ni/de-ZSM(未还原)中Ni 2p3/2在854.9,856.6 eV处有2个峰,分别对应于Ni3+和Ni2+[32-33],并没有Ni单质存在[31]。各元素的电子结合能见表2,其中Ni/de-ZSM(未还原)在856.6 eV处的Ni2+峰强度要高于854.9 eV处的Ni3+峰强度,这表明在Ni/de-ZSM(未还原)表面的Ni主要以Ni2+存在,有少量的Ni3+存在。通过对比2种催化剂的XPS图进一步证实,还原后催化剂中活性零价镍含量提高,再次证实了催化剂经过氢气还原预处理的必要性。
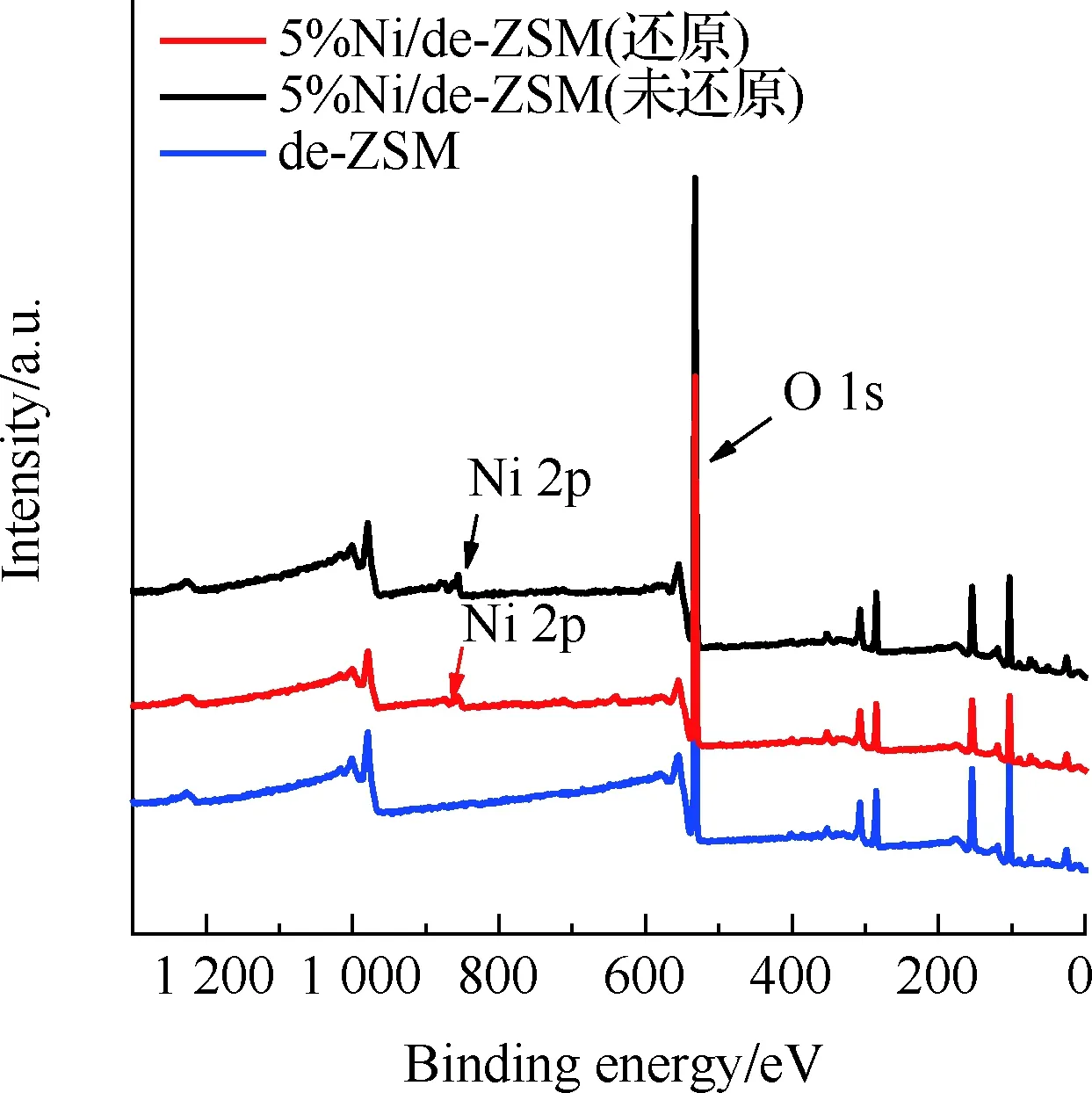
(a) 5%Ni/de-ZSM催化剂总谱
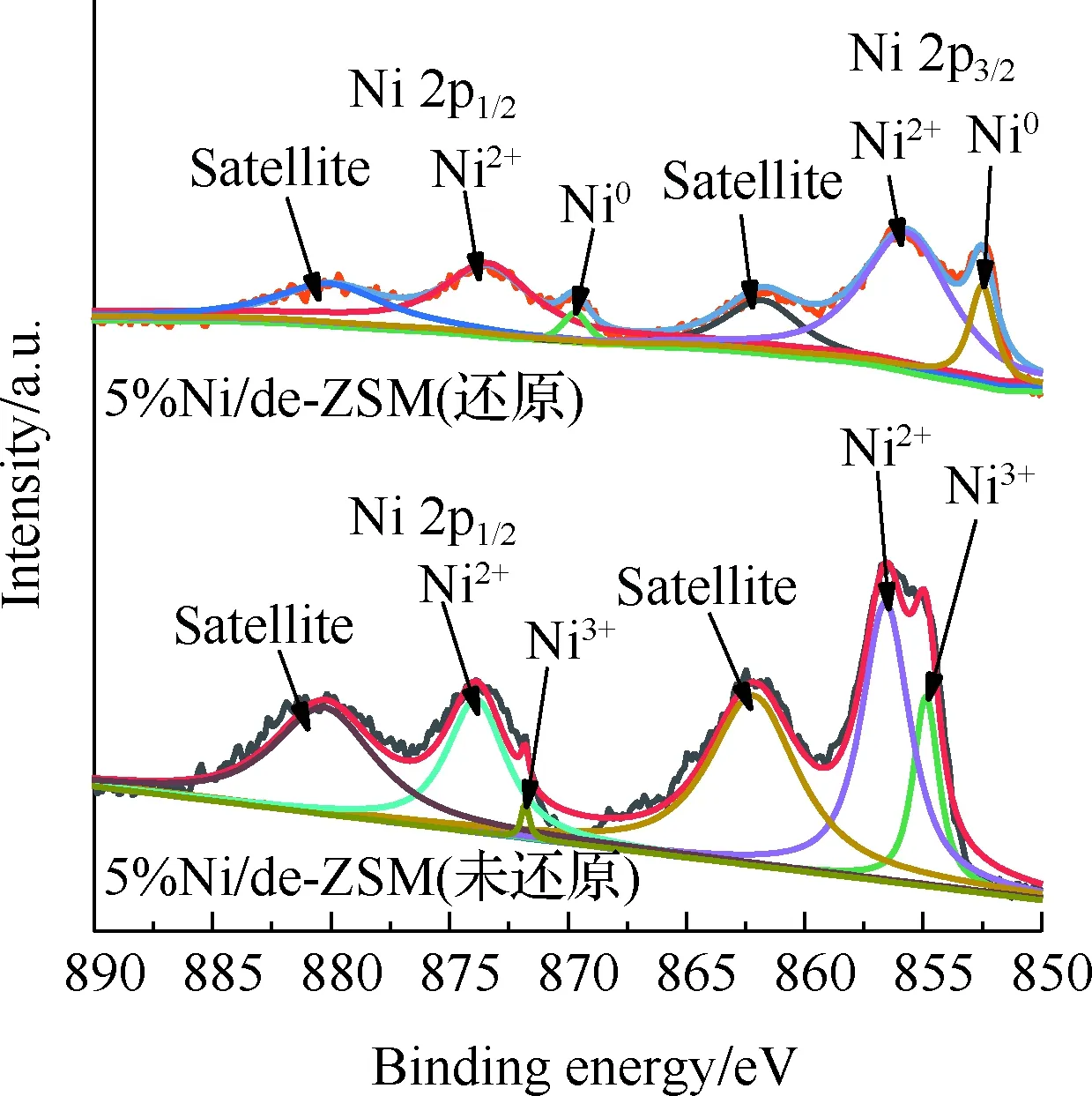
(b) Ni 2p的高分辨率XPS光谱
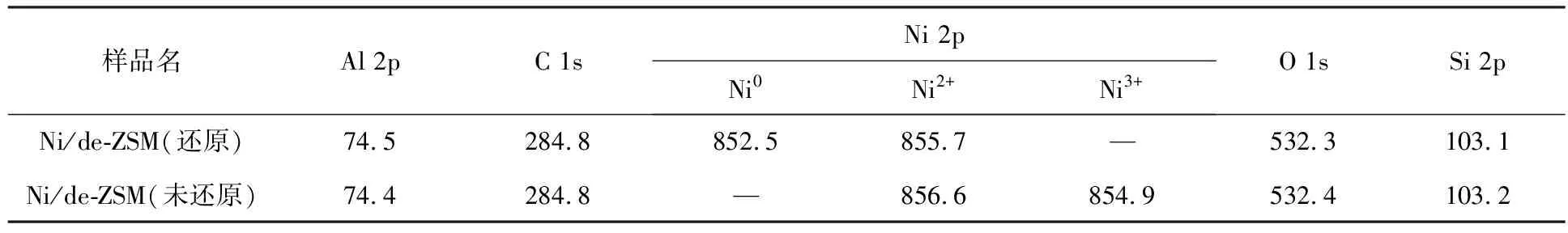
表2 不同催化剂中Ni,Al,C,O,Si的电子结合能
2.2 氨分解性能
图6为不同Ni负载量的Ni/de-ZSM催化剂的氨分解转化率图,在空管情况下,温度升至750 ℃ 时,氨气转化率基本为0,说明在此高温无催化剂的情况下,氨无法分解。在载体de-ZSM的作用下,升温至600 ℃ 时,氨气开始分解,继续升温至700 ℃ 时,氨气的转化率达到58%,说明载体具有一定的氨分解活性。相比于纯de-ZSM载体,负载Ni后,系列Ni/de-ZSM复合催化剂的氨分解转化率均明显提高,说明Ni活性物种确实对氨分解反应有促进作用。具体而言,当Ni的负载量由0增加至5%时,相应氨分解转化率逐步提高。图1(a)中XRD的结果随着Ni含量的增加,NiO峰的强度逐渐增加,也表明Ni含量的增加是氨分解转化率提升的主要原因。当Ni的负载量达到5%时催化剂的氨分解转化率达到最大,在400 ℃ 时氨气开始分解,550 ℃ 时氨气转化率已经达到了44%。与已有的文献Ni/SiO2[34],Ni/BaMnO3[35]等催化剂性能较为接近,详细对比见表3[35-39]。当Ni含量进一步增加时,催化剂的氨分解转化率没有明显提升。图2粒径分布图的变化规律可以解释催化剂活性随着Ni负载量变化的规律:当Ni的负载量低于5%时,NiO颗粒分布均匀且颗粒粒径为16 nm左右;随着Ni负载量的继续增加,催化剂表面NiO颗粒粒径略微增加,这是由于颗粒团聚而引起的。这也是7%Ni/de-ZSM催化剂的Ni负载量虽然增高,但是其氨分解性能并没有继续提升的原因。

图6 不同Ni/de-ZSM催化剂的氨分解转化率图Fig.6 Ammonia decomposition conversion of Ni/de-ZSM catalysts with different proportions

表3 550 ℃ 下不同催化剂氨分解催化性能比较
为了考察还原处理对催化剂性能的影响,进一步比较了还原前后5%Ni/de-ZSM催化剂的氨分解性能,结果如图7(a)~图7(c)所示。图7(a)为5%Ni/de-ZSM(还原)和5%Ni/de-ZSM(未还原)催化剂的氨分解转化率图。5%Ni/de-ZSM(还原)在400 ℃ 时氨气开始分解,650 ℃ 时氨气转化率已经达到了90%。而未经H2还原的催化剂(5%Ni/de-ZSM(未还原))在500 ℃ 时氨气才开始分解,且在相同温度下的氨分解转化率明显低于经过H2还原的催化剂,说明H2还原处理有利于提高催化剂的催化活性,这是因为H2还原处理可以将原始复合物中NiO完全转化为高活性的Ni(图1)。图7(b)为催化剂催化氨分解时的氢气生成速率图,随着温度持续升高,5%Ni/de-ZSM(还原)催化剂的氢气生成速率由400 ℃ 时的0.54 mmol/(min·g)逐渐升高到700 ℃ 时的31.29 mmol/(min·g),高于相同温度下5%Ni/de-ZSM(未还原)的氢气生成速率,进一步说明5%Ni/de-ZSM(还原)更易于产氢。通过阿伦尼乌斯图(图7(c))中拟合曲线的斜率可以计算得到催化剂的氨分解反应的表观反应活化能,5%Ni/de-ZSM(还原)催化剂的表观活化能为83.81 kJ/mol,远低于5%Ni/de-ZSM(未还原)的表观活化能(143.00 kJ/mol),并低于文献报道的类似催化剂,如3%Ni/MRM(116.7 kJ/mol)[22],90%Fe/Al2O3(127 kJ/mol),90%Co/Al2O3(123 kJ/mol)[40],且接近于5%Ru/MgO(83.3 kJ/mol)[41], 20%Ni/Al2O3(88 kJ/mol)[22]。为了进一步探究催化剂的稳定性,将5%Ni/de-ZSM(还原)催化剂在650 ℃ 下进行氨分解反应持续40 h,结果如图7(d)所示,该催化剂在650 ℃ 下高效稳定,说明该催化剂可以稳定高效催化氨分解制氢。
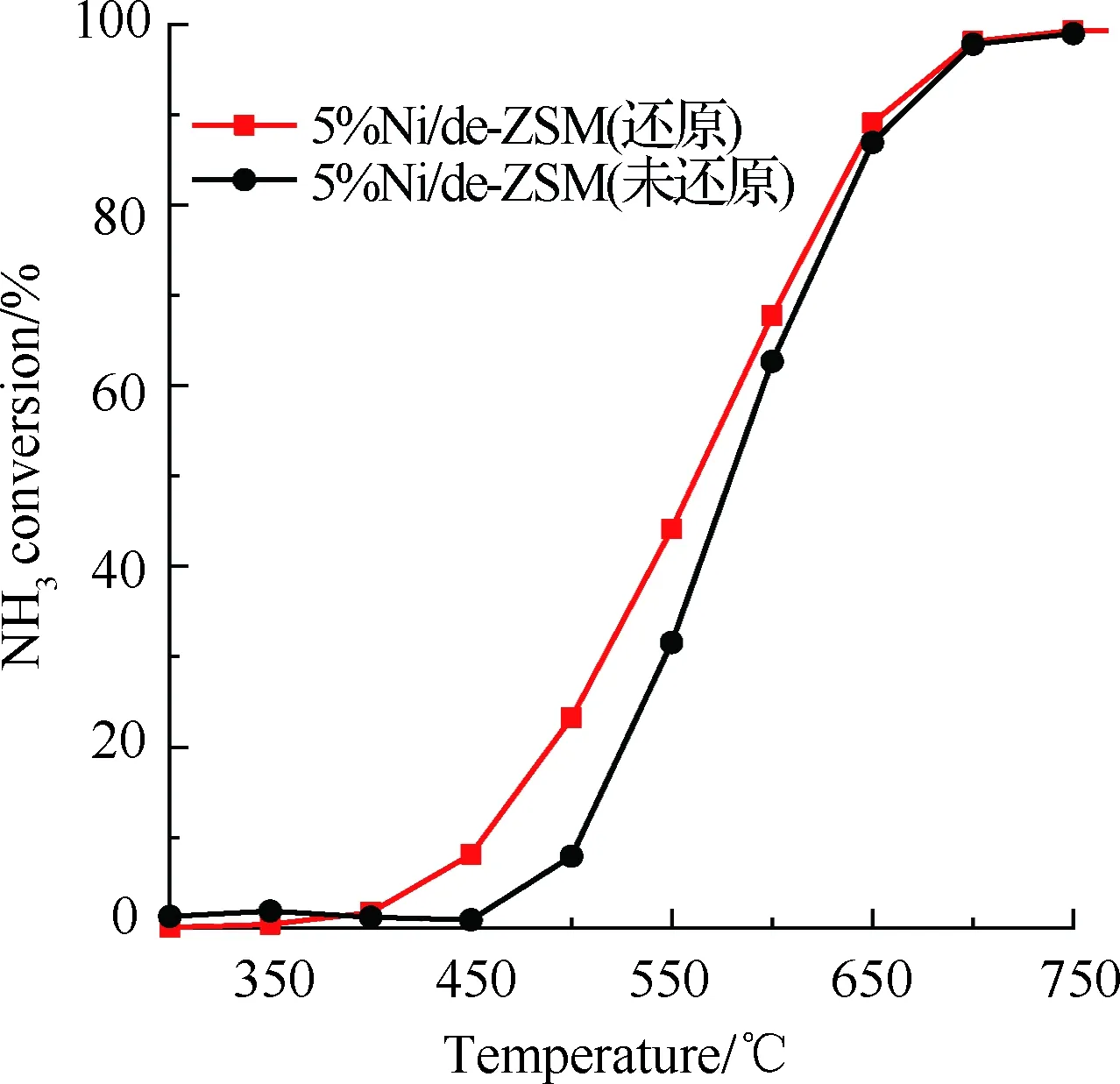
(a) 氨分解转化率图
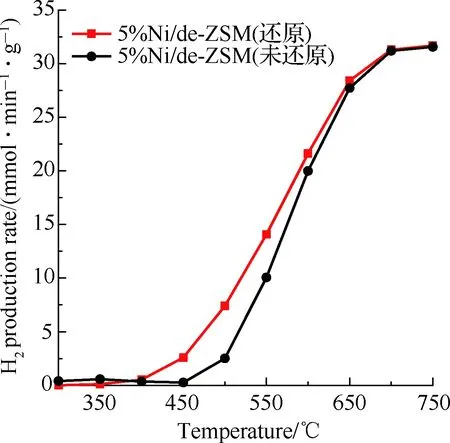
(b) 氢气生成速率图
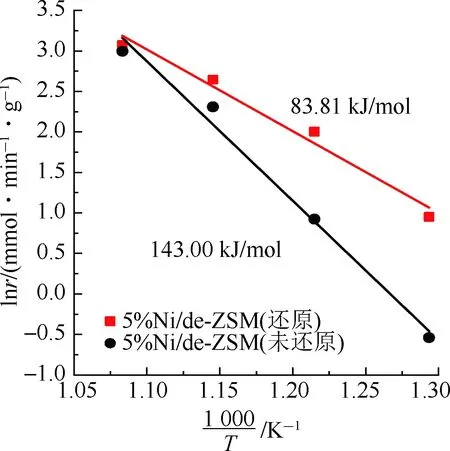
(c) 阿伦尼乌斯曲线图

(d) 稳定性测试图
3 结 论
通过浸渍法将镍高度分散负载在ZSM上,制备得到Ni/de-ZSM催化剂,合成原料成本低,合成方法简单快捷。当镍负载量为5%时,5%Ni/de-ZSM催化氨分解性能最优。当温度为650 ℃ 时,氨分解转化率已经达到了90%,氢气生成速率为28.41 mmol/(min·g),并且该催化剂在650 ℃ 进行了稳定性测试,40 h内氨分解性能没有明显下降。经由XRD,H2-TPR,TEM对还原和未还原的催化剂结构进行表征,发现经氢气还原后NiO纳米颗粒被还原成Ni纳米颗粒,表明氢气还原处理可以提升Ni/de-ZSM催化剂的催化氨分解性能。

