不同材料中红曲霉的分离及对比研究
张敏星,周 游,许 玫,陈文品
(1.重庆三峡职业学院农林科技学院,重庆 404155;2.重庆三峡学院生物与食品工程学院,重庆 404120;3.华南农业大学 园艺学院,广东 广州 510642)
红曲菌隶属真菌界(Eumycophyta)、子囊菌门(Ascomycota)、真子囊菌纲(Euascomycetes)、散子囊菌目(Eurotiales)、红曲菌科(Monascaceae)、红曲属(Monascus)[1]。红曲霉是腐生真菌,生长的最适pH值为3.5~5.0,嗜乳酸,耐10%乙醇,生长温度为26~42℃,最适温度32~35℃。1979年,Akira Endo[2]从红色红曲霉(Monascus ruber)中分离出一种胆固醇合成抑制剂Monacolin K,即洛伐他汀,具有良好的血脂调解功能,被广泛应用于高血脂症的治疗中。红曲米是以大米为主要原料经红曲菌发酵而成,在我国已有1 000多年的应用历史,是红曲霉菌种选育常见的分离材料[3]。
2003年,普洱茶中首次发现了有洛伐他汀的存在[4],随后还发现洛伐他汀是普洱茶中发现的唯一他汀类化合物[5],此后陆续有报道在普洱茶中检测到洛伐他汀,尤其是陈年普洱茶中,但并不是所有普洱茶中都存在[6-7]。普洱茶有减肥茶、美容茶、益寿茶等美称,大量科学研究显示普洱茶对人和动物具有降血脂功效[8-10],相比绿茶、乌龙茶、红茶等降脂功效更显著[11-12],可能与普洱茶中特有的降脂成分洛伐他汀有关[13]。近年来,国内外学者对普洱茶中产洛伐他汀微生物开展了研究[14-15],但鲜有报道从普洱茶中分离到红曲霉。
以红曲米和普洱茶为原料,通过不同分离方法进行红曲霉菌种的分离,目的是为了更好挖掘降脂红曲霉种质资源,揭示降脂功能食物与红曲霉之间的关系,为后续研究红曲霉与洛伐他汀降脂普洱茶之间的关系提供参考依据。
1 材料与方法
1.1 菌种分离材料
红曲米:市售的2种红曲米。
茶叶:4个不同发酵程度普洱熟茶、2个不同年份陈年普洱茶,共6个茶样。
1.2 培养基
马铃薯葡萄糖琼脂培养基(PDA):去皮马铃薯200 g,切碎成丁,加水煮沸30 min,纱布滤渣,加无水葡萄糖20 g,琼脂粉20 g,加热搅拌,冷却后定容至1 000 mL,高压灭菌锅于121℃下灭菌20 min。
麦芽汁琼脂培养基(MEA):称取麦芽粉,加4倍60℃的水,在65℃水浴中糖化3~4 h,糖化程度用碘液滴定(不变蓝色即可),纱布过滤,滤液稀释至约10 Brix,加入2%琼脂,于121℃下灭菌20 min。
麦芽汁培养基(MA):直接使用麦芽汁培养基药品配制,即取130.1 g麦芽粉(含氯霉素),加水至1 000 mL,混匀,于121℃下灭菌20 min。
1.3 分离方法
点接法直接分离:在双人双面超净工作台上,将材料以三点法点接在PDA培养基和MEA培养基上进行菌种分离,操作完成后置于恒温培养箱培养。
稀释涂布平板法:分别取1 g材料,加入9 mL无菌水,然后依次稀释至300倍、9 000倍、270 000倍的不同浓度,取0.2 mL涂布接种于MEA培养基上,每个浓度重复3皿。
选择性平板分离法:用无菌水按1%冰醋酸和5%乙醇配制pH值为3的处理液,将分离材料于处理液中活化24 h,再涂布接种于PDA平板培养基上培养。
选择性液体分离法:含10%的无水乙醇、pH值为3的麦芽汁培养基进行分离。
1.4 纯化方法
待培养基中长出肉眼可见大小不同的菌落,采用菌丝顶端纯化法,接种到PDA和MEA培养基上,继续培养观察,直到所见菌落形态可判定为同一种菌种。
1.5 鉴定方法
(1)菌落形态鉴定方法。将已分离的红曲菌株采用3点法分别接种到MEA、PDA平板培养基上,25℃下培养7 d,观察并记录菌落特征。菌落形态特征包括菌落大小、颜色、质地、厚薄、纹饰、边缘形态、渗出物及色素等。
(2)个体显微形态鉴定。直接制片观察法[16],即从生长7 d的菌落上用镊子挑取少量菌丝体,放在预先擦净并滴有乳酸石炭酸-苯酚溶液或者蒸馏水的载玻片上,用解剖针和镊子小心地将菌丝分散开来,盖上洁净盖玻片,置于生物显微镜下观察,并记录观察结果。个体显微形态包括菌丝特征、闭囊壳特征、分生孢子形态特征等。
关于分离菌株在菌落形态和个体显微形态的鉴定是否属于红曲霉属,参考学者李忠庆等人[1,17]的分类鉴定标准。
2 结果与分析
2.1 红曲霉的分离
对红曲霉进行分离时,分离方法采用材料点接法、稀释涂布平板法和选择性排他培养法,分离培养基采用半合成培养基(PDA、MEA)、加酸加醇的处理液和加酸加醇的麦芽汁液体培养基进行分离,最终从红曲米中分离到9株红曲霉,普洱茶中没有分离到红曲霉。
2.1.1 不同分离方法的分离效果
试验结果表明,不同分离方法,尤其是培养条件不同,分离效果不同。试验中,采用加酸加醇选择性培养手段,创造适于红曲霉生长的条件进行分离,效果最好,分离到的基本都是红曲霉属菌种。采用点接法及稀释涂布平板法在半合成培养基上能分离到红曲霉,但同时也分离出曲霉属、青霉属、酵母菌等其他微生物,进而影响到红曲霉菌株后续的分离纯化。
红曲霉具有嗜酸耐乙醇的生长特性,但生长速度较缓慢,在平板分离纯化中容易被其他丝状真菌覆盖而难以被分离纯化出来,目前对可培养红曲霉的分纯方法有直接分离法和排他分离法[18],总结红曲霉分离纯化的简易方法,在培养条件中加入乳酸和酒精以抑制其他微生物生长,可达快速分离红曲霉的目的[19]。
2.1.2 不同培养基的生长对比
在红曲霉的分离及后期纯化过程中,同种材料、同种红曲霉菌株在不同培养基上生长表现不同。
红曲霉在不同培养基上的生长表现见图1。
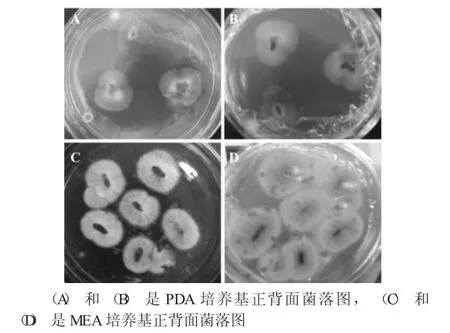
图1 红曲霉在不同培养基上的生长表现
在PDA培养基上,红曲霉生长明显受到一定程度的限制,菌落直径小、较薄,表面的菌丝短而稀疏,菌落背面分泌色素多为红色或粉红色物质。在MEA培养基上,红曲霉生长旺盛,菌落直径大、有一定厚度,表面菌丝密而长、多数呈绒毛状,菌落背面分泌色素多为橙黄色物质。
2.2 红曲霉的纯化
在红曲霉的分纯过程中发现,其生长表现易受外界条件影响,同一菌株在相同培养基上培养相同时间,菌落形态特征存在差异。推测可能是红曲霉纯化接种操作过程中培养皿内氧气含量不同而导致的,因此在试验中选取了一株红曲霉进行氧气对生长表现影响的试验。将红曲霉菌株以三点法接种在MEA培养基中,保鲜膜包扎后于培养箱培养,3次重复。菌株培养7 d后,分别进行脱膜透气处理和不脱膜处理。
氧气对红曲霉生长表现的影响见图2。
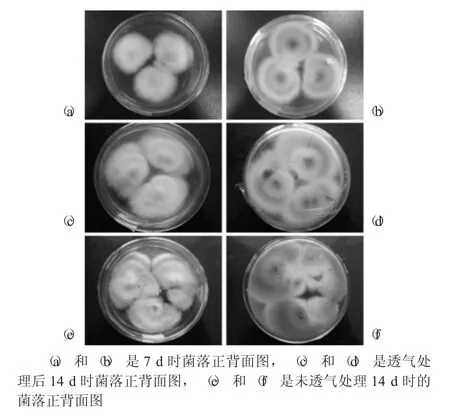
图2 氧气对红曲霉生长表现的影响
由图2可知,接种7 d后(图2(a)和(b)),可见菌落表面白色,气丝密、绒毛状;菌落背部橙黄,有一明显橙色同心圈,边缘气丝长、浅黄色。7 d时,将其中一培养皿进行脱膜透气处理,透气处理后(图2(c)和(d)),菌落长势变化较大,表面气丝在脱膜后生长旺盛,到14 d时略显衰落,菌落背面橙红,色素分泌明显增多。未经脱膜透气处理(图2(e)和(f)),菌落生长缓慢,在培养至14 d时,其长势相较透气处理差异明显,相较7 d时则变化差异不大。结果表明,红曲霉在不同氧气环境中生长表现不同,充足的氧气环境有利于红曲霉分泌色素物质,积累代谢产物。
此外,在红曲霉的分纯过程中还发现,红曲霉受到青霉、曲霉、酵母等其他微生物污染时,接触部位红曲色素分泌量增多、差异显著,且气生菌丝较长。
其他微生物与红曲霉共生时红曲霉生长表现图见图3。
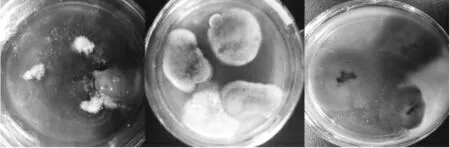
图3 其他微生物与红曲霉共生时红曲霉生长表现图
微生物的生长代谢受营养供给影响,当多种微生物共存时,会在营养、空气等方面存在竞争或合作等交互关系,进而影响生长表现。由此可见,红曲霉的生长代谢易受外界条件影响,如对红曲霉的鉴定进行到具体菌种时,除了传统的形态学鉴定,借助分子生物学鉴定显得十分必要。
2.3 红曲霉的鉴定
通过红曲米和普洱茶中红曲霉的分离纯化及鉴定,最终共分离到9株红曲霉。
不同红曲菌在MEA斜面培养基上的菌落形态图见图4,不同红曲霉的形态特征观察记录见表1。
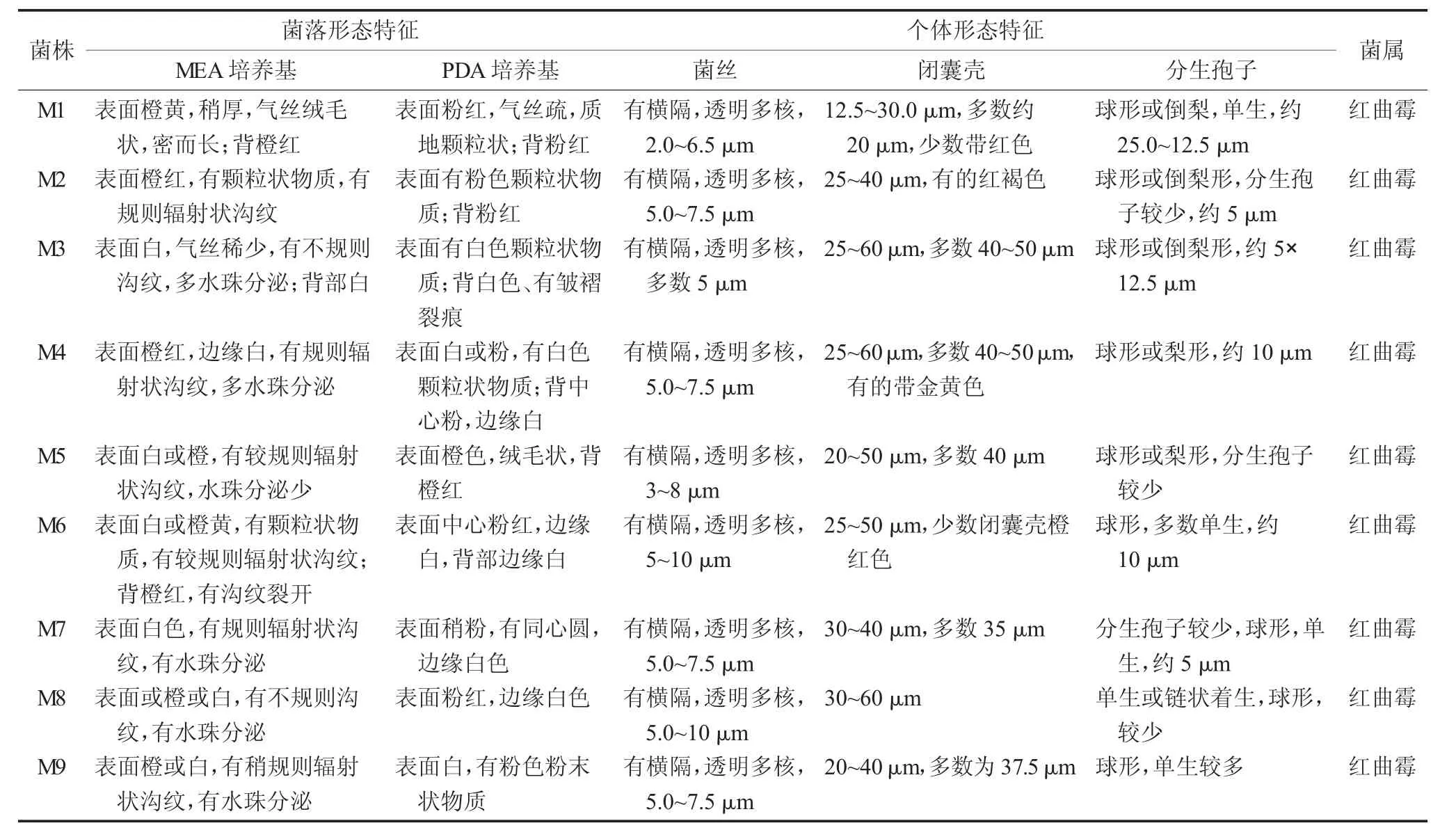
表1 不同红曲霉的形态特征观察记录
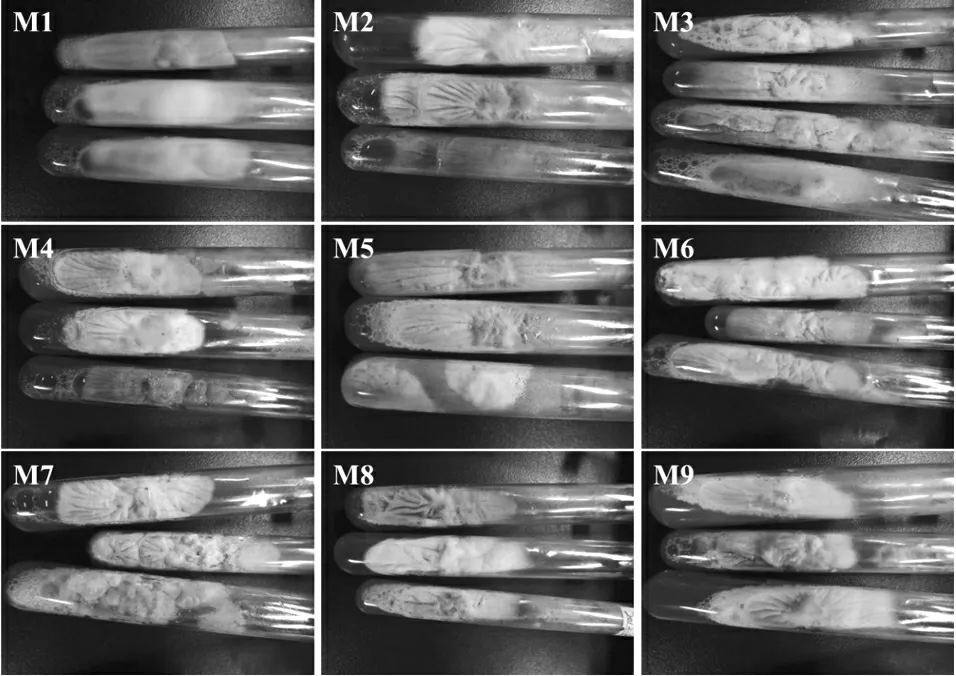
图4 不同红曲菌在MEA斜面培养基上的菌落形态图
9株菌的菌落形态特征表现为菌落初期为白色,后期变为黄色、橙黄、粉色、橙红色、紫红色等,表面菌丝多为绒毛状、多数密而长、少数较稀疏,多有颗粒状物质,部分有水珠分泌,背部有规则或不规则辐射纹。9株菌的个体显微形态特征表现为菌丝均有横隔、透明而多核、少数菌丝较宽;都有闭囊壳结构;分生孢子多数单生、呈球形,也有2~6个向基式链状着生的。对比这9株菌株的菌落形态和个体形态,符合红曲霉属分类标准中的形态特征,可确定为红曲霉属微生物。
2.4 2种材料分离结果的对比分析
2.4.1 红曲米中红曲霉的分离结果
试验从红曲米和普洱茶中分离红曲霉,红曲米中分离到9株红曲霉,普洱茶中没有分离到红曲霉。红曲米是以大米为主要原料经红曲菌发酵而成,在我国已有1 000多年的应用历史,性温、味甘、无毒,具消食活血、健脾温胃等功效,红曲米的功效与红曲霉密切相关[3]。目前,对红曲霉菌种的选育,主要从红曲发酵产品中获得,多数分离材料是红曲米[20-21],也有从酒醅、红腐乳、老陈醋中进行分离,结果都能分离到红曲霉。因此,红曲米成为诸多学者选育降脂红曲霉最常见、分离效果最好的材料之一。试验分离到9株红曲霉,都来自红曲米,也证实红曲米确实是红曲霉菌种选育的良好材料。
2.4.2 普洱茶中红曲霉的分离结果
试验中选用了6个普洱茶样作分离材料,包括4个不同发酵程度普洱熟茶、2个不同年份陈年普洱茶(均为20年以上),共6个茶样,都未分离到红曲霉。根据前人对普洱茶中他汀类物质的研究可知,陈年普洱茶中有检测到洛伐他汀,并不是所有普洱茶中都存在[6-7]。试验选择20年陈年普洱茶为分离材料,同时考虑到普洱熟茶中天然存在黑曲霉、青霉、根霉、酵母等优势菌群可能会干扰红曲霉的分离,采用直接分离和加酸甲醇选择性分离法,都未分离到红曲霉。
试验结果表明,茶普洱茶中可能没有红曲霉存在或红曲霉种类和数量极少,因此分离不到或较难分离到红曲霉。
3 结论
红曲霉具嗜酸耐乙醇的生长特性,在分离时可通过添加乳酸和酒精,有助于抑制其他微生物生长而达到快速分离红曲霉的目的。红曲霉在受到营养供给、氧气供给及其他微生物等外界条件影响时,出现色素分泌增多、菌丝生长旺盛的表现,使得与纯菌株时形态特征表现不同,因此对红曲霉的鉴定到具体菌种时,借助分子生物学手段十分必要。
通过红曲米和普洱茶对红曲霉的分离纯化及鉴定,试验最终共分离到9株红曲霉,其形态特征表现为菌落初期为白色,后期因分泌色素而变为黄色、橙、粉色、紫红色等;个体显微形态上菌丝均有横隔,有闭囊壳结构,分生孢子多数单生、呈球形。
红曲米中分离到9株红曲霉,普洱茶中未分离到红曲霉。结合前人研究结果可知,红曲米是选育红曲霉的良好材料,而普洱茶存在的洛伐他汀是否与红曲霉有直接关系,还有待进一步研究。

