微生物源抗菌肽抗肿瘤特性的研究进展
王露露, 陈 洲, 贾英民
(北京工商大学食品与健康学院, 北京100048)
AMPs是由12~50个氨基酸残基组成的小生物分子,是先天免疫系统的重要组成部分[1]。AMPs具有分子量小、易溶于水、耐热性强、抗菌谱广和不易产生耐药性等特点[2-3]。AMPs 依据其来源的不同可分为动物源AMPs、植物源AMPs、微生物源AMPs和人源AMPs等,其中,动物是AMPs最主要的来源[4-5],但动物源AMPs的提取和纯化相当复杂,限制了其生产应用。而自1925年首次发现微生物源AMPs以来,微生物源AMPs凭借其生产周期短、成本低、操作简单并易于实现工业化等优势,逐渐凸显出其应用优势。
AMPs主要用于抗菌研究,包括抗细菌和抗真菌。研究表明,AMPs具有广谱抗细菌活性,对G+菌或G-菌甚至两类菌都具有杀伤作用。不同AMPs在抗菌活性方面存在较大差异,且抗菌谱也明显不同。大多数AMPs对G+菌的抑制效果更为显著,如短杆菌分泌的短杆菌肽S对G+菌的最小抑菌浓度MIC低于3 μg/mL,但对G-菌的MIC范围则是3~12.5 μg/mL;多粘芽孢杆菌产生的Fusaricidin A除对4种G+菌有抑制作用外,还对白色念珠菌等10株真菌有很强的抑制作用,其中对植物病原菌尖孢镰刀菌的抑制作用最为显著,MIC 为1.56 μg/mL,其次是黑曲霉、米曲霉和青霉菌,MIC均为3.12 μg/mL。随着研究的深入,少数AMPs除具备较强的抗菌效果以外还表现出良好的抗肿瘤细胞、病毒和寄生虫的活性。如枯草芽孢杆菌产生的surfactin可抑制MCF-7(人乳腺癌细胞)、Hela(人宫颈癌细胞)和LoVo(人结肠癌细胞)的生长。同时surfactin还可以抑制伪狂犬病病毒(Pseudorabies virus)、猪细小病毒(Porcine parvovirus)、新城疫病毒(Newcastle diseasevirus)和传染性法氏囊病病毒(Infectious bursa virus)的复制增殖以产生抗病毒作用。放线菌分泌的硫肽类AMPs GE2270可以抑制疟原虫的生长,其IC50值为0.1 μmol/L。近年来AMPs因其优良的抗肿瘤特性逐渐被重视,更多科学家们便把精力投入到筛选具有良好抗肿瘤作用的新型AMPs的研究中,为实现AMPs在医学方面的研究和应用提供更多可能。本文重点围绕微生物源AMPs的抗肿瘤特性进行总结。
1 微生物AMPs抗肿瘤细胞特性的研究进展
根据微生物种类的不同,AMPs分为3大类:一是细菌源AMPs;二是放线菌源AMPs;三是真菌源AMPs。其中,细菌源AMPs的抗肿瘤研究最多,而在细菌源AMPs中,又以芽孢杆菌属AMPs的研究为主,乳酸菌属AMPs次之。
1.1 细菌源AMPs
细菌源AMPs是由细菌代谢合成的一类具有抑菌活性的多肽或前体多肽。研究发现,多种细菌源AMPs都能表现出一定的抗肿瘤作用(表1)。
1.1.1 来源于芽孢杆菌属的AMPs
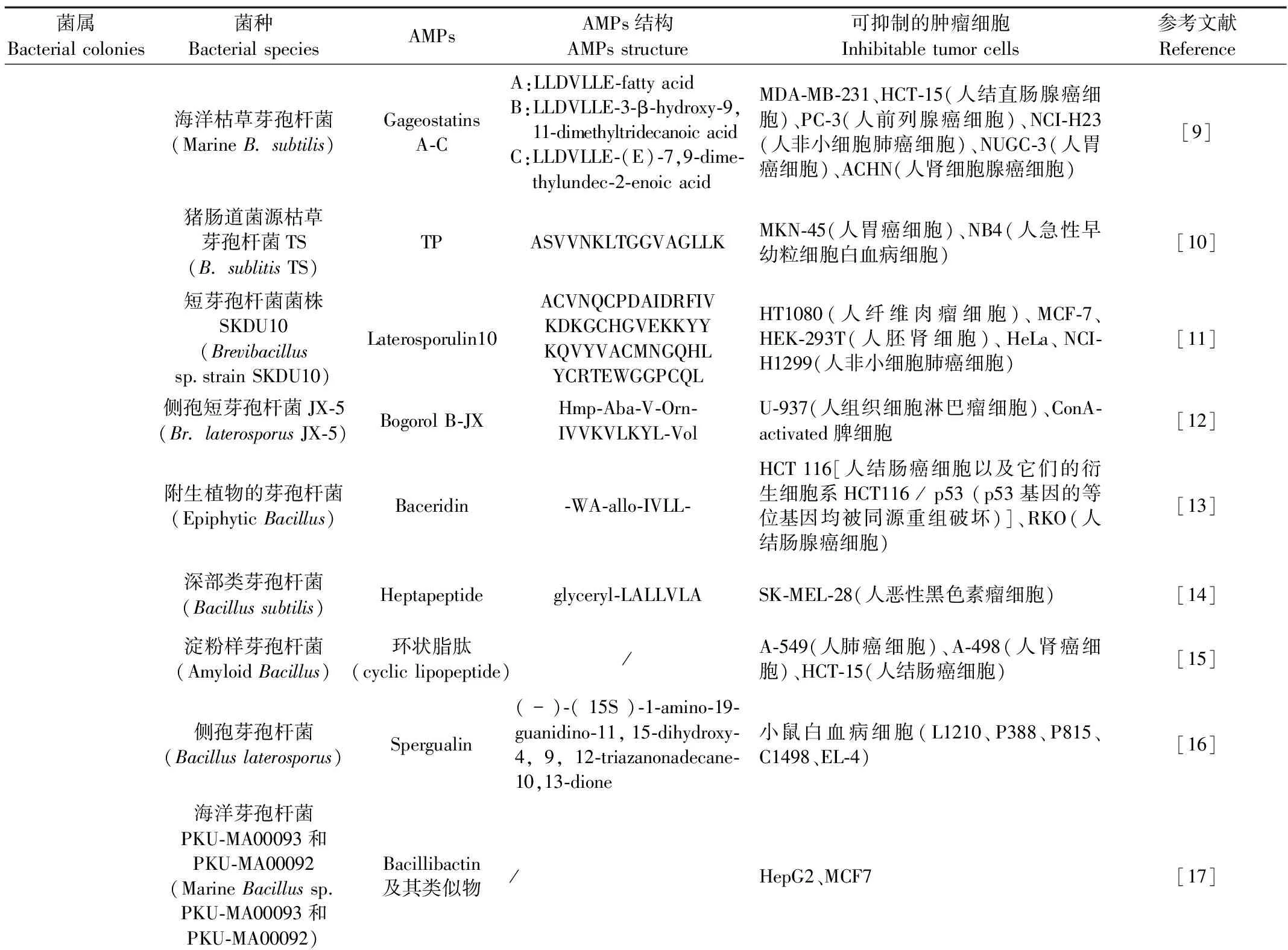
来源于芽孢杆菌属的AMPs主要包括:纳豆枯草芽孢杆菌TK-1产生的surfactin,纳豆枯草芽孢杆菌T-2产生的CLP,海洋枯草芽孢杆菌产生的Gageostatins A-C,藏猪肠道菌源性枯草芽孢杆菌TS产生的TP,短芽孢杆菌菌株SKDU10产生的Laterosporulin10(LS10),侧孢短芽孢杆菌 JX-5 产生的Bogorol B-JX(BBJX),附生植物的芽孢杆菌产生的Baceridin,“深部类芽孢杆菌”的海洋沉积物菌株SL79的培养物中分离出的Heptapeptide,结构类似于枯草芽孢杆菌产生的杆菌霉素D的由淀粉样芽孢杆菌fiply 3A产生的环状脂肽,侧孢芽孢杆菌产生的Spergualin(SGL),海洋芽孢杆菌PKU-MA00093和PKU-MA00092产生的Bacillibactin, 及其类似物以及本课题组前期获得由侧孢短芽孢杆菌S62-9产生的Brevilaterin。
以研究最广泛的surfactin为例。曹小红等[32]发现,surfactin对MCF-7、HepG2、LoVo、Raw264.7(小鼠单核巨噬细胞白血病细胞)和U-937(人组织细胞淋巴瘤细胞)有不同抑制作用,且surfactin还可诱导MCF-7和HepG2细胞发生胞质浓缩、核崩解等典型的凋亡形态学改变。此外,surfactin还可使MCF-7细胞的骨架发生剧烈变化。Kim等[6]发现surfactin还可通过阻断细胞周期来抑制LoVo细胞的增殖。这也说明同一AMPs对不同肿瘤细胞有不同的抑制作用。Park等[7]发现surfactin还可以抑制对苯二甲酸(TPA)诱导的人乳腺癌细胞MCF-7和 MDA-MB-231的侵袭、迁移。目前关于AMPs抑制肿瘤细胞的研究大都采用以上方法,但这些研究仍未指出明确的信号转导途径,未能定位到具体的作用位点,所以有待更深入研究。
本课题组前期获得一株侧孢短芽孢杆菌S62-9能高效分泌AMPs(Brevilaterin),Brevilaterin不仅对细菌和真菌均表现出广谱抑制作用,还对多种肿瘤细胞表现出一定的抑制作用,如它能选择性抑制人胃腺肿瘤细胞BGC-823的增殖(IC50为5~6 μg/mL),但对相应的人正常细胞(胃上皮细胞)的毒性却很小。后期研究发现,Brevilaterin在IC50为1~20 μg/mL范围内,对人表皮癌细胞A431等20株肿瘤细胞和人皮肤成纤维细胞HSF等10株人正常细胞有不同的抑制作用。研究还发现,Brevilaterin对A431细胞有较强的抑制作用,但同时又对HSF细胞有很小的毒性,这也为以后工作的开展奠定了基础。以上研究证实Brevilaterin能够选择性地抑制肿瘤细胞,但其抑制肿瘤细胞的机制尚不明确,这也是本实验室未来将要重点突破的工作之一。
1.1.2 来源于乳酸菌属的AMPs
来源于乳酸菌属的AMPs主要包括:乳酸链球菌产生的Nisin,植物乳杆菌C11产生的Plantaricin A(PlnA)和Plantaricin E(Pln E),乳酸片球菌PAC1.0产生的Pediocin PA-1,乳酸片球菌产生的Pediocin K2a2-3,乳酸片球菌MTCC 5101产生的Pediocin CP2,沙克乳酸杆菌GM3产生的GM3。
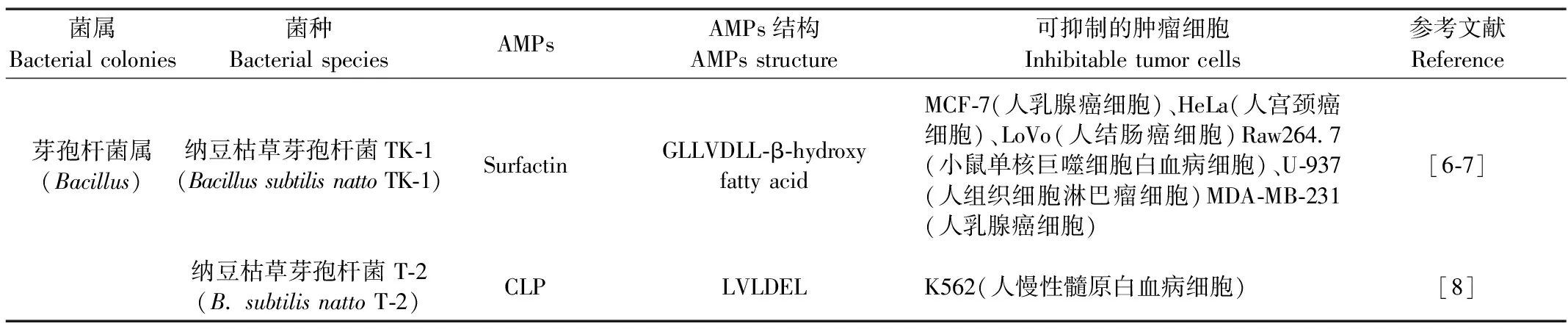
表1 细菌源AMPs的抗肿瘤研究信息
续表1(Continued Table 1)

续表1(Continued Table 1)
目前,Nisin是乳酸菌属来源的AMPs中研究最深入、应用最广泛的一种。如Nisin对MCF-7、HepG2、Vero(非洲绿猴肾细胞)、3种头颈鳞状癌细胞(UM-SCC-17B、UM-SCC-14A、HSC-3)、2种人结肠腺癌细胞(LS180、SW48)、HT29(人结肠癌细胞)和Caco2(人结直肠腺癌细胞)均有不同的抑制作用。当Nisin添加量高于IC50值时,MCF-7、HepG2、Vero的细胞质便会出现收缩和空泡化、细胞核收缩偏向一侧和细胞脱落等现象[33]。Nisin可通过改变钙内流和细胞周期,阻滞在G2期引起UM-SCC-17B、UM-SCC-14A、HSC-3细胞凋亡,且发现经Nisin处理后的细胞中的CHAC1基因(一种阳离子转运调节因子和凋亡调节因子)上调了4倍[18]。研究发现Nisin可通过下调CEA、CEAM6、MMP2F、MMP9F基因来抑制细胞转移。以头颈鳞状肿瘤小鼠为模型进行体内试验,发现Nisin处理后小鼠肿瘤体积明显下降[34-35]。而Begde等[36]发现Nisin对Jurkat、Molt-4和培养的人类淋巴细胞在IC50为225 μmol/L时并未观察到细胞凋亡现象,说明其对肿瘤细胞的作用具有选择性。Nisin目前主要被应用在食品加工等领域,但更多关于它能抑制肿瘤细胞的研究被报道也为其潜在的抗肿瘤及临床研究奠定基础。
1.1.3 来源于链球菌属的AMPs
来源于链球菌属的AMPs主要包括:肺炎链球菌产生的Pep27的类似物Pep27anal2,牛链球菌HC5产生的Bovicin HC5。
1.1.4 来源于其他细菌的AMPs
来源于其他细菌的AMPs主要包括:肺炎克雷伯杆菌KYC492产生的Microcin E492;绿脓杆菌42A产生的Pyocin S2;大肠杆菌产生的Colicins(A、E1、E3、U);耻垢分枝杆菌14468产生的Smegmatocin 14468和粪肠球菌T136产生的Enterocin-A及Enterocin-B。
综上所述,现已报道有抗肿瘤特性的细菌源AMPs主要来源于芽孢杆菌属,其次为乳酸菌属。它们的共同点是抑制肿瘤细胞的种类主要为人来源的肿瘤细胞,对不同的肿瘤细胞表现出一定的选择性,且都能使肿瘤细胞呈现出细胞皱缩等典型的凋亡现象。
1.2 放线菌源AMPs
放线菌源AMPs主要来源于链霉菌和微单胞菌,部分放线菌源AMPs也有一定的抗肿瘤作用。自1997年发现第一个由放线菌产生有抗肿瘤作用的AMPs——Thiocoraline以来,后来人们又陆续发现了SW-163C、SW-163E、chaxapeptin 1和Sungsanpin(1),但相比于细菌源AMPs,放线菌源AMPs的抗肿瘤研究发现较少且研究尚浅。
来源于链霉菌属的AMPs主要包括:链霉菌属(Streptomycesstrain SNJ013)产生的Sungsanpin(1);列文虎克链霉菌C58株(S.leeuwenhoekiistrain C58)产生的chaxapeptin 1;链霉菌属(Streptomycesstrain SNA15896)产生的SW-163C和E;来源于微单胞菌的AMPs为微单胞菌属(Micromonospora)产生的Thiocoraline。
1.3 真菌源AMPs
真菌源AMPs在微生物源AMPs中占比较小,主要以木霉属来源为主。Peptaibols类AMPs是一类由真菌合成的线性多肽分子,于1967年从绿色木霉(Trichodermaviride)培养物中分离得到。康宁霉素(Trichokonins,TKs)则是康宁木霉(Trichodermakoningii)的次生代谢产物,属于Peptaibols类抗菌肽。研究发现Peptaibols类AMPs还具有良好的抗肿瘤作用[37]。
TrichokoninⅥ是由康宁木霉SMF2株产生的AMPs之一。研究发现TrichokoninⅥ对A549、HepG2和BGC-823细胞有不同的抑制作用且细胞表现出不同的形态变化,且可使HepG2细胞进入一种caspase依赖性的新型paraptosis(副凋亡)程序性细胞死亡过程,其副凋亡作用主要表现在未见凋亡小体的形成,但胞内Ca2+浓度明显升高,相关凋亡蛋白和酶发生变化。TrichokoninⅥ诱导的细胞死亡具有paraptosis的一些特征,如:细胞大量死亡、线粒体破坏、以及胞质不均质化并伴有大量空泡的形成,不形成凋亡小体等典型的凋亡特征。同时,TrichokoninⅥ还可形成跨膜Ca2+通道,使胞内Ca2+浓度迅速升高。TrichokoninⅥ可使抗凋亡蛋白Bax-xl的表达水平下降,而caspase-9前体剪切为活性形式,同时,caspase下游底物PARP也被激活,且其对细胞的生长抑制作用可被caspase特异性抑制剂z-VAD-fmk所抑制[38]。
王红娜[39]发现TrichokoninⅥ不仅可使A549和HepG2细胞发生凋亡,还可诱导细胞发生自噬,并以A549细胞为对象研究其凋亡与自噬机制,结果发现其凋亡与自噬性死亡过程均不依赖于caspase活性,线粒体完整性在此过程中被破坏。在死亡过程中,A549细胞线粒体膜电位去极化,细胞内活性氧物质增多,抗凋亡蛋白Bcl-xl表达水平下降,促凋亡蛋白Bax表达水平上升。
AMPs抑制肿瘤细胞大都会启动caspase机制,但TrichokoninⅥ的研究发现其凋亡与自噬性死亡过程均不依赖于caspase活性,这也为以后的研究提供了新思路。
2 微生物源AMPs抗肿瘤机制的研究进展
随着学者们对AMPs抗肿瘤细胞研究的深入,人们对其抗肿瘤机制的认识也逐步提高,近年来研究重点延伸到AMPs抗肿瘤机制。AMPs抑杀肿瘤细胞的机制主要分为两种:一种是AMPs直接接触肿瘤细胞,破坏细胞膜、线粒体、核膜、细胞核染色体、细胞骨架和诱导细胞凋亡等以抑制或杀死肿瘤细胞;另一种是AMPs通过积极调动和增强机体的免疫系统来识别和杀伤肿瘤细胞[40]。此外,极少数AMPs还具有独特的抗肿瘤作用机制,如新型副凋亡程序性细胞死亡机制[41]。但参考目前国内外对抗肿瘤药物的研究经验,学者们也把AMPs抗肿瘤细胞机制的侧重点定位于诱导肿瘤细胞的凋亡。细胞凋亡是细胞在一定的生理或病理条件下,受多种基因精确调控的主动的、程序化的死亡过程,是机体重要的自稳调节机制[42]。近年来,大量研究证明,细胞凋亡通常是通过两个进化保守的信号转导途径实现的(表2):胞外途径为死亡受体途径;胞内途径为内质网途径和线粒体途径。

表2 微生物源AMPs诱导肿瘤细胞凋亡的途径
(1)死亡受体途径,指细胞膜表面的特定蛋白质能与携带凋亡信号的专一性配基结合,并将凋亡信号转导至细胞内从而诱导细胞凋亡。死亡信号的传导在此通路中依赖于死亡配体与受体的特异性结合以及受体死亡结构域与信号传导分子结合。其中死亡结构域是指死亡受体家族的胞内部分所含的约80个氨基酸残基组成的介导凋亡区域。该结构域可将胞外信号传递到胞内,进而引发凋亡。目前已知的死亡受体有8种,其信号转导途径主要有3条,分别为TNFR、TRAIL和Fas/FasL信号途径[46-47]。(2)内质网途径和线粒体途径。内质网途径是内质网对钙离子的调控,或是凋亡酶在内质网上激活死亡受体,进而诱导内质网钙离子的释放,从而使线粒体分裂,诱导产生凋亡,也有学者认为内质网途径是线粒体途径的补充。线粒体途径是目前研究最多的,线粒体在凋亡机制中承担着调控者的地位,其中Cyt C也起到了关键作用。研究发现,通过各种促凋亡刺激均可引起线粒体膜通透性转运孔的结构发生变化而开放,进而使线粒体膜的通透性增加,最终Cyt C和凋亡诱导因子等蛋白从线粒体释放到细胞质中。Cyt C自线粒体释放后,在ATP或dATP的共同作用下形成多聚复合物,从而启动caspase级联反应,最终引发细胞凋亡[46]。Surfactin、CLP、Brevilaterin、BBJX、Nisin ZP和Microcin E492均是通过线粒体途径诱导细胞凋亡。
3 结论与展望
综上所述,越来越多微生物源AMPs被发现有抗肿瘤细胞的作用,其中以细菌源AMPs研究最多,放线菌源和真菌源AMPs的研究较少;细菌源AMPs 中以芽孢杆菌源AMPs研究较多且抗肿瘤效果较好。不同微生物源AMPs可抑制肿瘤细胞的种类及能力各不相同,它们可抑制人源肿瘤细胞、动物源肿瘤细胞和病毒转染的正常细胞。其中,研究较多且较深入的是对人源肿瘤细胞的抗性研究,如对发病率较高的胃癌细胞、乳腺癌细胞、宫颈癌细胞、肝癌细胞和肺癌细胞等,这也是本课题组研究选用人源肿瘤细胞的依据。微生物源AMPs独特的抗肿瘤机制以及在细胞选择性和耐药性方面的优势,使其在抗肿瘤方面有良好的应用前景。随着各种新技术不断涌现以及AMPs理论和应用研究不断深入,AMPs有望在肿瘤治疗中发挥重要作用。

图1 微生物源AMPs常见抗肿瘤机理[48]Figure 1 Common anti-tumor mechanism of microbial AMPs[48]
虽然微生物源AMPs在抗肿瘤研究方面凸显出很多优势,但其要从实验研究走向实际应用还需解决很多问题。(1)现有AMPs抗肿瘤细胞的效果并不理想,还需要继续寻找抑制效果更好的AMPs,而且真菌和放线菌源AMPs的研究较少,可根据已有真菌和放线菌源AMPs的筛选方法继续寻找更多AMPs新资源。(2)迄今为止,研究发现的抗菌肽诱导细胞凋亡的常见机理(图1),但诱导细胞凋亡的许多机理仍未被研究透彻,如细胞凋亡调控相关基因的定位、凋亡精确的生化机制及其不同的信号转导途径的调控等都需要进一步探索。(3)目前AMPs抗肿瘤细胞的研究大多集中体外研究,而体内和临床的尝试还很少,且其药效、药理及对人体的影响也不清楚,可以针对部分抗肿瘤效果良好的AMPs资源作出进一步临床研究。

