基于“肠道菌群-黏膜屏障”探讨芪箭消瘿方对自身免疫性甲状腺炎大鼠的作用机制研究❋
牧亚峰, 左新河, 向 楠, 赵 勇, 华 川2,, 陈继东2,
(1.河南中医药大学第一附属医院, 郑州 450000;2.湖北中医药大学, 武汉 430065;3.湖北省中医院, 武汉 430074)
自身免疫性甲状腺炎(autoimmune thyroiditis,AIT)是最常见的自身免疫性甲状腺疾病,细胞和抗体介导的慢性免疫性炎症是甲状腺组织破坏的主要原因之一[1]。20%~30%患者最终会发展为甲状腺功能减退症[2],有研究报道AIT还是甲状腺癌的危险因素[3]。AIT的病因与发病机制至今尚未完全阐明,但其发病是遗传、环境、免疫等多因素共同作用的结果[4]。肠道是人体重要的器官,而肠黏膜屏障作为第一道防线在机体免疫系统中扮演着重要角色。目前,已知自身免疫性肝炎、糖尿病、炎症性肠病、慢性肾脏病等疾病存在肠黏膜屏障损伤,损伤的原因涉及细胞因子、肠道菌群、肠道免疫功能等多个方面[5]。然而有关AIT的肠道研究较少,仅有极少量文献报道了肠道菌群与桥本甲状腺炎的关系[6],尚没有药物对AIT肠道菌群及肠黏膜屏障作用的研究。前期研究表明,芪箭消瘿方能够降低AIT动物模型甲状腺球蛋白抗体(thyroglobulin antibodies,TGAb)、甲状腺过氧化物酶抗体(thyroid peroxidase antibodies,TPOAb)水平,减轻甲状腺组织淋巴细胞浸润[7]。本研究采用AIT大鼠模型,以肠道为切入点,探讨芪箭消瘿方对AIT大鼠肠道菌群及肠黏膜屏障的影响,为临床应用提供新的思路与参考。本研究通过湖北中医药大学实验动物中心动物伦理委员会批准(批号HUCMS201909008)。
1 材料
1.1 动物
SPF级雌性SD大鼠48只,体质量(110±10)g,购于三峡大学,实验动物许可证号SCXK(鄂)2017-0012。大鼠饲养于湖北中医药大学实验动物中心,室温(23±2)℃,相对湿度(55±10)%,光照12 h/d,自由摄食和饮水。
1.2 药物
芪箭消瘿方组成:黄芪30 g,白芍15 g,鬼箭羽15 g,穿山龙15 g。黄芪(1.5 g/袋,相当于饮片10 g,批号19071401),白芍(1 g/袋,相当于饮片10 g,批号19050921),鬼箭羽(0.5 g/袋,相当于饮片10 g,批号18041891),穿山龙(1.67 g/袋,相当于饮片10 g,批号19018041),江阴天江药业有限公司,购自湖北省中医院中药配方颗粒药房。硒酵母片(西维尔,规格50 μg/片),牡丹江灵泰药业有限公司,批号H10940161。
1.3 试剂与仪器
猪甲状腺球蛋白(货号180801)、完全弗氏佐剂(货号F5881)、不完全弗氏佐剂(货号F5506)、碘化钠(货号383112)(美国Sigma公司);游离三碘甲状腺原氨酸(free triiodothyronine,FT3)试剂盒(货号0079c)、游离甲状腺素(free thyroxine,FT4)试剂盒(货号0122c)、γ干扰素(interferon-γ,IFN-γ)试剂盒(货号R0009c)、白细胞介素(interleukin,IL)-10试剂盒(货号R0016c)及分泌型免疫球蛋白(secretory immunoglobulin,sIg)A试剂盒(武汉伊莱瑞特生物公司,货号R0875c);甲状腺过氧化物酶抗体(thyroid peroxidase antibodies,TPOAb)试剂盒(武汉华美生物工程有限公司,货号E11199r);甲状腺球蛋白抗体(thyroglobulin antibodies,TGAb)试剂盒(南京森贝伽生物科技有限公司,货号R0551);闭锁连接蛋白-1(zonula occludens-1,ZO-1)抗体(Abclonal,货号A0659)、闭合蛋白(Occludin)抗体(武汉三鹰生物技术有限公司,货号13409-1-AP);β-actin抗体(武汉博士德生物工程有限公司,货号BM0627);DNA提取试剂盒(Omega,货号D3450);DNA聚合酶(TransGen,货号AP231-01);DNA凝胶回收试剂盒(Axygen,货号AP-GX-50)。
离心机(湘仪离心机仪器有限公司,型号H1650-W);多功能酶标仪(美国MD公司,型号Flexstation3);轮转式切片机(德国Leica公司,型号RM2016);垂直电泳槽、电转仪(北京六一仪器厂,型号DYCZ-24DN、DYCZ-40);生物显微镜(日本Olympus公司,型号BX53);透射电镜(日本HITACHI公司,型号HT7700-SS);分光光度计(美国赛默飞公司,型号NanoDrop2000);PCR仪(美国ABI公司,型号QuantStudio 6);测序仪(美国Illumina公司,型号Miseq PE300)。
2 方法
2.1 分组、造模及给药
48只雌性SD大鼠随机分为对照组、模型组、硒酵母组及芪箭消瘿方低、中、高剂量组6组各8只。参照文献报道的方法,采用猪甲状腺球蛋白与弗氏佐剂皮下免疫注射联合高碘水喂养制备AIT大鼠模型[8]。依据人与大鼠等效剂量折算系数确定给药剂量,硒酵母组给药剂量为36 μg/kg(临床等效剂量),芪箭消瘿方低、中、高剂量组给药剂量分别为1.8、3.6、7.2 g/kg(分别为临床等效剂量的1、2、4倍),对照组和模型组以等体积0.9%氯化钠溶液灌胃。供试药液的制备:按组方比例取黄芪、白芍、鬼箭羽、穿山龙配方颗粒,用100 ℃ 0.9%氯化钠溶液充分溶解,分别制成质量浓度为2.4、1.2、0.6 g/mL的溶液;取适量硒酵母片置于研钵中研磨至极细粉末,加入0.9%氯化钠溶液充分溶解,配制成质量浓度为3.6 μg/mL的混悬液。以上药液均分装并保存于4 ℃冰箱中备用。
2.2 样本收集与处理
实验取材前1 d,每组随机选取5只大鼠,采用应激性排便法收集大鼠粪便样品,肛周消毒后固定并将大鼠尾部提起,手指按压下腹部促其排便,收集新鲜粪便2~3颗于灭菌冻存管中,-80 ℃保存;禁食12 h,10%水合氯醛麻醉后暴露胸腔,心脏采血收集于真空采血管,取上清分装于EP管中,-80 ℃保存;暴露颈部剪下附有甲状腺的气管段,冰上分离出甲状腺,置于4%多聚甲醛中固定;暴露腹腔剪下结肠,4 ℃ 0.9%氯化钠溶液冲洗肠腔,擦干后剪取部分结肠置于4%多聚甲醛及2.5%戊二醛中固定,另将剩余结肠置于冻存管中,-80 ℃保存。
2.3 HE染色观察甲状腺及结肠组织形态学变化
将经4%多聚甲醛固定好的甲状腺及结肠组织取出,梯度酒精脱水,二甲苯透明,常规石蜡包埋、切片,经脱蜡、清洗后行HE染色,显微镜下观察组织形态学变化。参照文献制定的甲状腺炎症评分标准打分[9]。0分:无淋巴细胞浸润;1分:2个或3个甲状腺滤泡之间的间质可见淋巴细胞浸润;2分:1个或2个甲状腺滤泡大小的浸润灶;3分:广泛浸润面积达10%~39%;4分:广泛浸润面积达40%~80%;5分:广泛浸润面积达80%以上。
2.4 透射电镜观察结肠上皮超微结构
取出2.5%戊二醛固定好的结肠组织,加入PBS缓冲液反复冲洗,1%锇酸室温固定2 h,梯度酒精脱水,将丙酮与环氧树脂包埋剂按1∶1混合渗透过夜、包埋,70 nm超薄切片,铀铅双染色。透射电镜下观察结肠组织紧密连接、上皮微绒毛等超微结构。
2.5 ELISA检测血清FT3、FT4、TGAb、TPOAb、IFN-γ、IL-10及结肠sIgA的含量
血清自然解冻,按照试剂盒说明书测定血清FT3、FT4、TGAb、TPOAb、IFN-γ、IL-10含量。取结肠组织称重并剪碎,将其与PBS缓冲液(按1∶9的重量体积比)加入组织研磨器中,充分冰浴研磨得匀浆液,取上清液,同法检测结肠sIgA含量。
2.6 Western blot检测结肠ZO-1、Occludin蛋白
向剪碎的结肠组织中加入磷酸酶抑制剂裂解,匀浆后取上清,BCA测定蛋白浓度。蛋白上样后经10%SDS-PAGE凝胶电泳并分离转膜,TBST封闭2 h后加入稀释的一抗(1∶1000),4 ℃孵育过夜,洗膜后加入稀释的二抗(1∶50000),37 ℃孵育2 h,ECL显影曝光,扫描胶片,BandScan软件分析条带灰度值。
2.7 粪便菌群DNA提取及测序
按照DNA提取试剂盒说明书对各组大鼠粪便样品进行DNA抽提。1%琼脂糖凝胶电泳检测DNA提取质量,NanoDrop2000测定DNA浓度和纯度。使用扩增引物338F(5’-ACTCCTACGGGAGGCA GCAG-3’)和806R(5’-GGACTACHVGGGTWTCT AAT-3’)对16 S rRNA V3~V4可变区进行PCR扩增,扩增程序如下:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),然后72 ℃稳定延伸10 min,最后4 ℃保存。扩增结果用2%琼脂糖凝胶回收,利用DNA凝胶试剂盒对回收产物纯化,2%琼脂糖凝胶电泳检测,并对回收产物进行检测定量。使用NEXTFLEX Rapid DNA-Seq Kit建库,利用MiSeq PE300平台进行高通量测序。最后,基于生物信息云平台对OTUs进行不同水平(门、属)物种注释。根据聚类结果,对粪便菌群进行物种多样性(α多样性、β多样性)及物种分类学组成分析。
2.8 统计学方法
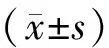
3 结果
3.1 甲状腺组织HE染色结果
图1示,炎症评分结果显示,对照组为0分,模型组评分较其明显增高(P<0.01),与模型组比较,各药物组评分显著降低(P<0.01)。甲状腺HE染色结果显示,对照组甲状腺滤泡结构完整,形态规则,呈类圆形或多边形,滤泡上皮细胞呈单层立方形,排列整齐,滤泡腔内充满胶质,滤泡间隙未见淋巴细胞浸润;模型组滤泡上皮细胞呈扁平状,大部分滤泡结构破坏萎缩,可见弥漫性淋巴细胞浸润;硒酵母组滤泡上皮细胞排列尚整齐,滤泡腔萎缩,胶质含量减少,可见吸收空泡;芪箭消瘿方各剂量组滤泡结构完整性改善,淋巴细胞浸润明显减少,病变程度减轻。
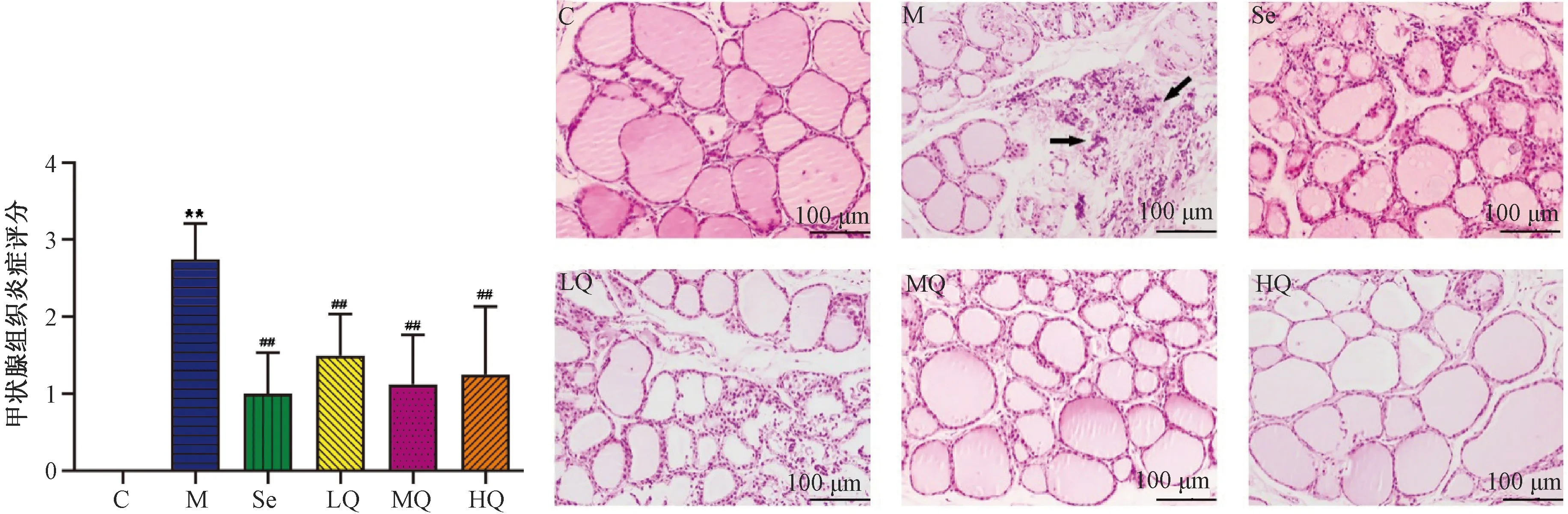
3.2 结肠组织HE染色及超微病理变化
图2示,结肠HE染色结果显示,对照组结肠黏膜完整,上皮细胞排列整齐,黏膜隐窝平行排列,杯状细胞丰富,无淋巴细胞浸润;与对照组比较,模型组结肠黏膜上皮部分断裂且不完整,黏膜隐窝形态扭曲,伴有淋巴细胞浸润;与模型组比较,芪箭消瘿方低剂量组、芪箭消瘿方中剂量组、芪箭消瘿方高剂量组及硒酵母组结肠黏膜完整性有所恢复,淋巴细胞浸润明显减少。
注:C.对照组;M.模型组;Se.硒酵母组;LQ.芪箭消瘿方低剂量组;MQ.芪箭消瘿方中剂量组;HQ.芪箭消瘿方高剂量组;与对照组比较:**P<0.01;与模型组比较:##P<0.01;箭头指淋巴细胞聚集图1 各组大鼠甲状腺组织HE染色及炎症评分结果比较(×100)
注:C.对照组;M.模型组;Se.硒酵母组;LQ.芪箭消瘿方低剂量组;MQ.芪箭消瘿方中剂量组;HQ.芪箭消瘿方高剂量组图2 各组大鼠结肠组织HE染色结果比较(×100)
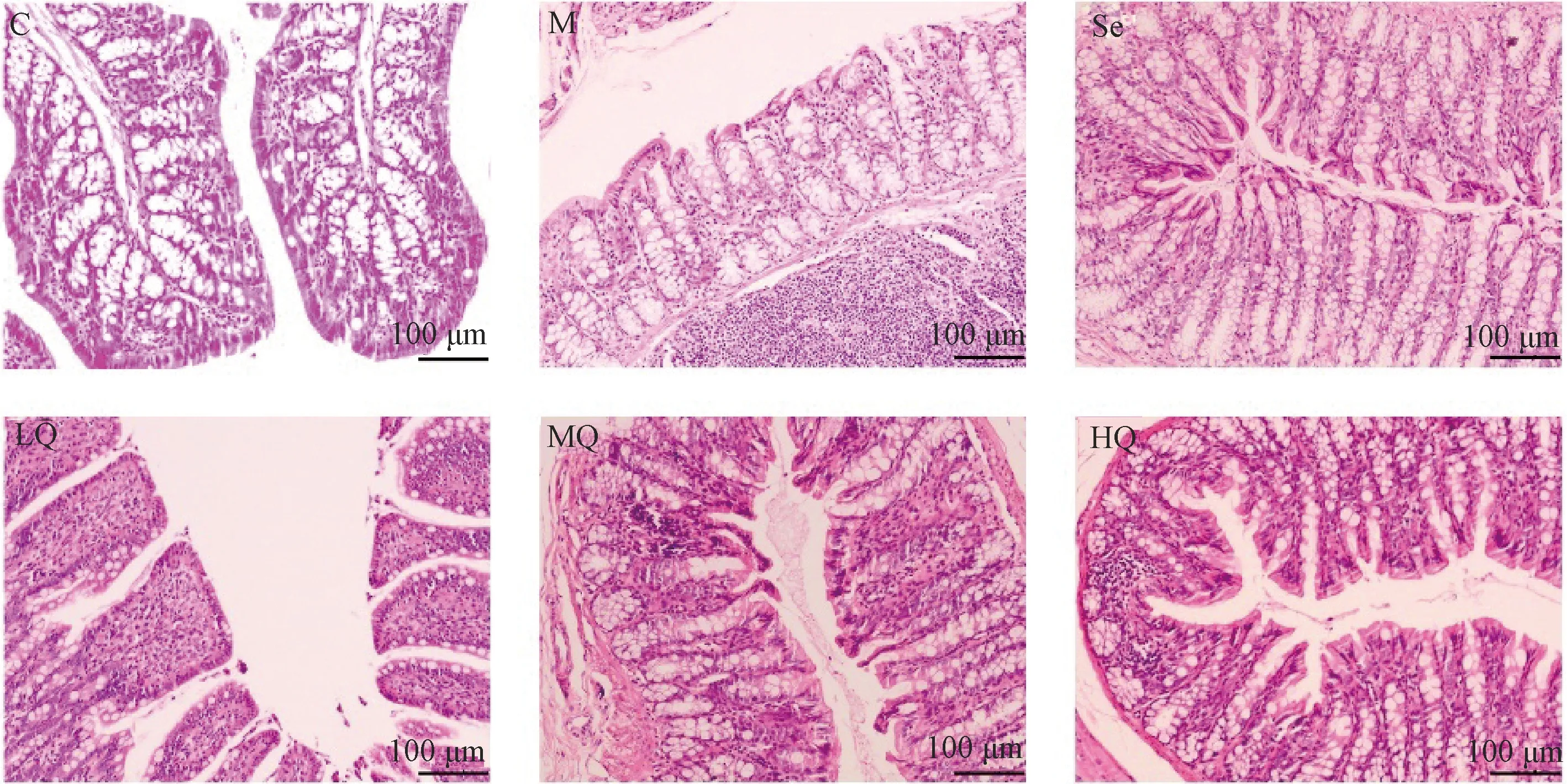
图3示,结肠黏膜超微病理显示,对照组可见细胞间紧密连接结构完整,连接致密、连续,桥粒密度较高,上皮细胞表面微绒毛正常。与对照组比较,模型组细胞间紧密连接出现部分断裂,连接开放、疏松,桥粒密度下降,微绒毛数量减少且排列较紊乱。经芪箭消瘿方低、中、高剂量及硒酵母干预后,细胞间紧密连接连续性均有不同程度恢复,连接更加紧密,肠上皮微绒毛数量增加,排列较模型组整齐。
注:C.对照组;M.模型组;Se.硒酵母组;LQ.芪箭消瘿方低剂量组;MQ.芪箭消瘿方中剂量组;HQ.芪箭消瘿方高剂量组(“*”所指为桥粒,“→”指紧密连接断裂处)图3 各组大鼠结肠黏膜超微病理结果比较(铀铅双染色×12000)
3.3 血清FT3、FT4、TGAb、TPOAb、IFN-γ、IL-10结果
表1示,与对照组比较,模型组FT3、FT4、TGAb、TPOAb、IFN-γ水平显著升高(P<0.01),IL-10水平明显下降(P<0.01);与模型组比较,硒酵母组及芪箭消瘿方低、中、高剂量组FT3、FT4、TGAb、TPOAb、IFN-γ水平明显下降(P<0.05,P<0.01),IL-10水平明显上升(P<0.01)。
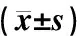
表1 各组大鼠血清ELISA检测结果
3.4 结肠ZO-1、Occludin蛋白及sIgA表达结果
图4A、4B、4C示,与对照组比较,模型组ZO-1、Occludin蛋白表达明显下降(P<0.01);与模型组比较,硒酵母组及芪箭消瘿方低、中、高剂量组ZO-1、Occludin蛋白表达显著升高(P<0.01)。图4D示,与对照组比较,模型组sIgA水平显著降低(P<0.01);与模型组比较,硒酵母组及芪箭消瘿方低、中、高剂量组sIgA水平显著升高(P<0.05,P<0.01)。
注:C.对照组;M.模型组;Se.硒酵母组;LQ.芪箭消瘿方低剂量组;MQ.芪箭消瘿方中剂量组;HQ.芪箭消瘿方高剂量组;闭锁连接蛋白(zonula occludens,ZO)-1,闭合蛋白(Occludin),分泌型免疫球蛋白(secretory immunoglobulin,sIg)A;与对照组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01图4 各组大鼠结肠ZO-1、Occludin蛋白及sIgA表达比较
3.5 肠道菌群的变化
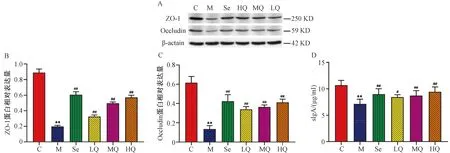
3.5.1 物种多样性分析 本研究共得到2020932条有效序列。表2示,各组Shannon、Simpson、chao、ace指数比较差异无统计学意义(P>0.05)。图5A示,当OTUs水平逐渐增加时曲线趋于直线,大部分样本所含OTUs在400~600之间,表明肠道微生物丰富度较高且分布较均匀。图5B示,当Shannon指数达到3.7时,各样本稀释曲线趋向平坦,表明测序数据足够大,能够反映样本中绝大多数的微生物多样性信息。图5C韦恩图显示,6组共有728个重叠的OTUs,对照组、模型组、硒酵母组及芪箭消瘿方低、中、高剂量组分别独有18、13、16、10、7、8个OTUs。图5 D PCoA图示,对照组和模型组在PC1水平上呈明显分开,表明AIT大鼠肠道菌群组成结构较对照组有改变且差异有统计学意义。而给药后硒酵母组及芪箭消瘿方低、中、高剂量组在PC1水平上偏离模型组的距离逐渐增大,说明给药后大鼠肠道菌群组成结构发生显著变化。
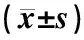
表2 各组大鼠α多样性指数结果比较
3.5.2 门水平群落结构组成分析 在门水平(Phylum)上,各组大鼠肠道菌群包括厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、柔膜菌门(Tenericutes)、放线菌门(Actinobacteria)等主要门类。对照组大鼠肠道菌群中厚壁菌门、拟杆菌门、变形菌门为优势菌门。与对照组比较,模型组厚壁菌门比例明显升高(P<0.01),拟杆菌门下降(P<0.01),厚壁菌门与拟杆菌门比值(Firmicutes/Bacteroidetes,F/B)上升(P<0.01)。与模型组比较,硒酵母组及芪箭消瘿方低、中、高剂量组厚壁菌门比例显著下降(P<0.05),拟杆菌门比例上升(P<0.05),F/B值降低(P<0.01)(见表3图6A)。
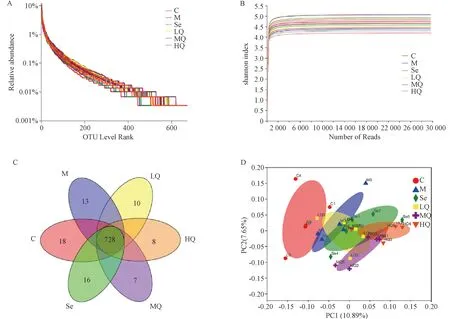
注:A.Rank-Abundance曲线;B.稀释曲线;C.韦恩图;D.PCoA图;C.对照组;M.模型组;Se.硒酵母组;LQ.芪箭消瘿方低剂量组;MQ.芪箭消瘿方中剂量组;HQ.芪箭消瘿方高剂量组。图5 OTUs曲线及β多样性分析比较
3.5.3 属水平群落结构组成分析 在属水平(Genus)上,各组大鼠肠道菌群主要包括Muribaculaceae、瘤胃球菌属Ruminococcaceae、毛螺菌属Lachnospiraceae、乳酸杆菌属Lactobacillus、拟杆菌属Bacteroides、克里斯滕森菌属Christensenellaceae、普雷沃氏菌属Prevotellaceae、罗姆布茨菌Romboutsia等,其中乳酸杆菌属与普雷沃氏菌属组间变化显著。与对照组比较,模型组乳酸杆菌属和普雷沃氏菌属丰度明显下降(P<0.01)。与模型组比较,硒酵母组及芪箭消瘿方低、中剂量组乳酸杆菌属丰度呈不同程度回升(P<0.05),高剂量组乳酸杆菌属丰度呈下降趋势(P>0.05);而在普雷沃氏菌丰度水平方面,与模型组比较,硒酵母组及芪箭消瘿方中、高剂量组呈下降趋势(P>0.05),芪箭消瘿方低剂量组成上升趋势(P>0.05)(见表3图6B)。
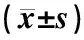
表3 各组大鼠门水平与属水平肠道菌群变化比较
4 讨论
AIT是典型的进行性自身免疫性疾病,近年来发病率日趋升高。由于发病机制不明,临床表现不典型,部分患者在未诊断时可能已发展为甲状腺功能减退症。目前现代医学治疗手段多为激素、硒制剂或随访观察,尚不能完全根治。中医药在调节甲状腺抗体水平的同时,还能降低西药毒副作用以及兼顾乏力、便秘等临床症状,具有显著的疗效优势。AIT属于中医学“瘿病”范畴,多由正气不足、痰浊瘀血结于颈前所致。临床辨证以此证为主者,当以益气扶正、化痰活血法治疗。芪箭消瘿方正是以“扶正祛邪”为大法,重用甘温之黄芪以益气扶正,白芍柔肝敛阴,佐以鬼箭羽活血通络,穿山龙活血之余兼能化痰,全方共达益气养阴、化痰活血之功。本研究大鼠造模后甲状腺抗体水平升高,甲状腺滤泡结构破坏且炎症评分增高,表明成功诱导出AIT动物模型。硒酵母广泛应用于AIT的临床治疗,加之其良好的药物安全性及有效性,故将硒酵母作为本实验的阳性对照药。

注:C.对照组;M.模型组;Se.硒酵母组;LQ.芪箭消瘿方低剂量组;MQ.芪箭消瘿方中剂量组;HQ.芪箭消瘿方高剂量组图6 门水平(A)与属水平(B)肠道菌群变化比较
肠道菌群与人类共存,研究发现1型糖尿病、炎症性肠病、系统性红斑狼疮、类风湿关节炎、多发性硬化症等自身免疫性疾病与肠道菌群存在关联[10]。厚壁菌及拟杆菌是哺乳动物的优势菌群[11],而F/B与某些病理状态相关,是肠道菌群健康的重要指标[12]。本研究显示,AIT大鼠肠道厚壁菌门和拟杆菌门相对丰度变化,F/B上升,表明AIT大鼠肠道菌门物种比例失调,菌群呈紊乱态势。该研究结果与Ishaq[13]所报道的一致。经芪箭消瘿方干预后,F/B下调,菌门物种比例失调得以纠正。同时发现,AIT大鼠肠道乳酸杆菌及普雷沃氏菌相对丰度下降,这与AIT患者肠道菌群分析的结果相同[14]。乳酸杆菌是益生菌的重要来源,能够通过分泌乳酸、过氧化氢、细菌素等物质降低肠道pH,具有杀菌或抑制病原菌黏附感染的作用[15]。研究表明,乳酸杆菌参与调节sIgA的分泌[16]。普雷沃氏菌具有定殖性和低致病性,在哮喘、慢性阻塞性肺疾病中明显减少[17],能够利用富含纤维的碳水化合物生产短链脂肪酸,发挥抗炎作用[18]。低、中剂量芪箭消瘿方给药后,乳酸杆菌相对丰度上升,而高剂量组反应不敏感。低剂量组普雷沃氏菌相对丰度有回升趋势,而中、高剂量组则呈下降趋势,这可能与方剂中药物成分浓度增加、抑菌作用药物成分占主导地位有关。肠道菌群具有多种功能,可影响其生长和定殖能力,同时能够对宿主产生下游效应,这种效应可能有益亦可能有害[19]。某些肠道菌群能够生产机体所没有的特定酶,将碳水化合物等营养物质发酵成短链脂肪酸[20,21]。短链脂肪酸具有抗炎、调节免疫的作用,同时还能够维持肠上皮完整性、生产维生素、免疫系统信号分子与细胞交互以及激活和抑制特异性反应[22]。研究发现,乳酸杆菌可有效维持肠道上皮的再生和体内稳态,进而修复病理损伤后的肠黏膜[23]。然而部分肠道菌群可突破肠黏膜屏障与免疫系统接触,进而引起炎症[24]。
肠黏膜屏障是抵抗有害病原体的第一道防线[25],紧密连接是维持肠黏膜机械屏障功能完整的重要结构[26]。紧密连接蛋白主要包括以Occludin为代表的跨膜蛋白和以ZO-1为代表的胞浆蛋白,前者胞间两两相连形成吻合结构而封闭细胞间隙,后者与前者相互连接,使紧密连接形成网状结构而更加稳定[27]。sIgA是肠黏膜免疫屏障的重要组成部分,与体液及细胞免疫共同发挥局部免疫功能[28],具有增强肠道免疫、阻止条件致病菌增殖及病原菌入侵、恢复肠道微生态平衡的作用[29]。IL-10在炎症过程中可引起多种宿主防御机制,尤其是上皮细胞的防御机制,其本身具有抑制炎症反应并限制炎症所导致的组织破坏作用[30]。本研究结果显示,AIT大鼠结肠sIgA、ZO-1蛋白、Occludin蛋白表达明显下降,结肠黏膜上皮部分损伤伴紧密连接完整性受损,肠黏膜屏障功能失常并伴有损伤。经芪箭消瘿方干预后,sIgA、ZO-1蛋白、Occludin蛋白表达上调,结肠黏膜病理形态及紧密连接结构有不同程度恢复,说明肠黏膜屏障功能损伤得到修复。同时,肠道菌群的组成受到黏膜免疫系统的监视,细胞间紧密连接功能强弱又可通过影响肠黏膜通透性决定菌群抗原是否暴露,肠道菌群、紧密连接、肠黏膜免疫屏障之间的相互协调作用有助于维持肠道稳态[31]。
综上所述,芪箭消瘿方能够降低AIT大鼠甲状腺功能、甲状腺抗体及炎症因子水平,改善甲状腺组织炎症浸润及炎症评分,减轻结肠黏膜病理损伤,其作用机制可能与调节肠道菌群生物多样性及物种组成有关,进而增加结肠紧密连接蛋白及sIgA表达,改善肠黏膜屏障损伤而起到治疗作用。

