海假交替单胞菌(Pseudoalteromonas marina)pilZ基因缺失抑制厚壳贻贝附着变态
张驰 ,王劲松 ,杨金龙 , ,张俊波 ,万荣 , ,梁箫 *
( 1. 上海海洋大学 国家海洋生物科学国际联合研究中心,上海 201306;2. 上海市水产动物良种创制与绿色养殖协同创新中心,上海 201306;3. 南方海洋科学与工程广东省实验室(广州),广东 广州 511458;4. 上海海洋大学 海洋科学学院,上海201306;5. 国家远洋渔业工程技术研究中心,上海 201306;6. 国家远洋渔业工程技术研究中心舟山分中心,浙江 舟山316014)
1 引言
附着变态是厚壳贻贝(Mytilus coruscus)等海洋无脊椎动物幼虫生长发育过程中必经的重要阶段,一般受到自然环境中所存在的化学因子和动物自身的内源性因子所调控[1]。其中,生物被膜(Biofilm,BF)作为重要的化学诱因被广泛研究。生物被膜是细菌在成长过程中为应对环境变化而呈现出的一种不同于游离生长形式的菌体,其为聚集黏附于基质表面的被膜状生物群体[2]。环二鸟苷单磷酸(cyclic di-GMP或c-di-GMP)是细菌胞内普遍存在的一种重要的第二信使,可以通过结合多种不同类型的效应蛋白来调控细菌的诸多生物功能和行为,同时其胞内水平的变化会影响细菌生物被膜的形成[3]。在生物被膜形成的复杂过程中,细菌需要感知、转导、传递来自细胞内外的化学信号,将多糖、蛋白、脂类等物质分泌到胞外形成 胞 外 产 物(Extracellular Polymeric Substances, EPS)包裹菌体。
海假交替单胞菌(Pseudoalteromonas marina),一株分离自海洋环境中所形成的生物被膜上的革兰氏阴性菌,其自身形成的生物被膜及其分泌的多种具有生物学活性的胞外产物均能诱导厚壳贻贝幼虫的附着变态[4-8]。例如,Peng等[5]在对P. marinaorf01912基因敲除后发现,细菌胞内c-di-GMP水平显著增加,同时使生物被膜上可拉酸(Colanic Acid, CA)含量增多,从而促进了厚壳贻贝幼虫的附着变态;同年,研究发现,当P. marina中fliP基因缺失后,突变菌形成的生物被膜诱导厚壳贻贝附着变态的能力显著降低,而从野生菌中提取的鞭毛蛋白可以提高幼虫的附着变态率[6];此外,研究表明,P. marina野生菌提取的鞭毛蛋白能够促进生物被膜上胞外产物的产生[8];近期研究发现,P. marina中tesA基因缺失会导致胞内c-di-GMP水平升高,同时导致生物被膜中脂肪酸含量下降,从而抑制了厚壳贻贝幼虫的附着变态[7]。以上研究表明,海假交替单胞菌中某一基因的缺失会影响细菌胞内c-di-GMP水平的变化,改变生物被膜胞外产物的含量,从而间接调控厚壳贻贝幼虫的附着变态。
c-di-GMP已被证实的胞内效应蛋白或受体包括PilZ结构域蛋白、转录因子、退化的GGDEF、EAL或HD-GYP结构域蛋白、AAA ATPase结构域蛋白以及RNA核糖开关等[9-10]。PilZ结构域蛋白作为典型的cdi-GMP结合蛋白近年来被广泛研究,两者结合可调控细菌的运动性[11-12]、毒性[13]以及纤维素、藻酸盐[14-15]等胞外多糖的合成和生物被膜形成[16]。但值得注意的是,并不是所有的PilZ结构域蛋白都具有与c-di-GMP结合的能力,有些PilZ结构域蛋白通过与具有GGDEF和EAL结构域的蛋白相互作用,参与到c-di-GMP调控某些生物因子如IV型菌毛(Type IV pili,T4P)的生物合成信号通路中[17]。
本研究通过P. marina基因组数据[18]筛选出同时被注释为“PilZ结构域蛋白基因”和“IV型菌毛生物合成基因”的pilZ基因,并利用同源重组的方法构建了P. marinapilZ基因的缺失菌。通过比较野生菌与pilZ基因缺失菌的菌落表型、运动性、形成生物被膜的能力及其生物被膜对厚壳贻贝幼虫附着变态的影响,为解析P. marina生物被膜的形成机制、生物被膜与厚壳贻贝附着变态的互作关系提供理论依据。
2 材料与方法
2.1 材料
厚壳贻贝眼点期幼虫均取自浙江省舟山市嵊泗县(30°73′N,122°44′E),幼虫在实验室条件下暂养1周后进行试验。暂养在盐度为30,经孔径为0.45 μm的滤膜(Whatman)过滤后的自然海水中,每隔2 d更换2/3水体,每日按时投喂1次湛江等鞭金藻(5×104cells/mL),放置于18℃暗室内充气培养。
文章所用菌株和质粒详见表1。实验使用的细菌菌株为P. marinaECSMB14103(保藏号:MCCC1K03511),其从形成于浙江省舟山市枸杞岛海域(30°73′N,122°77′E)0.5~1.0 m水深的自然生物被膜上分离出来。P. marina野生菌和突变菌均在25℃条件下,于Zobell 2216E培养基(5‰蛋白胨、0.01‰柠檬酸铁、1‰酵母提取物和15‰琼脂)中进行培养,配制Zobell 2216E培养基的试剂均购买于Sigma公司。本文用到的Escherichia coliWM3064和pK18mobsacB-ery由中国科学院南海海洋研究所王晓雪研究员实验室课题组馈赠,E.coliWM3064菌株于37℃下在含有0.3 mmol/L DAP(2,6-diamino-pimelic acid)(Sigma)的LB(Luria-Bertani)(Sangon)培养基上培养。在培养含有pK18mobsacB-ery质粒的菌株时,应加入终浓度为50 μg/mL的卡那霉素(Sangon)和25 μg/mL的红霉素(Sangon)以维持抗性。其他情况下的菌株和质粒按照先前的研究进行培养[19]。

表1 本研究使用的细菌菌株和质粒Table 1 The strains and plasmids used in this study
2.2 方法
2.2.1pilZ基因突变菌株的构建
参考Zeng等[21]的同源重组方法构建ΔpilZ突变菌株。用带有限制性酶切位点的引物对,通过PCR扩增出pilZ基因的上下游片段。然后通过双酶切和连接,PCR产物连接到空载体pK18mobsacB-ery上,从而构建出重组载体。将重组载体导入到E. coliWM3064中,再将导入成功的WM3064菌株和P. marina野生菌株混合,滴加在1/2 SW-LB-DAP平板(正常配制LB固体培养基的情况下,加入1/2的过滤海水并在灭菌后加入0.3 mmol/L的DAP溶液)上进行接合转移培养。25℃条件下培养2~5 d后,将菌苔按浓度梯度稀释涂布于含有红霉素的Zobell 2216E平板上筛选出单菌落,并用LF/SR和SF/LR引物对进行PCR验证。将验证正确的菌株涂布于20%蔗糖培养基上培养2 d,挑取单菌落用LF/LR和SF/SR引物对进行PCR验证。ΔpilZ菌株利用SF/SR、LF/SR、SF/LR和LF/LR引物对进行最终验证。文章所用引物详见表2。
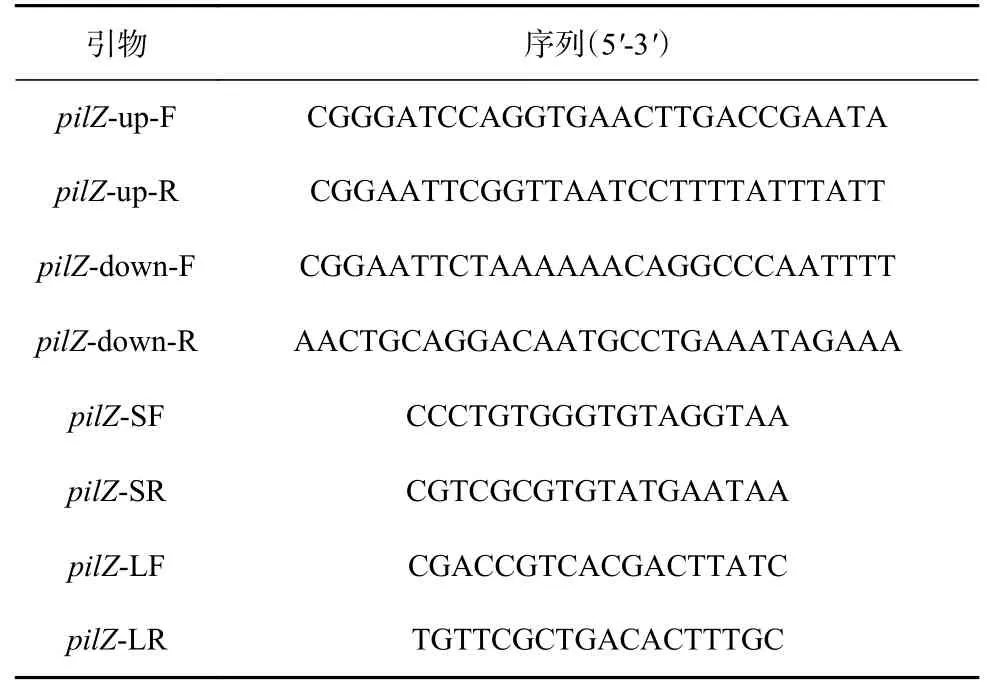
表2 构建ΔpilZ菌株所使用的引物及其序列Table 2 Primers used to construct ΔpilZ strain and its sequences
2.2.2 生物被膜培养
参考Yang等[22]的方法来培养生物被膜。挑取野生菌和ΔpilZ菌单菌落于2216E液体培养基中培养16~18 h(25℃,200 r/min)。用50 mL无菌离心管收集菌液,离心(3 500 r/min,15 min)、弃上清,保留细菌沉淀。加入50 mL灭菌过滤海水(Autoclaved Filtered Seawater, AFSW)吹打混匀,离心后弃上清,保留沉淀,上述步骤重复3次。最终使用AFSW充分混匀细菌沉淀,并定容至50 mL。吸取100 μL定容后的菌液加入到9 900 μL AFSW中稀释混匀后吸取1 mL用孔径为0.22 μm的滤膜过滤,然后使用0.1%吖啶橙对滤膜染色5 min(吖啶橙使用前需用孔径为0.22 μm滤膜过滤),待滤膜风干后制片,使用荧光显微镜(Olympus BX51)观察计数,在10×目镜、100×油镜下随机选取10个均匀视野进行细菌计数,每组分别设置3个平行,最终通过计算确定1 mL稀释菌液的细菌数量。根据所得细菌密度向装有无菌载玻片(12.7 mm×38.1 mm)的无菌培养皿(64.0 mm(Φ)×19.0 mm(高))中加入相应量菌液,并使用AFSW补加定容至20 mL,一共设置了1×108cells/mL、3×108cells/mL、5×108cells/mL和1×109cells/mL 4种初始浓度。最后将培养皿放置于18℃条件下培养48 h。
2.2.3 生物被膜上细菌密度计数
取出制备好的生物被膜放入甲醛溶液(5%)中固定24 h后,再用AFSW轻轻润洗载玻片3次后染色,染色及观察方法同2.2.2节,有关计算公式参照文献[22]。
2.2.4 幼虫附着变态鉴定
按上述方法培养好野生菌和ΔpilZ菌的生物被膜,用AFSW轻轻润洗3次生物被膜,然后将1片附有生物被膜的载玻片和20只活性良好的幼虫放入盛有20 mL AFSW的无菌玻璃培养皿中。将其置于18℃下避光培养,使用体视显微镜在10×目镜、5×物镜下观察幼虫和附着变态幼虫。与幼虫相比,附着变态的幼虫纤毛环消失、具有鳃和稚贝壳,幼虫附着变态的个数可间接反映不同单一生物被膜对幼虫附着变态影响的差异。无生物被膜的灭菌短玻片(12.7 mm×38.1 mm)作为阴性对照,10-4g/mL的肾上腺素(Epinephrine, EPI)作为阳性对照。不同菌株生物被膜每个浓度下做9个生物学重复。
2.2.5 细菌菌落形态
挑取单菌落于2216E液体培养基中培养16~18 h(25℃,200 r/min)后,按浓度梯度稀释涂布于Zobell 2216E固体平板上,于25℃恒温培养箱中培养2~5 d,选取大小均匀的单菌落进行表型拍摄。
2.2.6 细菌运动性
方法参照Zeng等[21]的描述。挑取野生菌和ΔpilZ菌株单菌落于5 mL的2216E液体培养基中,同时设置无菌的2216E培养基作为空白对照,置于25℃、200 r/min条件下震荡培养至指数期(OD600约为1.0)。吸取1 μL培养后的菌液垂直悬浮滴加到0.3%琼脂平板上,在25℃下培养2 d。本试验设置了3个独立的生物学重复。
2.2.7 生物被膜膜厚观察
使用甲醛溶液(5%)将形成好的野生菌和ΔpilZ菌株生物被膜固定24 h,5 μg/mL的碘化丙啶(Propidium Iodide, PI)用来对生物被膜染色。避光染色15 min后,用AFSW轻轻洗掉生物被膜上多余的染料。每个载玻片随机选择3个显微镜视野观察,使用徕卡TCS SP8共聚焦激光扫描显微镜(CLSM)观察细菌分布和生物被膜膜厚。本试验设置了3个独立样片。
2.2.8 生物被膜胞外产物染色
P. marina生物被膜染色方法参考González-Machado等 [23] 和Peng等[5]的方法,具体信息参考表3。使用150 mmol/L氯化钠溶液润洗附有生物被膜的载玻片,再避光染色20 min,然后用150 mmol/L氯化钠溶液轻轻洗去多余染料,处理后的样片使用共聚焦激光扫描显微镜和LAS X软件采集共聚焦图像。野生菌和ΔpilZ菌株生物被膜分别制备3个重复样片,每个样片随机选取3个均匀视野进行拍摄。
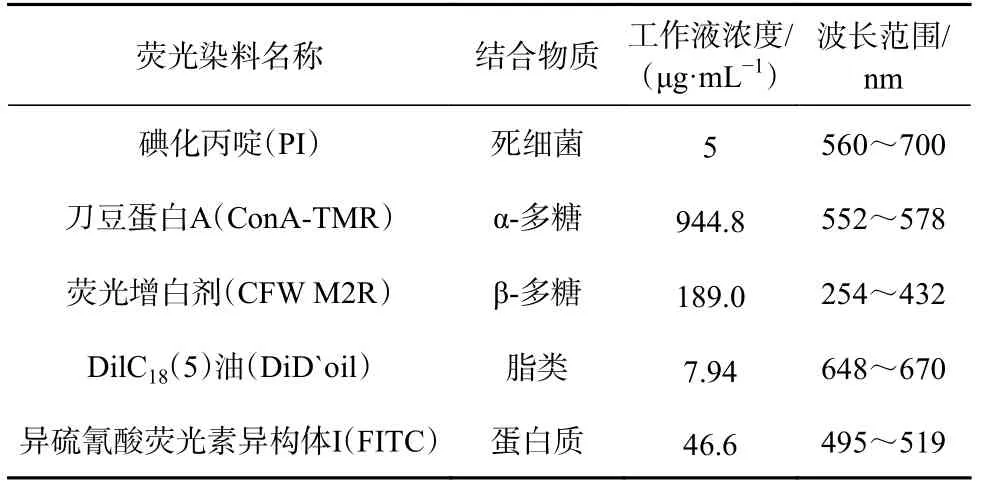
表3 激光共聚焦显微镜荧光染料信息Table 3 Laser confocal microscopy fluorescence dye information
2.2.9 胞内c-di-GMP定量
将野生型和ΔpilZ突变菌株用2216E液体培养基摇瓶在25℃、200 r/min条件下培养16~18 h,并用干净无菌的2216E培养基稀释至OD600值为0.3。取5 mL稀释后的菌液于12 000×g下离心5 min,弃去上清,保留沉淀。将沉淀风干后,加入100 μL的c-di-GMP提取液(0.1%(V/V)甲酸、40%(V/V)乙腈、40%(V/V)甲醇和19.9%(V/V)水),吹打混匀后在冰上孵育15 min;然后于16 000 ×g下离心5 min。取上清液用于LC-MS/MS定量分析,方法参考文献[24]。c-di-GMP标准品(Sigma)标准曲线用于计算上清液浓度,该实验设置了9个生物学重复。
2.2.10 数据分析
附着变态的幼虫所占的百分比要通过Arcsine转换以提高数据正态性。在数据统计分析前,利用JMPTM软件(10.0.0版)的Shapiro-Wilk’s W检验来检验数据的正态性。采用Kruskal-Wallis和Steel-Dwass All Pairs检验组间差异显著性。相关性分析采用Spearman秩相关检验。p<0.05作为差异显著性的临界值。使用Image J软件处理共聚焦图像,计算生物被膜胞外产物中各个成分的含量(单位:μm3)。
3 结果与分析
3.1 PCR鉴定pilZ基因缺失
如图1A所示,M表示DNA标记,自上而下条带大小分别为4 500 bp、3 000 bp、2 000 bp、1 200 bp、800 bp、500 bp、200 bp。第1、3、5、7号条带是用野生型菌株的总DNA为模板扩增的PCR产物,第2、4、6、8号条带是用突变菌总DNA为模板扩增出的PCR产物。1号和2号条带所用引物对为pilZ-SF/-SR,3号和4号条带所用引物对为pilZ-LF/-SR,5号和6号条带所用引物对为pilZ-SF/-LR,7号和8号条带所用引物对为pilZ-LF/-LR。野生型菌株的PCR产物对应大小分别为1 991 bp(条带1)、2 155 bp(条带3)、2 849 bp(条带5)和3 013 bp(条带7);ΔpilZ的PCR产物对应大小则分别为1 664 bp(条带2)、1 828 bp(条带4)、2 522 bp(条带6)和2 686 bp(条带8)。图1B为P. marina pilZ基因敲除前后的基因簇。
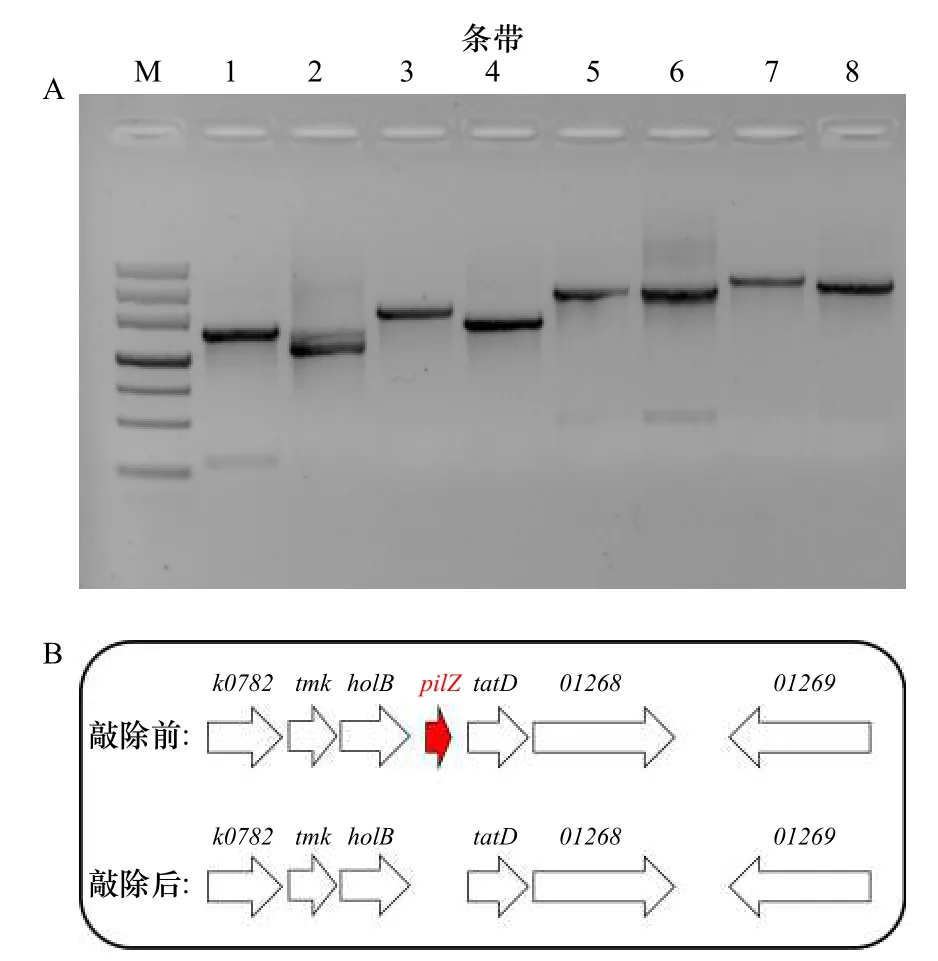
图1 pilZ基因缺失验证(A)和缺失前后基因簇(B)Fig. 1 The pilZ gene deletion verification (A) and gene cluster(B) before and after knockout
3.2 ΔpilZ生物被膜对厚壳贻贝幼虫附着变态的影响
对野生型和ΔpilZ菌株生物被膜的幼虫附着变态率进行分析比较显示,ΔpilZ生物被膜的幼虫附着变态率显著低于野生菌生物被膜(p<0.05)(图2A),抑制了厚壳贻贝幼虫的附着变态。其中,初始细菌密度5×108cells/mL下,ΔpilZ附着变态率较野生菌下降极为显著,相比较于野生型菌株33.88%的附着变态率,ΔpilZ菌株附着变态率仅为10.56%,附着变态率下降了68.87%(p<0.01)。此外,ΔpilZ生物被膜的细菌密度在不同初始细菌浓度下,均显著高于野生菌生物被膜,初始细菌密度5×108cells/mL下,ΔpilZ生物被膜细菌密度较野生型增加了35.76%(p<0.05)(图2B)。相关性分析结果表明,无论是野生菌还是ΔpilZ菌,生物被膜的细菌密度与其幼虫附着变态率均无显著关系(p>0.05)。
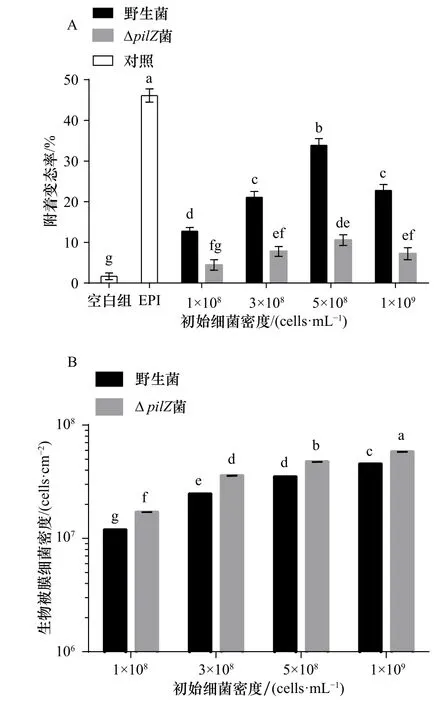
图2 不同初始细菌密度下野生菌与ΔpilZ菌生物被膜对幼虫附着变态的影响(A)及生物被膜细菌密度的分析(B)Fig. 2 Effect of wild-type and ΔpilZ biofilms formed with different initial bacterial density on larval settlement and metamorphosis (A) and the analysis of biofilm bacterial density (B)
3.3 pilZ基因缺失对菌体形态的影响
P. marina野生菌单一菌落表型为规则的圆形,表面光滑(图3A),ΔpilZ菌株单个菌落表型与野生菌相比,未显示出明显不同的变化(图3B)。
图3 菌落形态Fig. 3 Colony morphology of bacteria
3.4 ΔpilZ菌运动性和生物被膜CLSM图像分析
野生菌在半固体培养基上形成了明显的趋化圈,但与野生型菌相比,ΔpilZ菌株的运动性降低(图4A)。CLSM图像显示,ΔpilZ生物被膜上聚集的细菌比野生菌生物被膜多,二者数量明显不同(图4C,图4D)。野生菌生物被膜的膜厚为(5.16±0.16)μm,而ΔpilZ菌生 物 被 膜 膜 厚 为(6.2±0.18)μm,较 野 生 菌 增 加 了20.16%,差异性分析显示,二者之间存在显著性差异(p<0.05)(图4B)。
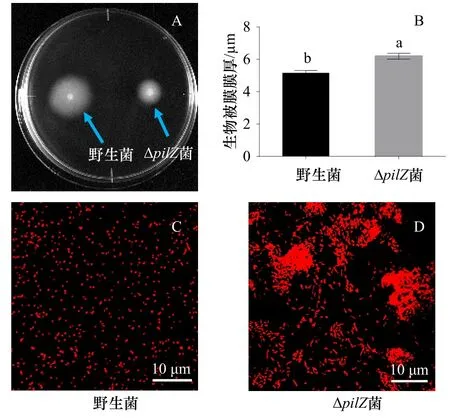
图4 野生型菌株和ΔpilZ菌株运动性(A)、生物被膜(C、D)和膜厚(B)Fig. 4 Motility (A), biofilm (C, D) and biofilm thickness (B)of wild-type and ΔpilZ strains
3.5 ΔpilZ生物被膜胞外产物CLSM图像分析
共聚焦图像及生物量数据统计分析结果比较显示,与野生型菌株相比,ΔpilZ菌株生物被膜胞外产物中β-多糖和蛋白含量变化不同(图5A)。CLSM图像处理结果表明,其中β-多糖含量降低了42.57%,蛋白含量下降了19.34%,而对于α-多糖和脂质未观察到差异(p>0.05,图5B)。
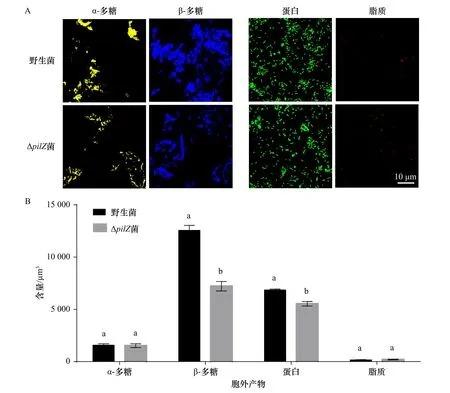
图5 野生型菌株和ΔpilZ菌株生物被膜共聚焦扫描图像(A)和统计结果(B)Fig. 5 Confocal scanning images (A) and statistical results (B) of biofilm of wild-type and ΔpilZ strains
3.6 细菌c-di-GMP水平
根据LC-MS/MS定量分析结果以及c-di-GMP标准曲线得出,ΔpilZ胞内c-di-GMP水平为(20.50±1.09)ng/mL,野生菌胞内c-di-GMP水平为(21.10±1.35)ng/mL,突变菌株与野生菌胞内c-di-GMP水平无显著性差异(p>0.05)(图6)。
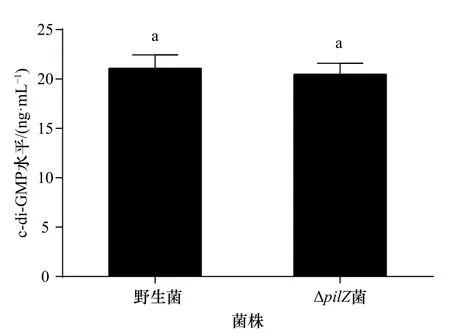
图6 野生菌和ΔpilZ菌的胞内c-di-GMP水平Fig. 6 The c-di-GMP levels of wild-type and ΔpilZ strains
4 结论与讨论
c-di-GMP作为细菌胞内第二信使早已在30多年前被首次报道过[14],且被证实与细菌运动、细菌聚集、胞外产物的生成和生物被膜形成有关[25-27]。在绝大多数细菌中,胞内c-di-GMP水平调控细菌由浮游生活向固着生物被膜生活方式的转变[28-30]。Jenal等[3]研究表明,当细菌胞内c-di-GMP处于较高水平时会使细菌聚集靠拢,进而促进生物被膜的形成。同时,胞内c-di-GMP的水平与纤维素[31-32]、藻酸盐[15]、Pel多糖[33]等细菌胞外多糖的产生也紧密相关;藻酸盐和Pel多糖[34-35]等胞外多糖又可影响铜绿假单胞菌(Pseudomonasaeruginosa)生物被膜的形成。因此,细菌胞内c-di-GMP水平不仅可以直接影响生物被膜的形成,还可以通过调控胞外多糖的含量来影响生物被膜形成。在海假交替单胞菌以往的研究中,当菌体多糖合成相关基因orf01912、脂肪酸合成基因tesA和纤维素合成基因BcsQ缺失后,细菌胞内c-di-GMP水平发生变化,影响生物被膜胞外产物的含量,进而影响厚 壳 贻 贝 幼 虫 的 附 着 变 态[5,7,36]。其 中,胞 外 多 糖 合 成相关基因01912表达蛋白的结构域中含有可与c-di-GMP结合的AAA ATPase结构域,当c-di-GMP的靶基因01912缺失后,菌体胞内c-di-GMP水平升高[5],表明菌体某些结合蛋白基因的缺失会影响到胞内cdi-GMP水平的改变,从而引起生物被膜胞外产物的变化。在本研究中,pilZ基因缺失后形成的生物被膜胞外β-多糖和蛋白的含量、诱导厚壳贻贝幼虫附着变态的能力均显著降低(p<0.05)。然而,野生菌与ΔpilZ菌株胞内c-di-GMP水平的定量结果显示,两株菌胞内c-di-GMP水平并无显著性变化(p>0.05),与此前的研究呈现出相反的结果。通过对pilZ基因表达产物的结构预测发现其具有PilZ结构域,表明该表达产物是c-di-GMP结合蛋白。然而当P. marina pilZ基因缺失后并未像此前的研究结果那样可以通过影响菌体胞内c-di-GMP的水平来改变胞外产物的含量,从而影响厚壳贻贝附着变态。因此,推测该基因可能通过其他途径调控生物被膜形成及厚壳贻贝幼虫附着变态。
pilZ基因最初发现是作为IV型菌毛生物合成和抽搐运动所必需的调控基因[18]。Welker等[37]研究表明,T4P运动马达的活性可调节细菌微菌落的局部结构和黏度,微菌落作为生物被膜的前体结构直接影响生物被膜的成熟与否。在脑膜炎奈瑟菌(Neisseria meningitidis)中,T4P的收缩可以增强菌落的流动性,从而有利于生物被膜的扩散、成熟[38]。在铜绿假单胞菌(P. aeruginosa)和黄色黏球菌(Myxococcus xanthus)中,抽搐运动作为菌体的另一种特殊运动方式影响生物被膜形成[39-41]。在本研究中,相较于野生菌,pilZ基因缺失后菌体运动能力下降,生物被膜上细菌密度、膜厚明显增加(p<0.05),这可能是因为pilZ基因缺失影响T4P的抽搐运动,进而导致细菌附着在载玻片上时运动性减弱,使细菌更容易聚集在一起形成生物被膜。
同时,在对黄色黏球菌的研究中发现[42],菌体S运动过程中,细菌胞外多糖可以调节T4P的反应,且二者之间存在相互作用,T4P的缺失会影响到胞外多糖的含量。而多糖作为生物被膜胞外产物的主要成分[2],可诱导海洋无脊椎动物幼虫的附着变态。如纤维素的过量产生、荚膜多糖的减少均可以抑制厚壳贻贝幼虫的附着变态[21,43];可拉酸含量增加,会促进厚壳贻贝幼虫的附着变态[5]。本研究中,与野生型菌株相比,ΔpilZ菌株所形成的生物被膜显著抑制了厚壳贻贝幼虫的附着变态;通过共聚焦图像分析结果可以看出,ΔpilZ菌株较野生型菌株而言,胞外产物中β-多糖和胞外蛋白含量显著下降,相关性分析结果表明,幼虫附着变态率与二者显著相关(p<0.05)。由此可见,pilZ基因缺失后菌体可能因无法正常组装T4P而引起菌体运动性下降、生物被膜上的胞外多糖含量及蛋白减少,进而抑制了厚壳贻贝幼虫的附着变态。另外,pilZ基因缺失后菌体表面的T4P变化以及该基因的表达产物与c-di-GMP之间的相互作用仍需进一步探究。
综上所述,本研究利用同源重组方法构建P. marina pilZ基因缺失菌,菌体pilZ基因的缺失会影响T4P的正常组装和抽搐运动,细菌运动性减弱,形成的生物被膜膜厚增加、细菌密度增加,胞外产物中β-多糖和蛋白含量减少,进而降低了对厚壳贻贝幼虫附着变态的诱导能力。本研究为进一步了解海洋细菌生物被膜形成的分子机制及其对厚壳贻贝幼虫附着变态的诱导机制提供了理论依据。

