细菌膜囊泡在海洋生态系统中的研究现状及展望
赵晶 ,贾宸政,王凯,张贝贝
( 1. 厦门大学 海洋与地球学院,福建 厦门 361102;2. 厦门市海湾生态保护与修复重点实验室,福建 厦门 361102)
1 引言
膜囊泡的提出,可以追溯到150年前达尔文“泛生论”中提到的细胞能产生携带遗传物资的“微芽”[1],但此发现因缺乏实验证据而被否定。20世纪60年代,首次观察到的源于革兰氏阴性细菌的外膜囊泡,也因对生物功能认识不足而被认为是细胞不平衡生长与排泄机制的产物[2-3]。直到1975年,DeVoe和Gilchrist[4]在感染脑膜炎球菌(Neisseria meningitidis)患者的脊髓液中发现了膜囊泡,膜囊泡才与细菌感染联系在一起。随后,人们针对细菌膜囊泡的发生与形成、结构与功能逐渐开展研究。2007年,Valadi等[5]首次发现真核生物的细胞外囊泡能够携带、转移遗传物质并介导细胞间通讯,将细胞外囊泡的研究推向新的高度。至今,学术界普遍认为细胞外囊泡的释放是原核生物与真核生物的活细胞所共有的保守机制[6]。细胞外囊泡根据释放它们的物种分类具有不同的命名,通常而言,外泌体和微囊泡用于真核生物;膜囊泡、膜泡、外膜囊泡和外膜泡则多适用于细菌和古菌等生物(EVpedia, http://EVpedia.info)。
细菌膜囊泡是一类由磷脂双分子层组成的,大小通常介于20~400 nm,携带复杂蛋白质(细胞质/周质/外膜蛋白)、核酸(RNA/DNA/质粒)、毒素因子、信号分子甚至噬菌体等重要信息物质的囊泡[7-8]。细菌膜囊泡的生物发生机制主要是细胞内/外膜出芽和细胞爆裂溶解,且不同的发生途径可能导致囊泡具有不同结构与组成成分[8-9](图1)。对于革兰氏阴性菌而言,不平衡的肽聚糖生物合成或外膜疏水分子的插入可导致外膜出芽[10-13]。由于内膜保持完整,外膜凸起形成的单层膜囊泡并不具有细胞质组分[8]。而另一种方式,细胞在DNA损伤时产生的内溶素等作用下,爆裂产生的膜碎片通过聚集并自我组装,形成内含随机细胞质成分的内外膜囊泡和爆炸性外膜囊泡[14-15]。对于革兰氏阳性菌及分枝杆菌而言,细胞壁的刚性结构成为囊泡释放的阻碍。在这种情况下,内膜起泡后可能通过膨胀压力、细胞壁修饰酶和微管蛋白等超微结构穿过细胞壁,形成包含细胞质组分的细胞质膜囊泡[16]。同时,内溶素等因素也能导致革兰氏阳性菌细胞发泡死亡从而产生囊泡[17]。
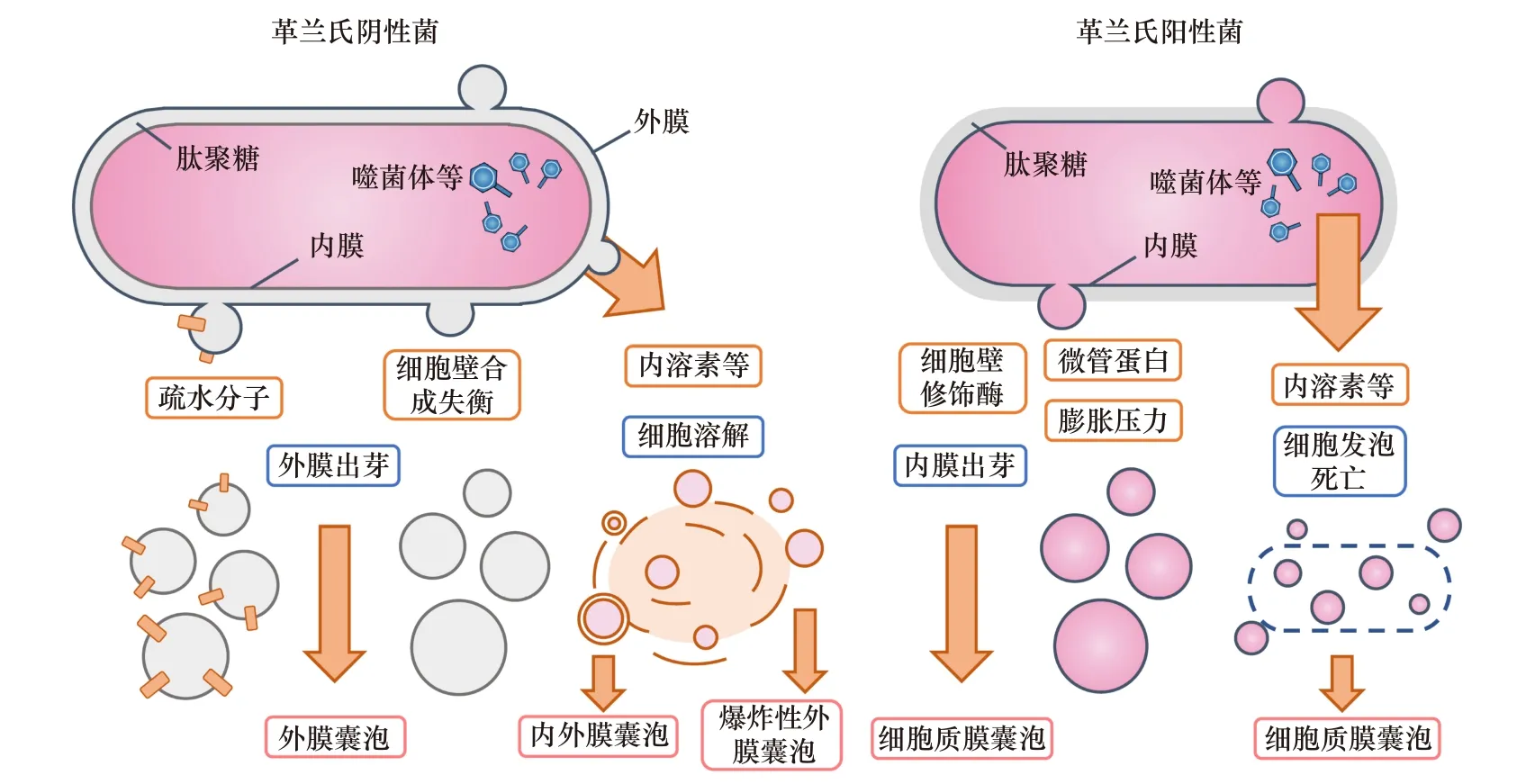
图1 细菌膜囊泡的生物发生Fig. 1 Biogenesis of bacterial membrane vesicles
2013年,Rothman等因揭秘真核生物外泌体的细胞运输调控机制问鼎诺贝尔奖,使细胞外囊泡的研究成为热点。而同样作为一种生物纳米颗粒,原核生物膜囊泡在生物体的生命活动中扮演着多重角色,包括将毒力因子传递到宿主细胞[18-19]、提高母细胞获取营养物质的几率[20-21]、介导种间或种内基因水平转移[22-23]、触发微生物群体感应[24-25]、驱动生物膜形成[26-27]、减小噬菌体与抗菌肽危害[28-29]、抑制或杀死竞争菌并建立生态位[30-31]等过程。现今,细菌膜囊泡领域的研究主要聚焦于陆源病原菌与人类健康等研究方向,在膜囊泡的生物发生、组成成分以及如何调控宿主与病原菌相互作用等方面展开[18-31]。
相较于陆源微生物而言,海洋细菌是膜囊泡研究的“盲区”。在美国国家生物技术信息中心 ( National Center for Biotechnology Information, NCBI )的PubMed数据库(https://pubmed.ncbi.nlm.nih.gov)中以“Bacterial membrane vesicles”和“Marine bacterial membrane vesicles”进行检索,近10年来的有关海洋领域膜囊泡的文献仅占细菌膜囊泡研究的1.7%,我们对其中细菌膜囊泡的生态角色、生物功能等所知甚少(图2)。近年关于海洋细菌膜囊泡的研究已初露端倪,表明其在海洋生物圈中可能发挥着重要作用,且功能广泛。细菌膜囊泡能够调节噬菌体与微生物的相互作用从而影响对海洋病毒感染动力学的研究[28,32],并且在海洋宿主与细菌的互惠共生中影响海洋无脊椎动物的生命进程[33-39],最终使整个海洋生态系统的能量流动与物质循环更加复杂多样。本文将重点分析近年来发现的细菌膜囊泡在海洋生物及环境中的潜在功能,为其他聚焦海洋微生物的科研工作者提供新的研究思路,并为未来进一步开展细菌膜囊泡在海洋生物圈中的作用等研究奠定理论基础。
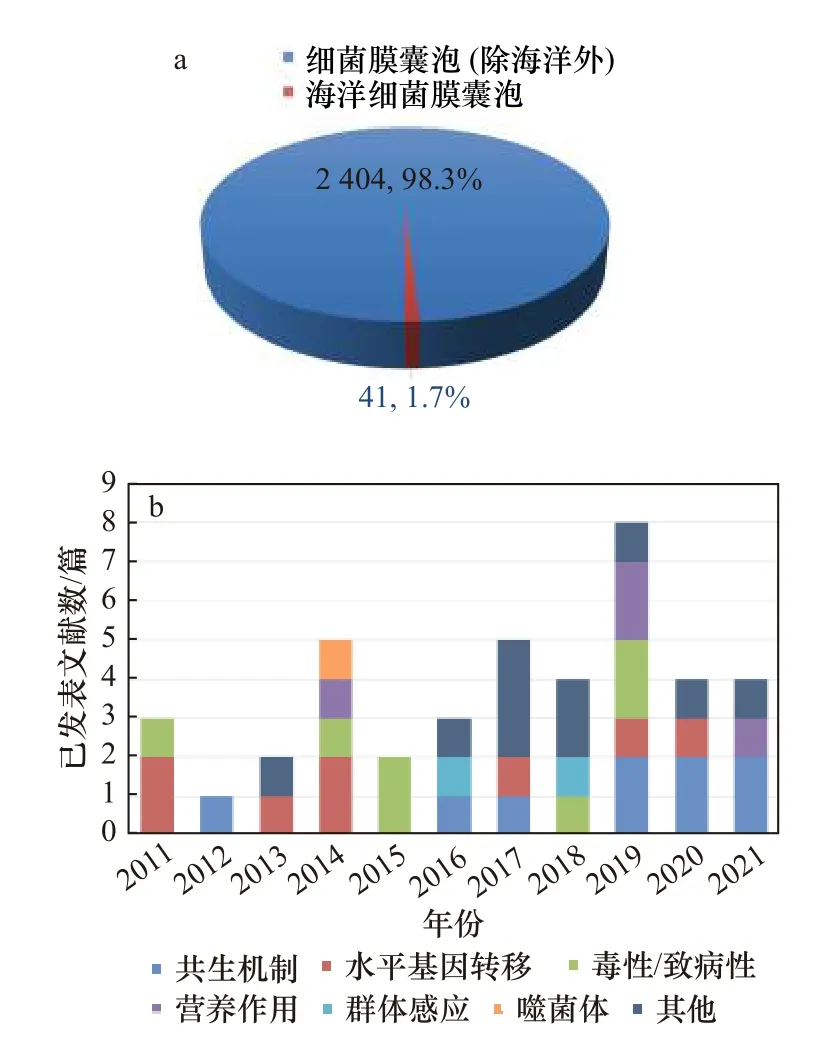
图2 2011-2021年发表的海洋细菌膜囊泡领域文献数量Fig. 2 Publications in the field of marine bacterial membrane vesicles from 2011 to 2021
2 细菌膜囊泡在海洋生物体及环境中的潜在功能
Lynch和Alegado[40]研究发现,海洋中存在高水平的细菌膜囊泡,保守估计每天经由膜囊泡释放的蛋白质可达约1×106t,可转化成3.92×1011g碳、1.24×1011g氮和1.96×1010g硫,将影响对全球营养盐收支的统计。此外,在物质无限稀释的海洋环境中,膜囊泡能使胞外酶和信号物质尤其是疏水性群体感应分子具有可溶解性、稳定性、高浓度等优势,并在海水的流动下进行远距离传递,有利于海洋微生物间的物质信息交流[30,41-42](图3)。因此,膜囊泡在影响海洋生态系统的群落结构乃至生物地球化学循环方面都具有巨大潜力。
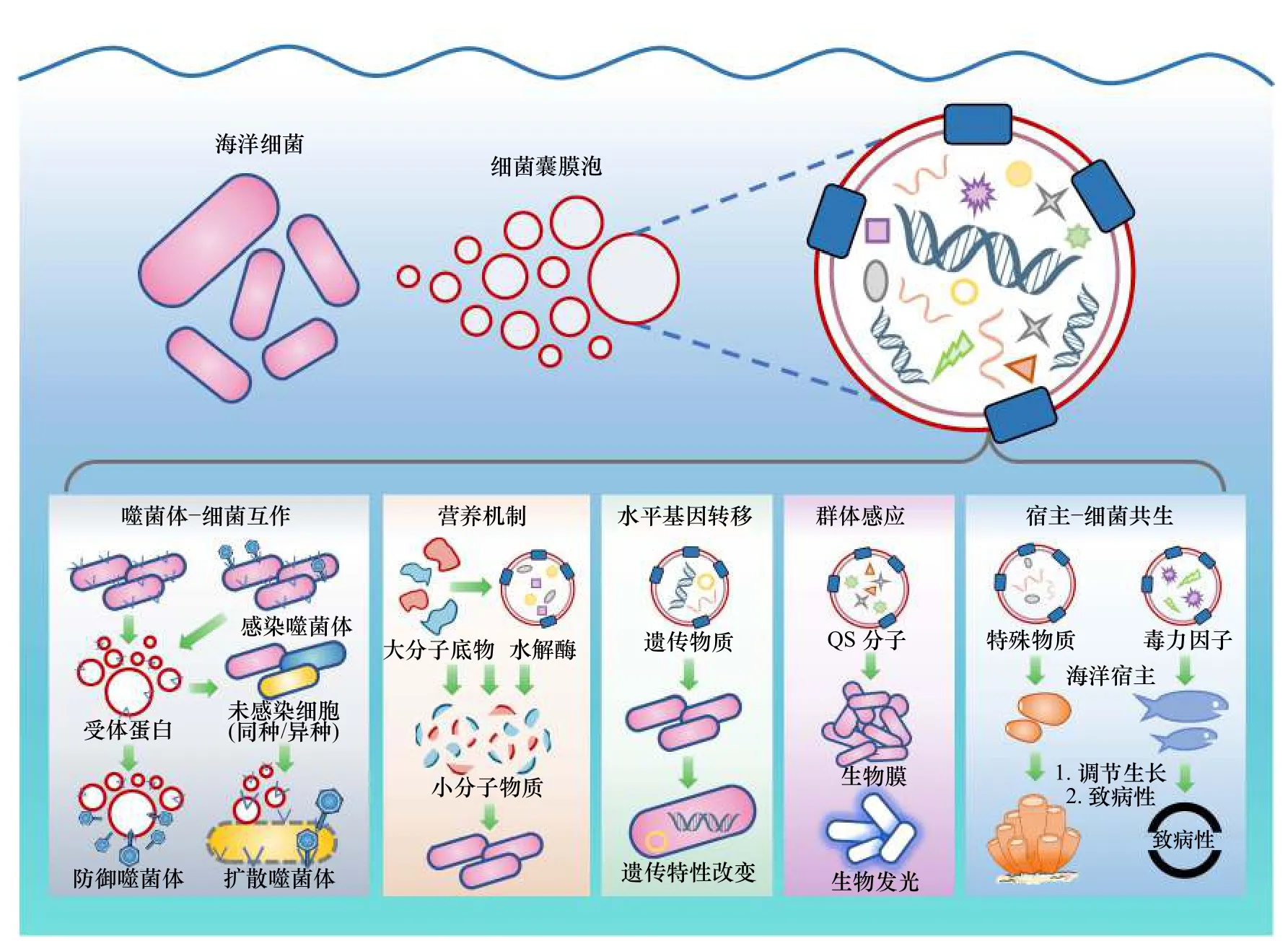
图3 微生物细胞外囊泡在海洋生态系统中扮演的潜在角色Fig. 3 The potential roles of microbial extracellular vesicles in marine ecosystems
2.1 在噬菌体感染中的防御功能
细菌在与噬菌体的长期对抗性共进化过程中,为了抵御噬菌体的侵染演化出了多种复杂机制,包含通过修饰表面受体阻断噬菌体吸附[43-44]、限制性修饰系统(R-M 系统)切割入侵的DNA[45]、成簇的规律间隔短回文重复序列及其相关蛋白(CRISPR-Cas系统)介导的适应性免疫[46]、流产感染中断噬菌体繁殖[47]、硫代磷酸酯修饰系统切割噬菌体DNA[48]等。其中,细菌膜囊泡由于在特定的生物发生过程中携带了母菌的表面受体,能够作为一种替身诱骗噬菌体侵染,从而减少噬菌体对母菌的吸附[8](图4a)。早在10年前,Manning和Kuehn[29]研究发现大肠杆菌(Escherichia coli)释放的膜囊泡能够快速且不可逆的吸附包括抗菌肽和T4噬菌体在内的外膜作用物质,从而促进细菌的先天性防御。这种抵御噬菌体侵染的防御机制并不是个例,霍乱弧菌(Vibrio cholerae)产生的膜囊泡甚至能对3种噬菌体起到不同程度的抵御作用[49]。理论上,革兰氏阴性菌通过出芽形成的囊泡带有母菌外膜组分,都可能作为防御噬菌体的第一道防线,这种受体依赖型的机制对宿主的保护程度可能取决于膜囊泡的产生速度与累积浓度;革兰氏阳性菌分泌的囊泡对某些以质膜蛋白为受体的噬菌体可能也有同样的防御作用。
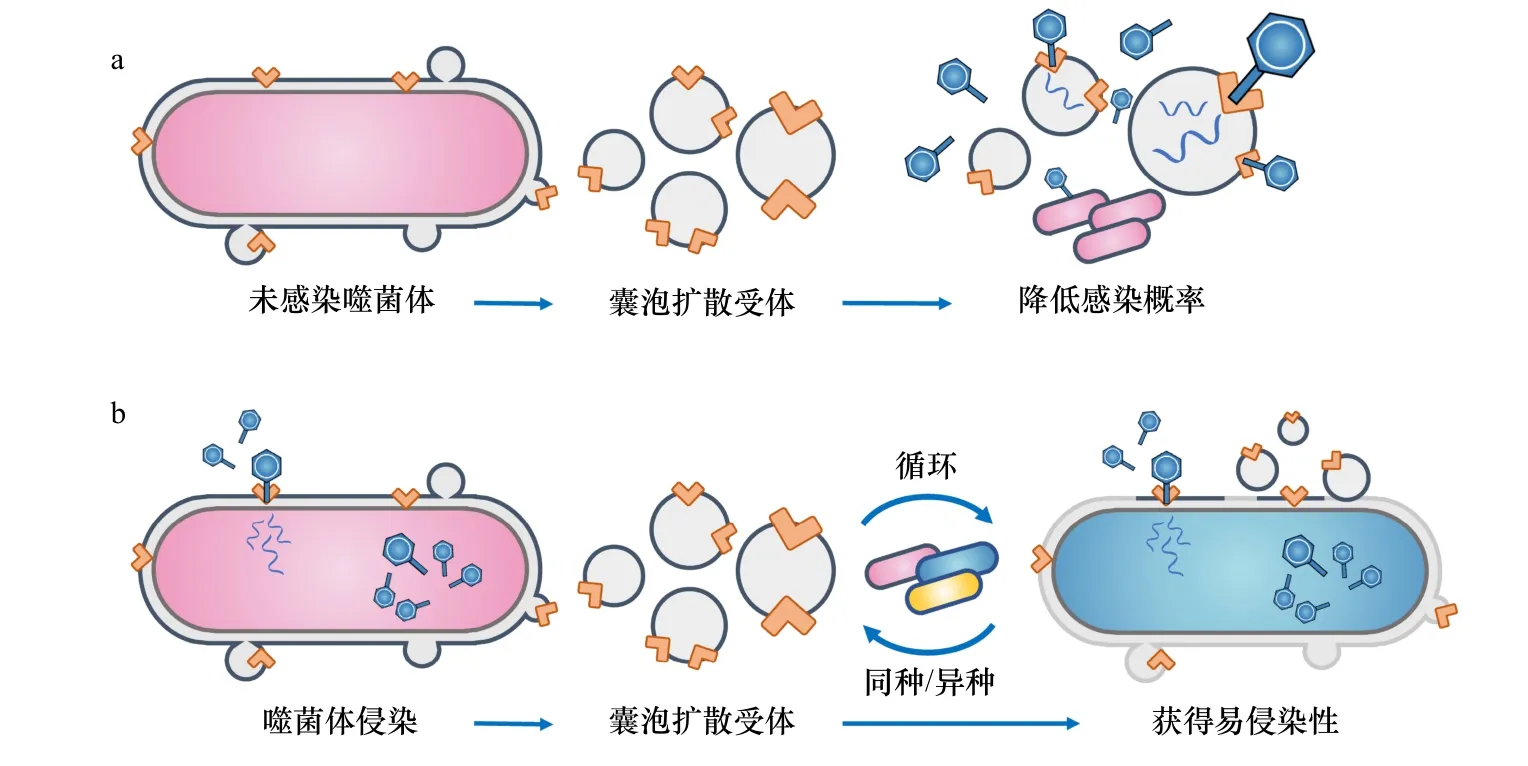
图4 细菌膜囊泡参与噬菌体与微生物相互作用Fig. 4 Bacterial membrane vesicles are involved in phage-bacterial interactions
病毒是海洋生态系统中丰度最高的生物实体,甚至高达108个/mL,是海洋细菌和古菌总和的15倍,每秒钟可发生1023例感染[50-51]。根据Biller等[28]研究可知,海洋原绿球藻(Prochlorococcus)持续释放大量的膜囊泡能与噬菌体(PHM-2)相结合。其中,往往伴随着尾鞘缩短与衣壳染色密度的改变,证明了该现象确实是噬菌体注入核酸进行错误性侵染的结果而非一种人工产物或偶然性重叠。我们最近的研究发现,海绵共附生拟杆菌(Tenacibaculum mesophilum)产生的膜囊泡同样能够与周围环境的噬菌体结合(数据未展示)。据我们所知,目前,关于海洋细菌膜囊泡与噬菌体防御方面的文献报道仅有1篇[28]。这些细胞外囊泡的释放降低了细胞被感染致死的可能性。据此,我们可以想象:海洋生态系统中存在的大量细菌膜囊泡可能代表了一类能够影响海洋噬菌体感染进程的颗粒,它们通过改变病毒感染动力学从而调节海洋微生物的群落结构与丰度。
2.2 加速噬菌体侵染的扩散功能
在病毒与宿主的相互作用中,膜囊泡等细胞外囊泡也能够在侵染细胞的过程中发挥作用,从而促进病毒的复制扩散与生态位的占据。早在1978年,Loeb和Kilner[52]研究发现T4噬菌体能侵染并提高大肠杆菌释放膜囊泡的能力,且细胞在感染前后释放的囊泡膜的蛋白质组成相似。事实上,这些囊泡结构不仅内含宿主细胞编码分子,而且可能包含病毒基因片段与蛋白等重要信息,甚至是增殖后的病毒颗粒[17,53-54]。根据Tzipilevich等[55]的研究可知,枯草芽孢杆菌(Bacillus subtilis)释放的膜囊泡能通过膜融合转移病毒受体YueB,导致其他物种更易受到噬菌体SPP1感染。这种由囊泡介导的细胞表面成分交换的机制,促进了噬菌体对其他处于同一生态位的非宿主物种的侵染,扩大了病毒宿主范围(图4b)。此外,在人体细胞外泌体与病毒的研究中,也有文献指出COVID-19和HIV等病毒可能利用感染细胞释放的细胞外囊泡转移受体并扩大侵染范围,甚至能躲避免疫系统从而促进病毒的胞间传播[56-58]。
在海洋生态系统中,病毒每秒钟引发1023例感染,每天杀死20%(生物量)的微生物,病毒感染的宿主特异性使其成为调控微生物群落的强大媒介[50-51]。理论上,海洋病毒很有可能将被感染细菌分泌的细胞外囊泡作为病毒颗粒的载体,从而达到繁殖和扩散的目的。据我们所知,目前该领域研究暂无报道,仅有1篇文献以真核藻类及其噬菌体为研究对象。2017年,Schatz等[32]发现颗石藻(Emiliania huxleyi)受噬菌体PM04感染后释放出的细胞外囊泡能够延长病毒颗粒在水体的半衰期以维持有效的侵染性,从而加速病毒侵染同种藻类细胞的进程。与先前所述的抗病毒保护机制不同的是,该研究报道的囊泡并不能作为一种诱骗噬菌体感染的防御机制[28-29,49]。此外,这种机制下的海洋微生物囊泡是一类完全相反的、推动病毒感染动力学的生物纳米颗粒。另一方面,细菌膜囊泡具有促进噬菌体在非宿主自然群落中的传播和入侵的潜力,这使得处于同一生态位的微生物群落结构得到多重调控[55]。
2.3 维持细菌生长的营养机制
自然界中,微生物能通过从外界环境中摄取和利用所需的营养物质,以满足其各项生理生化活动,从而维持和延续其生命形式。其中,膜囊泡在该方面扮演着重要角色,其主要是通过运输金属离子、携带受体、包装水解酶等途径协助母细胞获取营养物质[20-21,59-61]。目前,这些研究多集中于陆地环境的微生物。例如,铜绿假单胞菌(Pseudomonas aeruginosa)和结合分枝杆菌(Mycobacterium tuberculosis)利用囊泡复合物转运宿主环境中的铁离子[20-21];伯氏疏螺旋体(Borrelia burgdorferi)释放携带水解酶与受体的膜囊泡降解基质蛋白以获取外源多肽[59];黄色黏球菌(Myxococcus xanthus)和溶杆菌(Lysobactersp.)分泌含有水解酶的囊泡杀死其他微生物获取营养来源[60-61]。理论上,膜囊泡通过拓宽母菌获取外源营养的途径,增强了细菌在宿主或寡营养生境等恶劣环境中的存活能力,这种机制可能广泛存在于微生物中。根据目前的测序数据可知,98%以上的微生物缺乏合成氨基酸的必要途径或关键基因,其生长依赖于群落中的其他成员、宿主或环境所提供的氨基酸、维生素或辅助因子等必需营养[62]。对此,细菌膜囊泡相当于提供了一种有效的生存策略,维系了种群的持久存在。
在海洋生态系统中,微生物的生长可能因营养物质的缺乏而受到限制,而克服营养匮乏的机制是海洋微生物在恶劣环境中生存的关键[63-64]。在这种情况下,海洋细菌膜囊泡能通过携带水解酶与受体蛋白等策略维持微生物细胞的生存[42,65-68]。例如,假交替单胞菌中的Pseudoalteromonas distincta与海洋黄杆菌(Formosaspp.)能够出芽形成携带水解酶的珍珠状囊泡链,这种细胞表面附属物不仅使单位细胞体积具有更多的表面酶,而且扩大了对聚合营养物的监测空间[65-66]。不同的是,交替单胞菌(Alteromonas macleodii)是直接向周围海水环境释放大量包装有水解酶的囊泡,以此提高基质环境中可供细菌群落吸收利用的营养物质的浓度[42]。此外,分离自南极的希瓦氏菌(Shewanella vesiculosa)的囊泡中携带着水解酶与Ton-B依赖性受体并且表现出对革兰氏阳性菌的溶解作用[67],这可能也是与溶杆菌类似的一种捕食机制[60-61]。其所携带的Ton-B的外膜通道家族蛋白被认为是海洋细菌在营养限制条件下生存的一种机制[69]。与之相类似的,还有分离自南极的假交替单胞菌中的Pseudoalteromonas antarctica[68]。它们可能将膜囊泡作为酶与Ton-B受体的载体对所需营养物质进行识别与转运等,以此适应南极极端的营养环境。相较于上述这些“自私”的摄取,原绿球藻的膜囊泡则能够作为某些异养微生物的单一碳源并支持其生长,表现出另外一条营养流动途径[28]。总而言之,相较于以孔蛋白进行被动转运为生存策略的生物而言,细菌膜囊泡作为一种潜在的营养机制为海洋微生物提供了优势,对整个海洋生态系统的营养通量和循环都具有重要意义。
2.4 介导水平基因转移的重要模式
自然界中,原核生物能够通过快速获取维持其生存所需的遗传特征以适应外界环境变化[70]。其中,遗传的可塑性得益于细菌之间或细菌与其他物种之间通过水平基因转移所进行的遗传物质交流[71],该过程往往导致物种的基因更具多样性。通常,微生物可以通过接合、转导、转化以及基因转移因子等途径进行水平基因转移。然而,随着Dorward等[72]研究发现淋病奈瑟氏菌(Neisseria gonorrhoeae)膜囊泡介导耐药性质粒的转移,膜囊泡逐渐被认为是一种介导水平基因转移的新型模式。目前,在革兰氏阳性菌与阴性菌中均能观察到由膜囊泡介导的基因转移现象,包括耐药性基因[73]、毒力相关基因[22]、代谢相关基因[74]等。这种基因转移的模式,实现了不同代谢功能与基因跨越时间、空间和环境传播,提升了细菌的环境适应性,加快了物种进化[75]。
根据Biller等[28,76]的研究可知,细菌囊泡在海洋环境中普遍存在、数量庞大(在近海表层水与马尾藻海水样品中的浓度分别达到约6×106颗粒/mL和3×105颗粒/mL),且囊泡中包含的多样性与异质性DNA与33个门如变形菌门(Proteobacteria)、蓝藻门(Cyanobacteria)、拟杆菌门(Bacteroidetes)等具有显著的同源性。同时,Soler等[77]提出,磷脂双分子层的包裹可能决定了DNA在海洋环境中的稳定存在。此外,Chiura等[70]在实验室条件下证明,从海水中采集的膜囊泡确实能将营养缺陷标记DNA转移到大肠杆菌中。种种证据表明,细菌膜囊泡可能充当了储存与运输遗传信息的“仓库”与载体,从而介导了海洋生态系统中大规模的水平基因转移。目前,这种基因转移机制在海洋中的研究主要集中在古细菌[53,77-80]。例如,嗜热古菌(Thermococcus kodakaraensis)产生的囊泡能在热液喷口的高温环境中保护并转移质粒,甚至在没有感染的情况下传递病毒的基因组[53,78]。相似的,嗜盐古菌(Halorubrum lacusprofundi)分泌的囊泡同样可以作为其质粒的细胞间运输载体,并通过类似病毒的机制“感染”其他细胞[79]。此外,Kwon等[80]对自然环境中囊泡的宏基因组测序也表明,细胞外囊泡可能是海洋微生物群落中多种视紫红质基因转移的载体。总之,膜囊泡可能是海洋环境中水平基因转移的重要驱动力,使不同系统发育的微生物之间的基因交流更加复杂多样,提升了物种对环境的适应性。
2.5 介导群体感应的重要模式
群体感应是指环境菌群密度达到阈值后,通过累积的信号分子如酰基高丝氨酸内酯(AHLs)、假单胞菌喹诺酮信号(PQS)等介导细胞间通讯,进而调控微生物群体的生理特征,如产生毒性、形成生物膜等的过程[81]。通常而言,群体感应分子是由微生物合成并释放到环境中,与位于细胞膜或细胞质内的特定受体结合进而产生作用的[82]。然而,由于某些信号分子属于疏水性化学物质,其分子扩散可能受到细胞磷脂双分子层的阻碍[83]。针对这一现象,研究发现微生物能以膜 囊泡作 为群体 感应分 子的载体[30,41,83-84]。例如,铜绿假单胞菌利用囊泡传递PQS信号分子[83];脱氮副球菌(Paracoccus denitrificans)也能将疏水性分子C16-HSL包装至囊泡中运输[84]。微生物以这种策略进行细胞间通讯,不仅解决了疏水性分子难以通过细胞膜的问题,而且使信号分子在囊泡运输的过程中得到浓缩与稳定的优势,促进了群体感应的发生。
在开放的海洋环境中,群体感应面临的限制更加明显:一方面,疏水性信号分子难以通过自由扩散作用于受体细胞;另一方面,即使信号分子能够通过细胞膜传播,由于海水近乎无限稀释的特性,可能也难以达到引起群体感应的浓度阈值。在此情况下,基于细胞外囊泡的信号分子运输模式对于水生生境中的微生物具有尤为重要的生态意义。Brameyer等[41]研究发现,哈维弧菌(Vibrio harveyi)能将疏水性信号分子CAI-1包装至膜囊泡中,并以此引发群体感应。相似的,Li等[30]在施罗氏弧菌(Vibrio shilonii)产生的膜囊泡中也检测到疏水性信号分子AHLs,这可能与群体感应诱导的对珊瑚共生体的致病性有关。总之,这种将细胞外囊泡作为一种纳米尺度的信号传输载体的策略,促进了信号分子在水生环境中的长距离分布,对于调控海洋微生物群落的生理特征具有重要生态学意义。
2.6 调节微生物与宿主的共生机制
在长期的进化过程中,生物与微生物之间逐渐建立起了互惠共生的关系,从简单低等的原生生物到高等的哺乳动物都普遍存在这种现象[33-35,85]。而随着共生机制研究的不断深入,人们逐渐发现共生微生物也能通过膜囊泡的形式调节宿主的各种生命活动[86-87]。例如,Ñahui Palomino等[86]发现由乳杆菌属(Lactobacillusspp.)主导的阴道微生物群的膜囊泡可能抑制人体组织的HIV-1感染;定居于人类肠道的脆弱拟杆菌(Bacteroides fragilis)能通过膜囊泡在结肠炎过程中激活非经典的自噬途径发挥保护作用[87]。相较于某些内源的条件致病菌或外部入侵的病原体[88],这种由共生微生物分泌的膜囊泡参与了对宿主生命活动的调控,其介导的跨物种交流反而有利于维持宿主内环境的稳态。
然而,这种关系并不局限于陆地环境中的生物。海洋中的共生现象比陆地更为普遍、关系更加密切,包括藻类与固氮细菌或动物的互利共生以及动物之间的共栖、互利、寄生等各种类型[89]。但是,关于共生微生物细胞外囊泡在宿主中作用的研究才刚刚起步。目前已经在领鞭毛虫(Salpingoeca rosetta)[33-35]、苔海绵(Tedaniasp.)[36]、贝螅(Hydractinia echinata)[37]、华美盘管虫(Hydroides elegans)[38]、夏威夷短尾鱿(Euprymna scolopes)[39]中发现了相似的现象。例如,我们实验室在之前的研究中发现,拟杆菌门(Bacteroidetes)中的多株菌能够通过膜囊泡促使苔海绵的浮游幼虫进入附着状态[36],这可能与囊泡内部包裹的sRNA或精氨酸有关(资料未展示)。相同的,假交替单胞菌中的Pseudoalteromonas luteoviolacea等也能通过该途径诱导华美盘管虫的附着与变态[38]。此外,费氏弧菌(Vibrio fischeri)能上调主要外膜蛋白的转录,并以膜囊泡刺激其宿主“光器官”的发育[39]。据此,我们可以推测海洋细菌膜囊泡是一种广泛存在的共生宿主发育刺激因子,能够调控海洋真核生物生活史的转变,对于维持海洋生物群落的稳定性至关重要。同时,少数研究也发现膜囊泡可能作为海水养殖致病菌如塔斯马尼亚弧菌(Vibrio tasmaniensis)、杀鱼爱德华氏菌(Edwardsiella piscicida)等的毒力因子扩散载体,进而参与海洋微生物对宿主的致病过程[90-92]。总而言之,不同类型的细菌可能因具有不同的生存策略而分泌具有功能差异性的膜囊泡,进而在宿主与微生物的相互作用中扮演着多重角色。而作为一种生物纳米颗粒,膜囊泡表面携带或内部包裹的复杂信息物质或许才是细菌与真核宿主共生机制或致病机制的关键所在。
3 总结与展望
海洋是地球生态系统的关键组成部分。细胞外囊泡作为一类非细胞颗粒,来源于几乎所有生物细胞,它们可能通过各种方式在海洋生态系统中发挥生物学功能。海洋微生物作为海洋生态系统中分布最广、种类最多、丰度最大的一类生物,其所释放出的膜囊泡因携带丰富多样的内容物,将对海洋生物中的个体、种群、群落乃至生态系统产生重要影响。此外,基于膜囊泡在细菌-噬菌体互作与细菌营养机制等方面的潜在作用,我们推测海洋细菌膜囊泡可能影响生物地球化学循环,甚至是气候变化。首先,海洋微生物膜囊泡能够加速或减慢病毒感染过程,最终可能改变惰性溶解有机碳的释放速率,影响到“微型生物碳泵”的效率。其次,由于膜囊泡携带各种复杂的代谢产物等,可以直接作为微生物的营养来源或获取途径,将直接影响其群落组成并促进惰性溶解有机碳的积累。此外,细菌膜囊泡可能提高了海水的营养盐含量,并影响初级生产力与固碳效率。
目前,我们对其生态角色与生物功能研究尚浅、所知甚少。针对当前海洋细菌膜囊泡的研究概况,我们提出以下科学问题:(1)已发现膜囊泡具有防御噬菌体及促进噬菌体扩散的双向作用,那么其是否参与及如何调节海洋生态系统中微生物与噬菌体间的平衡?其是否改变了海洋微型生物碳泵的效率?(2)基于囊泡中含有大量C源、N源、P源等营养组分,其在海洋生态系统中物质循环的输出通量贡献比率是多少?(3)已证实细菌膜囊泡是生物分子的载体,其所介导的海洋生物细胞间通讯尤其是共生体系中的作用机制值得深入研究。
现今,由于细胞外囊泡具有细胞间信息传递的功能以及作为诊断工具的实用性而成为热点被广泛研究,但在自然环境中仍有很多领域还未涉及,在基础生物学上还有许多未解之谜。在海洋领域,关于细菌膜囊泡的大多数研究还停留在对某种现象的发现和观察,或是通过蛋白质组学等手段将其携带的组分与相应的功能联系在一起。尽管有不少文章推测膜囊泡在海洋生态系统中的各种潜在作用,但是这些假设和模型概念往往都缺乏进一步的实验验证。因此,在不同培养条件或自然条件下所开展的生化和生物信息学等研究仍然是解析膜囊泡功能与作用机制的关键点。不可否认,细胞外囊泡研究的一个主要挑战是囊泡在大小、结构、内含物等方面的高度多样性。其中,实验室的特异性培养条件可能会改变膜囊泡的理化特性,这可能降低了研究结果的准确性与可重复性。此外,海洋细菌膜囊泡与病毒的粒径存在一定重叠,导致这两种生物实体难以区分,影响了对海洋生态系统中膜囊泡丰度的评估。另一方面,细菌膜囊泡领域暂未发现与真核生物外泌体相类似的特异性标记物,这就增加了鉴定和量化其生态功能的难度。未来,随着细胞外囊泡生物学领域的扩大发展、组学技术的不断进步,相信海洋细菌膜囊泡也将受到越来越多的关注,为进一步拓宽海洋微生物学的各个领域奠定基础。

