凡纳滨对虾多代选育群体生长和耐综合胁迫性状的配合力及杂种优势分析
王伦,王崇懿,刘建勇,傅学丽*
( 1. 广东海洋大学 水产学院,广东 湛江 524088)
1 引言
凡纳滨对虾(Litopenaeus vannamei)又名南美白对虾,具有生长快、抗逆能力强、适宜高密度养殖等优点,是世界三大对虾养殖品种之一[1-4]。据统计,2020年我国凡纳滨对虾海水养殖产量达119.774×104t,占海水虾类养殖总产量的80.50%以上,是我国最主要的海水对虾养殖品种[5]。由于该品种并非我国的本地种,大多数亲本种群是从国外进口或经过多代选育的亲本种群[6-7],经过多代选育后有效种群规模较小,可能会带来重要经济性状近交衰退的风险[8]。杂交是解决以上问题的有效方法之一[7],是创造变异的重要途径;杂交可以产生亲本从未表现的超亲优势(获得杂种优势)[9],从而显著提高子代的生活力。因此,利用杂交将2个及2个以上不同遗传背景品种的个体基因自由组合,创造出新的遗传类型,经人工选择优良亲本,继而培育出新品种。在凡纳滨对虾育种领域,我国虽已培育出多个新品种,但采用的方法多为选择育种(家系选择、群体选择及品系选择),采用杂交育成的新品种仅见“壬海1号”[10],导致对杂种优势的利用远远不够。
近年来,对虾的放养密度不断增加,但高密度养殖会降低水环境中的pH,增加总氮和氨氮浓度[11-12](对虾高密度养殖氨氮浓度高达46 mg/L[13],pH低至4.1[14]);而夏季的高温则会增加养殖水体中盐度[15]。生活在较高盐度、氨氮和较低pH水体中,对虾会出现生长缓慢、免疫力下降、对病原菌的易感性提高等不良现象,致使养殖成活率降低[16-18]。凡纳滨对虾耐高盐度、耐高氨氮和耐低pH的杂交育种遗传改良是解决以上问题的重要途径。
配合力分析是水产动物杂交育种研究中的重要工作之一,是遗传改良的重要手段,也是杂种优势利用的前提[19]。有关凡纳滨对虾生长或单因子胁迫的配合力研究已有相关报道,王浩等[20]研究了凡纳滨对虾7个引进群体体质量的配合力;胡志国等[21-22]报道了凡纳滨对虾耐盐度和耐高氨氮胁迫的杂种优势和配合力,分别选出耐高低盐一般配合力(General Combining Ability, GCA)较高的泰国正大 (TZ)群体及耐高氨氮的强优势组合(美国迈阿密SIS群体(UM)与美国夏威夷SIS群体(UH)的杂交组合,即(UM×UH)组合)群体。然而在凡纳滨对虾实际养殖生产中,其所受的胁迫常常为多个环境胁迫因子的综合胁迫,但在凡纳滨对虾耐综合胁迫(高盐、低pH与高氨氮共同胁迫)配合力分析方面的研究未见报道,因此有必要开展该方面的研究,以实现育种目标的进一步提高。本研究以凡纳滨对虾“兴海1号”选育核心群体与国外引进的不同遗传背景的凡纳滨对虾群体交配,构建12个群体,以生长和耐受性状为主要选育目标,探究凡纳滨对虾的生长和耐综合胁迫的配合力及杂种优势,以期为凡纳滨对虾生长和耐受性状选育提供依据与参考。
2 材料与方法
2.1 实验材料
2.1.1 实验所用亲虾来源
凡纳滨对虾“兴海1号”新品种核心群体(GX):以我国广东湛江和广西东兴的7个凡纳滨对虾养殖群体(3 880尾)为基础群体,以成活率和体质量为目标性状,采用BLUP选育技术,从2011年开始经连续7代选育而成,并在2018年通过了全国水产原种和良种审定委员会审定。该品种的主要优点为:生长速度快、养殖存活率高(养殖100日龄的凡纳滨对虾“兴海1号”平均成活率为77.80%,平均体质量为15.42 g,与SIS一代苗相比,平均成活率提高了15.0%)、抗逆性强(主要表现为抗高氨氮)。该品种核心群体经本课题组选育至今已达10年。
泰国群体(W和L):2019由泰国引进两个多世代选育群体,分别为生长速度快的W品系及养殖适应性强,适合在高位池塘、普通虾塘、大棚等多种养殖模式养殖的L品系。
美国群体(K和M):2019由美国引进两个多世代选育群体,分别为兼具快长、养殖适应性强的K品系和养殖适应性强的M品系。
以上5个不同遗传背景的凡纳滨对虾群体均经多世代选育而成,具有较高的遗传纯度。
2.1.2 家系构建和对虾养殖
实验于2020年3月在湛江市国兴水产科技有限公司(国兴公司)进行,按袁瑞鹏等[23]的方法强化亲虾,从每个群体中分别挑选雌、雄亲虾各20尾,进行交配实验。本课题组选育的“兴海1号”核心群体(GX)具有长速快、耐氨氮及养殖适应性强等优点,以其为父母本(续代选育)分别同W、L、K、M的母本和父本杂交,成功构建了GX♀×W♂、GX♀×K♂、GX♀×M♂及W♀×GX♂、K♀×GX♂;以GX、W、L、K、M群体分别为父母本进行自交(保留纯系及提纯),构建了GX♀×GX♂、W♀×W♂、L♀×L♂、K♀×K♂、M♀×M♂;以长速快的W和K群体分别与养殖适应性强的L和M群体杂交,成功构建了W♀×M♂、K♀×M♂,因构建家系较困难和育苗过程中的其他因素导致仅成功构建及保留12个子代组合(表1)。孵化后,选取每尾雌虾孵化出的无节幼体约3 500尾,根据标准化育苗方式于500 L的桶中独自育至仔虾,而后移至独立水泥池进行标粗培育。培育体长至3 cm左右时,每个交配群体随机取900尾对虾进行荧光标记,将所有标记好的对虾置于长×宽×高为13 m×10 m×0.6 m的池内同环境养殖60 d。
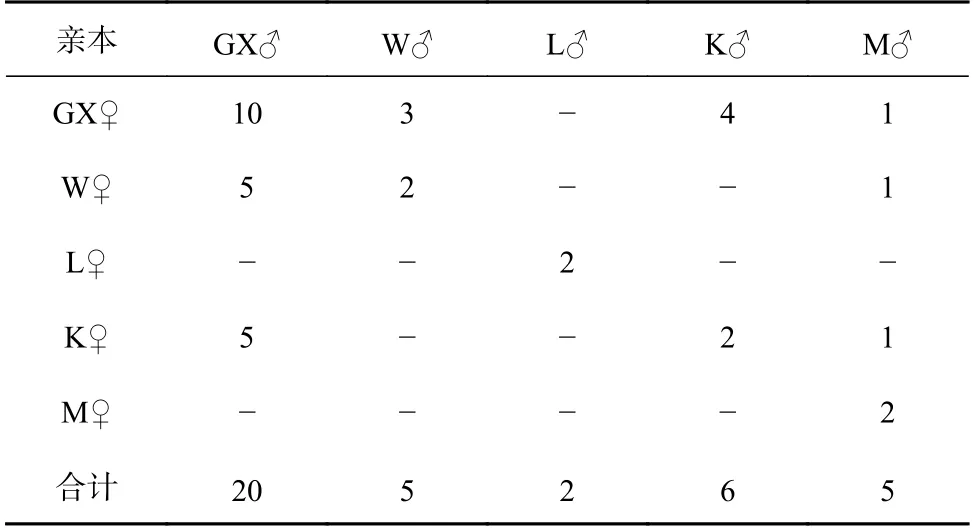
表1 凡纳滨对虾5个不同遗传背景群体的不完全双列杂交Table 1 Incomplete diallel crossing of five populations of Litopenaeus vannamei with different genetic backgrounds
2.2 高盐、低pH和高氨氮综合胁迫实验
2019年由国兴公司对凡纳滨对虾养殖土塘塘底水质指标进行监测,结果显示:盐度上限值为35,pH下限值为6,参照袁瑞鹏[24]的方法开展高氨氮胁迫预实验,确定同环境养殖60 d,48 h高氨氮胁迫半致死浓度(LC50%)为120 mg/L(铵根离子)。综合胁迫浓度的确定方式为控制盐度为35、pH为6±0.1,改变氨氮浓度(可变范围为1~120 mg/L),当半致死时间(LT50%)为48 h时对应的盐度、pH及氨氮浓度即为最终的综合胁迫浓度。
综合胁迫预实验:对虾同环境养殖60 d后,设置高盐为35、低pH为6±0.1,将高氨氮胁迫48 h的LC50%(120 mg/L)折中(60 mg/L),往1 mg/L或120 mg/L方向以间隔1 mg/L为梯度依次递增或递减,可递分为120个梯度,1次实验难以完成,因此,分40个梯度为1个大组(共3个组)。第1组为(1)由60 mg/L递减的20个浓度(盐度、pH和氨氮浓度)梯度分别为:35、6±0.1和60 mg/L;35、6±0.1和59 mg/L;35、6±0.1和58 mg/L;35、6±0.1和57 mg/L;35、6±0.1和56 mg/L;35、6±0.1和55 mg/L;35、6±0.1和54 mg/L;35、6±0.1和53 mg/L;35、6±0.1和52 mg/L;35、6±0.1和51 mg/L;35、6±0.1和50 mg/L;35、6±0.1和49 mg/L;35、6±0.1和48 mg/L;35、6±0.1和47 mg/L;35、6±0.1和46 mg/L;35、6±0.1和45 mg/L;35、6±0.1和44 mg/L;35、6±0.1和43 mg/L;35、6±0.1和42 mg/L;35、6±0.1和41 mg/L;35、6±0.1和40 mg/L;(2)由60 mg/L递增的20个浓度梯度分别为:35、6±0.1和61 mg/L;35、6±0.1和62 mg/L;35、6±0.1和63 mg/L;35、6±0.1和64 mg/L;35、6±0.1和65 mg/L;35、6±0.1和66 mg/L;35、6±0.1和67 mg/L;35、6±0.1和68 mg/L;35、6±0.1和69 mg/L;35、6±0.1和70 mg/L;35、6±0.1和71 mg/L;35、6±0.1和72 mg/L;35、6±0.1和73 mg/L;35、6±0.1和74 mg/L;35、6±0.1和75 mg/L;35、6±0.1和76 mg/L;35、6±0.1和77 mg/L;35、6±0.1和78 mg/L;35、6±0.1和79 mg/L;35、6±0.1和80 mg/L。其他两个组以此类推分别继续往前和往后递减和递增。3组预实验分开进行,先分别对第1组的40个梯度开展综合胁迫实验。调高盐、低pH及高氨氮的药品及测量仪器分别为:粗盐(盐度计折射仪HT211ATC)、1 mg/L HCl和1 mg/L NaOH[25](高精度pH测试笔ATC)和NH4Cl分析纯晶体(水质分析仪W-I)。预实验每个梯度设3个重复(每组30尾虾)于调好的实验海水中进行,因水体中的低pH会缓慢恢复正常,故每2 h调整1次实验海水pH并统计死亡数,并全程保持溶氧不低于6.0 mg/L,时间持续至对虾死亡过半为止。当高盐为35、低pH为6±0.1和高氨氮为70 mg/L时,由SPSS 19.0算出LT50%为47.31 h,最接近48 h,故将该3因子浓度作为综合胁迫的浓度(因在第1组中便确定了综合胁迫的浓度,故并未继续开展第2组和第3组预实验)。
综合胁迫正式实验:对虾暂养3 d后开始实验,由综合胁迫预实验确定的浓度开展正式实验,其他胁迫条件与综合胁迫预实验相同,每个群体随机取实验用虾90尾 (设3个重复,每组30尾)置于小筐中放于水深30 cm的池(长×宽:5 m×5 m)中进行综合胁迫。按交配组合群体排序,生长性状与耐综合胁迫性状一一对应,每2 h调一次实验海水pH、统计死亡数、记录存活时间并测量生长性状(用精度为0.01位的分析天平连接电脑自动录入体质量数据,数码相机拍照后用ImageJ软件测体长、头胸甲长及腹节全长),实验持续至全部对虾死亡时结束。
2.3 杂种优势及配合力估算
2.3.1 凡纳滨对虾生长及耐综合胁迫杂种优势
杂种优势的公式[7, 26-29]为
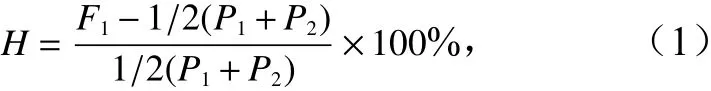
式中,F1、P1和P2分别表示亲本1和亲本2正反交子一代、亲本1自交子一代表型均值、亲本2自交子一代表型均值;H为正反交子一代杂种优势率。
2.3.2 凡纳滨对虾生长及耐综合胁迫性状的配合力分析模型
模型公式为

式中,yijk为第i个母本群体与第j个父本群体杂交的第k个个体的生长及耐综合胁迫性状的观测值;μ为总体均值;Dami为第i个群体母本的GCA;Sirej为第j个群体父本的GCA;Parentsij为第i个母本群体与第j个父本群体杂交的特殊配合力 (Specific Combining Ability, SCA);eijk为随机效应残差。
利用ASReml4[30]软件和亲本模型进行方差组分剖分及配合力估计。估计显著性时分别将亲本模型中的GCA或SCA 剔除掉,分别构建两个模型,用ASReml4软件中的lrt.asreml函数进行显著性检验,根据一般配合力和特殊配合力的显著性,决定是否进行下一步的LSD多重比较[31];参照文献[32-36]方法计算GCA方差、SCA方差分别占表型方差的比例。
3 结果与分析
3.1 凡纳滨对虾亲本群体的GCA
凡纳滨对虾5个不同遗传背景群体的GCA效应值见表2。结果显示:父本群体体质量、体长和头胸甲 长 的GCA范 围 分 别 为(-8.90×10-7±0.000 5)~(3.62×10-7±0.000 5)、(-9.34×10-6±0.003 3)~(5.22×10-6±0.003 3)、(-1.92×10-6±0.000 8)~ (2.03×10-6±0.000 8),母本群体体质量、体长和头胸甲长的GCA范围分别 为:(-1.23×10-6±0.000 5)~(5.31×10-7±0.000 5)、(-5.70×10-6±0.002 6)~(2.81×10-6±0.002 6)、(-2.71×10-6±0.000 8)~(1.24×10-6±0.000 8),均 较 接 近 于0;父母本群体耐综合胁迫的GCA范围为:(-0.93±1.687 87)~(1.46±1.614 2),其中父本群体的GCA范围为(-8.55×10-6±0.005 4)~(7.74×10-6±0.005 4),均较接近于0。

表2 凡纳滨对虾生长和耐综合胁迫性状的GCA效应值Table 2 GCA effect value of growth and comprehensive stress tolerance traits of Litopenaeus vannamei
3.2 凡纳滨对虾12个组合的SCA
凡纳滨对虾12个组合生长和耐综合胁迫性状的特殊配合力效应值见表3。结果显示:12个组合体质量、体长、头胸甲长和腹节全长的SCA范围分别为(-0.92±0.25)~(0.35±0.25)、(-5.82±1.35)~(2.02±1.60)、(-0.61±0.29)~(0.31±0.27)和 (-0.39±0.39)~(0.17±0.4),其中,组合K♀×K♂(0.35±0.25)、GX♀×W♂(0.31±0.22)和GX♀×M♂(0.29±0.29)体质量的SCA排名靠前;12个组合耐综合胁迫的SCA范围为(-2.79±2.02)~(3.65±1.79),其中组合GX♀×GX♂(3.65±1.79)、L♀×L♂(2.19±2.33)和W♀×GX♂(1.30±2.03)耐综合胁迫的SCA排名靠前。此外,母本群体生长(4.98×10-6%~0.43%)和耐综合胁迫(0.73%)及父本群体生长(5.00×10-6%~0.54%)和耐综合胁迫(5.08×10-6%)的GCA方差占表型方差的比例总体来说小于生长(0.25%~4.06%)和耐综合胁迫(1.43%)的SCA方差占表型方差的比例(表4),表明亲本的SCA对子代性状的表现起主导作用。

表3 凡纳滨对虾生长和耐综合胁迫性状的SCA效应值Table 3 SCA effect value of growth and comprehensive stress tolerance traits of Litopenaeus vannamei

表4 凡纳滨对虾生长和耐综合胁迫性状配合力的方差组分Table 4 The variance components of combining ability for growth and comprehensive stress tolerance of Litopenaeus vannamei
3.3 杂交组合生长和耐综合胁迫性状的杂种优势比较
杂交组合生长和综合胁迫耐受性杂种优势见图1。结果显示:6个杂交组合GX♀×W♂、GX♀×K♂、GX♀×M♂、W♀×GX♂、K♀×GX♂和K♀×M♂的体质量、体长、头胸甲长、腹节全长及耐综合胁迫性状的平均杂种优势率(H)范围分别为(-5.95%~25.525%)、(-1.00%~80.79%)、(-3.43%~24.90%)、(-4.14%~55.87%)和(-8.03%~42.86%),其中组合GX♀×K♂的体质量(-5.95%)、体长(-1.00%)、头胸甲长(-3.43%)、腹节全长(-4.14%)及耐综合胁迫(-8.03%)性状的H均为负值,其余均为正值。其中组合GX♀×W♂体质量的H最高(25.52%),组合K♀×M♂耐综合胁迫的H最高(42.86%),组合W♀×GX♂次之(41.72%)。

图1 凡纳滨对虾杂交组合生长和耐综合胁迫性状的杂种优势Fig. 1 Heterosis of growth and comprehensive stress tolerance in hybrid combinations of Litopenaeus vannamei
4 讨论
4.1 凡纳滨对虾生长和耐综合胁迫性状的配合力分析
配合力是杂交育种中评估杂交效果与筛选优良杂交组合的重要遗传参数;配合力又分一般配合(GCA)和特殊配合力(SCA),前者由基因的加性效应决定可稳定遗传[33,37];后者由基因非加性效应(显性、超显性及上位效应)决定不可稳定遗传[38],是产生杂种优势的必要条件[21,34,39]。对凡纳滨对虾配合力的研究已有相关报道[20-22],然而有关凡纳滨对虾耐综合胁迫配合力的研究未见报道,本研究以5个不同遗传背景的多世代选育凡纳滨对虾群体(具有较高纯度)为亲本构建子代组合,并尝试估计各组合耐综合胁迫和生长性状的配合力。结果显示,父本群体体质量、体长和头胸甲长的GCA分别为(-8.90×10-7±0.000 5)~(3.62×10-7±0.000 5)、(-9.34×10-6±0.003 3)~(5.22×10-6±0.003 3)、(-1.92×10-6±0.000 8)~(2.03×10-6±0.000 8),母本群体体质量、体长和头胸甲长的GCA分别为(-1.23×10-6±0.000 5)~(5.31×10-7±0.000 5)、(-5.70×10-6±0.002 6)~(2.81×10-6±0.002 6)、(-2.71×10-6±0.000 8)~(1.24×10-6±0.000 8),均较接近于0,父本群体耐综合胁迫性状的GCA为(-8.55×10-6±0.005 4)~(7.74×10-6±0.005 4),均较接近于0,与王浩等[20]报道的凡纳滨对虾7个群体生长性状GCA(-0.53~0.42)及胡志国等[21-22]报道的凡纳滨对虾父母本群体耐低溶氧与耐高氨氮及耐高盐与耐低盐的GCA(-0.215~0.152 2和-0.215 3~0.152 2)存在差异;与林明雪等[40]报道的多世代选育的高纯度“吉富”系列尼罗罗非鱼杂交,生长性状的GCA为0且表现出较高的杂种优势结果相似,推测选育亲本群体的GCA可能会随选育世代和遗传纯度的增加而逐渐趋近于0,具体原因还有待进一步的研究(包括对多代选育纯系内交配及多代选育纯系间杂交的配合力进行更加全面、详细的研究和探讨)。
利用LRT似然比进行配合力的显著性检验,发现GCA不显著,SCA显著,续而对SCA进行多重比较(LSD-t检验)。结果显示,组合K♀×K♂(0.35±0.25)、GX♀×W♂(0.31±0.22)和GX♀×M♂(0.29±0.29)体质量的SCA排名靠前、效应值为正且3组合的t检验差异不显著(p>0.05);组合GX♀×GX♂(3.65±1.79)、L♀×L♂(2.19±2.33)和W♀×GX♂(1.30±2.03)耐综合胁迫的SCA排名靠前、效应值为正且3组合的t检验差异不显著(p>0.05),说明前3个组合存在较高的体质量非加性效应,后3个组合存在较高的耐综合胁迫非加性效应。可考虑将组合K♀×K♂、GX♀×W♂和GX♀×M♂作为子二代快长的备选组合,将组合GX♀×GX♂、L♀×L♂和W♀×GX♂作为子二代耐综合胁迫的备选组合。该研究可为凡纳滨对虾配套系杂交提供参考资料,随着研究进一步的深入, 笔者后续将结合配合力评估凡纳滨对虾生长和耐受性能的三系、四系配套效果。
4.2 凡纳滨对虾生长和耐综合胁迫性状的杂种优势分析
杂种优势是两个不同群体的亲本杂交子代在繁殖、存活和生长等生活力方面优于亲本的现象[34],在生产上,被用来评估不同杂交方案的可行性。中国明对虾(Fenneropenaeus chinensis)杂交、凡纳滨对虾(L.vannamei)杂交,在生长性状上表现出杂种优势[29,41-42]。在本研究中,杂交群体GX♀×W♂、GX♀×M♂、W♀×GX♂、K♀×GX♂和K♀×M♂的体质量、体长、头胸甲长、腹节全长及耐综合胁迫的杂种优势均为正(0.10%~80.79%和6.87%~42.86%),说明杂交群体在生长及耐综合胁迫性状上表现出一定的杂种优势。Lu等[7]认为,大量的杂种优势可能是由于有利显性等位基因的积累或杂种中显性等位基因掩盖隐性有害等位基因而产生的;从近交使有害基因暴露的角度考虑,杂种优势仅是近交衰退的补偿,也就是说杂交子代不表现优势而可能表现劣势[23,43],田燚等[43]报道中国对虾两群体杂交,F1代早期群体YP♂×KN♀存活率表现出一定杂种优势,而群体YP♀×KN♂表现出杂种劣势;袁瑞鹏等[23]报道凡纳滨对虾群体杂交F1代群体YH♀×ZX♂低溶氧耐受性具有杂种优势,而群体ZK♀×YH♂低溶氧耐受性表现杂种劣势;在其他水产动物中,杂交子代也表现出杂种优势与杂种劣势[44]。在本研究中,杂交群体GX♀×K♂的体质量(-5.95%)、体长(-1.00%)、头胸甲长(-3.43%)、腹节全长(-4.14%)及耐综合胁迫(-8.03%)性状的H为负值,表现出一定的杂种劣势。总的来说,杂交中表现出的杂种优势表明,杂交对提高凡纳滨对虾生长和耐综合胁迫性状具有正向效应。此外,本研究筛选出组合GX♀×W♂体质量的H最高,为25.52%;组合GX♀×M♂体长、头胸甲长和腹节全长的H均最高,分别为80.79%、24.90%和55.87%;组合K♀×M♂耐综合胁迫的H最高,为42.86%,组合W♀×GX♂的次之,为41.72%,可考虑将组合GX♀×W♂和组合GX♀×M♂作为快长配套杂交的备选组合,将组合K♀×M♂和组合W♀×GX♂作为耐综合胁迫配套杂交的备选组合。
5 结论
本研究利用亲本模型分析了“兴海1号”新品种核心群体(GX)、泰国引进群体(W和L)和美国引进群体(K和M)5个凡纳滨对虾种质群体之间的GCA和SCA,并在此基础上分析了5个群体之间的杂种优势。结果显示,杂交后代生长和耐综合胁迫性状的表现主要受到亲本SCA的影响,杂交组合生长(体质量、体长、头胸甲长与腹节全长)和耐综合胁迫性状均表现出一定的杂种优势;杂交组合GX♀×W♂体质量的GCA和H最高;杂交组合W♀×GX♂耐综合胁迫的SCA最高且H较高,可考虑分别加强该两组合在生长和耐综合胁迫性状方面的配套杂交应用。

