婚姻状况对美国肺鳞癌患者的生存影响分析
王 颖,牟冬梅,2,杨鑫禹,王 悦,韩丝琪,王世申
1吉林大学公共卫生学院,吉林长春,130021;2吉林大学第一医院临床研究部,吉林长春,130021;3吉林省长春市疾病预防控制中心,吉林长春,130033
2020年全球肺癌新发病例220万例,全球癌症死亡病例996万例,其中因肺癌死亡人数180万例,肺癌发病率和死亡率分别居全球恶性肿瘤的第2位和第1位,远超过其他癌症类型[1]。肺癌5年生存率低于20%,非小细胞肺癌作为肺癌的一种,占肺癌总数的85%左右,而鳞状细胞癌是非小细胞肺癌中最常见的一种类型,占非小细胞肺癌的20%-30%,属第二大亚型[2]。
研究证明,肺癌患者的年龄、性别、手术治疗方式、肿瘤大小等是肺癌患者预后生存率的影响因素[3]。婚姻状况作为社会经济因素之一,近些年来与癌症预后的关系得到了众多学者的关注,婚姻状况已经被证明是直肠癌、肾癌、食管癌等多种癌症的重要预后因素[4-6]。但现有研究多数注重于未婚患者与已婚患者的比较,忽略其他婚姻状况对人群疾病预后产生的影响。SEER(surveillance, epidemiology and end results,SEER)数据库作为北美最具代表性的大型肿瘤登记注册数据库之一[7],收集了大量循证医学的第一手资料,本研究选取SEER数据库中肺鳞癌患者为研究对象,将婚姻状况进一步细化,探讨婚姻状况对肺鳞癌患者的生存影响。
1 资料来源与方法
1.1 资料来源
SEER数据库收集了美国数百万癌症患者的发病率、死亡率和患病情况等信息,是世界公认的肿瘤患者随访数据权威来源之一[7]。研究通过SEER* Stat软件检索SEER数据库中2010-2017年病理诊断为肺鳞状细胞癌的患者,共筛选出了31741 例患者信息。纳入标准:数据库中病理诊断为鳞状细胞癌;肿瘤部位为支气管与肺。排除标准:生存时间、种族、肿瘤大小、TNM分期信息随访资料不完整。
1.2 研究方法
研究提取的数据包括确诊时的年龄、性别、种族、婚姻状况、保险情况、肿瘤分化程度、肿瘤大小、肿瘤临床TNM分期、生存时间和生存状况。采用回顾性队列研究的方法,根据患者的婚姻状况将患者分为单身、未婚(有伴侣)、已婚、分居、离异、丧偶。以患者诊断为肺鳞状细胞癌为起点,将肺鳞癌患者的相关性死亡或本次随访结束作为研究终点。
1.3 统计学方法
使用SPSS 24.0进行数据分析。用Kaplan-Meier法计算生存率和中位生存时间并绘制生存曲线[8],使用Log-rank检验方法比较两组或多组患者的生存差异[9],Cox多因素分析计算风险比值(HR)及HR值95%置信区间。比较不同年龄、不同性别、不同TNM分期情况下,婚姻状况对患者预后生存的影响。
2 结果
2.1 调查对象基本情况
研究共纳入符合条件的研究对象31741例,其中单身4120例(13.0%),未婚有伴侣78例(0.2%),已婚16774例(52.8%),分居363例(1.1%),离异4210例(13.3%),丧偶6196例(19.5%)。见表1。
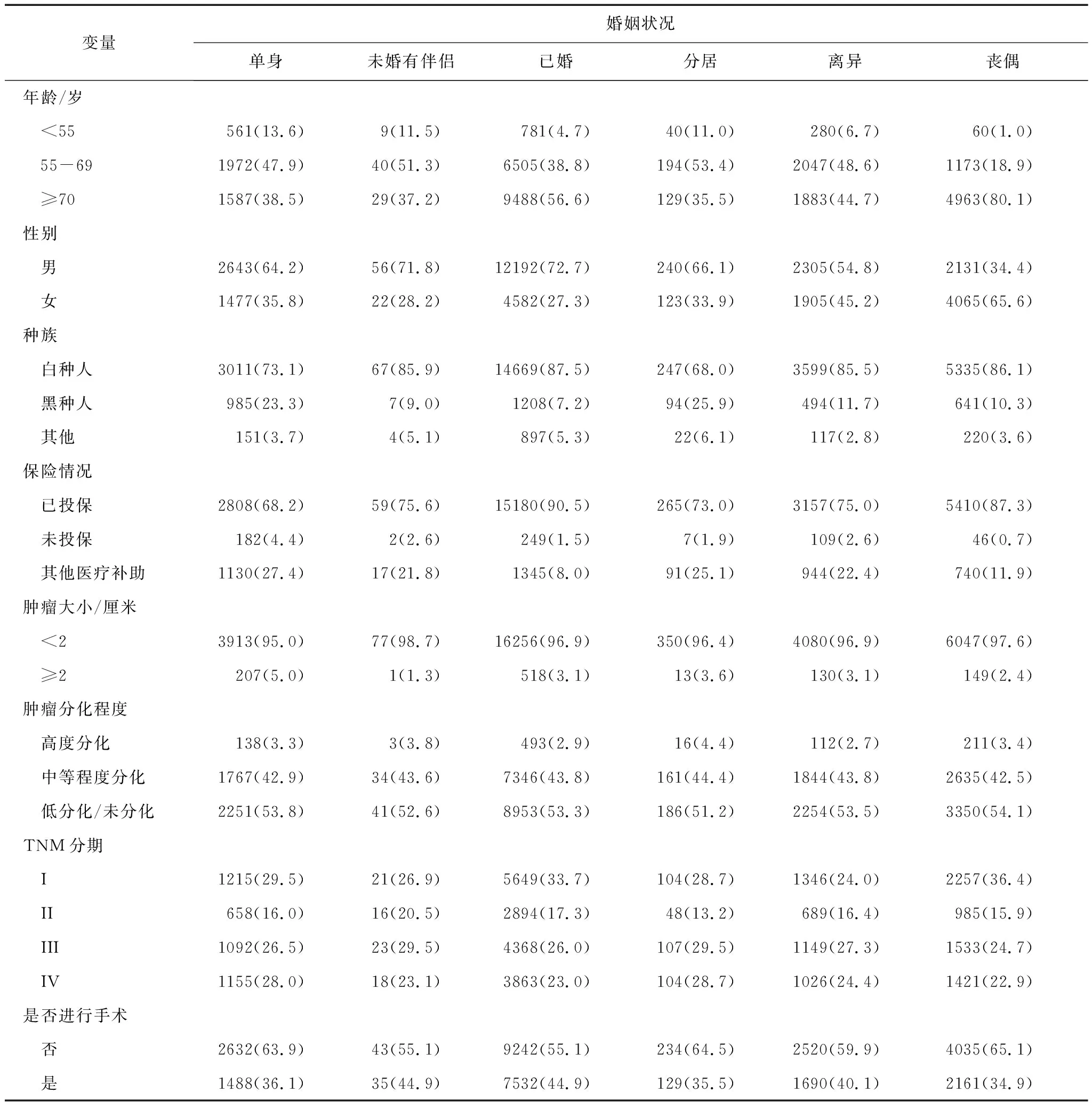
表1 肺鳞癌患者基线特征 n(%)
2.2 婚姻状况对肺鳞癌患者总生存期的影响
单因素分析中,不同婚姻状况患者生存曲线存在差异(χ2=163.05,P<0.01),未婚有伴侣的肺鳞癌患者中位生存期最长,单身患者最短。多因素分析结果显示,年龄、性别、种族、婚姻状况、保险状况、肿瘤大小、TNM分期、手术情况均为影响肺鳞癌患者预后生存的独立危险因素。见表2。

表2 肺鳞癌患者的单因素和多因素分析
鉴于不同婚姻状况患者的生存曲线存在差异(图1),为进一步确定哪两组之间存在差异,采用Log-rank检验中的两两比较。已婚患者与单身、分居、离异、丧偶患者生存率差异有统计学意义(P<0.05),离异患者与单身、丧偶患者生存率差异有统计学意义(P<0.05)。见表3。

表3 婚姻状况成对比较

图1 调整后的婚姻状况生存曲线
2.3 分层分析评估婚姻状况对总生存期的影响
为进一步探索婚姻状况对肺鳞癌患者总生存期的影响,研究分别按照年龄、性别、TNM分期进行分层,在每一层内分析婚姻状况与肺鳞癌的关联强度。
2.3.1 不同年龄下婚姻状况对总生存期的影响。<55岁中,已婚患者肺鳞癌死亡风险最小;55-69岁中,单身患者肺鳞癌死亡风险最高;≥70岁中,已婚患者和未婚有伴侣患者中位生存时间一致,且两组肺鳞癌死亡风险相比较差异无统计学意义。丧偶患者在年龄>70岁人群中的生存时间比单身、离异组短,但在70岁以下人群中生存时间则比另两组长。见表4。

表4 不同年龄婚姻状况对总生存期的影响
2.3.2 不同性别下婚姻状况对总生存期的影响。在性别亚组中,女性中位生存期比男性长,不同婚姻状况的生存曲线存在差异(χ2=214.38,P<0.01)。男性亚组中,已婚患者中位生存期最长,单身患者肺鳞癌死亡风险最高,离异组生存时间较丧偶组长。在女性亚组中,未婚有伴侣的患者中位生存期最长,丧偶患者肺鳞癌死亡风险最高。见表5。
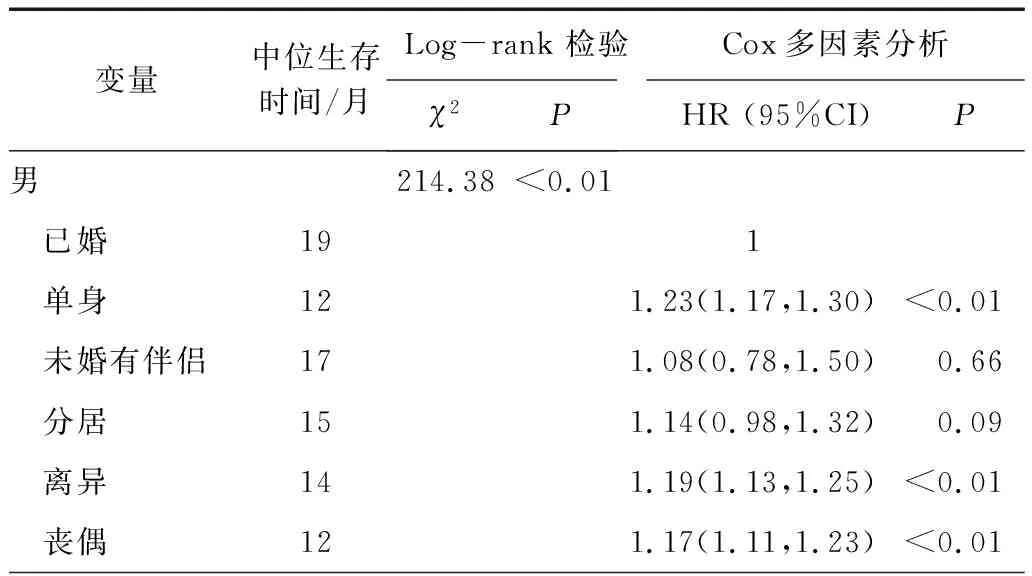
表5 不同性别下婚姻状况对总生存期的影响

表5(续)
2.3.3 不同TNM分期下婚姻状况对总生存期的影响。TNM分期越高,患者中位生存期越短,呈现逐期递减的趋势。TNM分期的I、II期中,未婚有伴侣的患者中位生存期最长;III期,已婚患者与未婚有伴侣的患者中位生存期相同;IV期,已婚患者中位生存期最长。已婚和未婚有伴侣患者的HR值均低于其他婚姻状况患者。TNM分期I-III期中,丧偶患者的生存时间均最短。见表6。
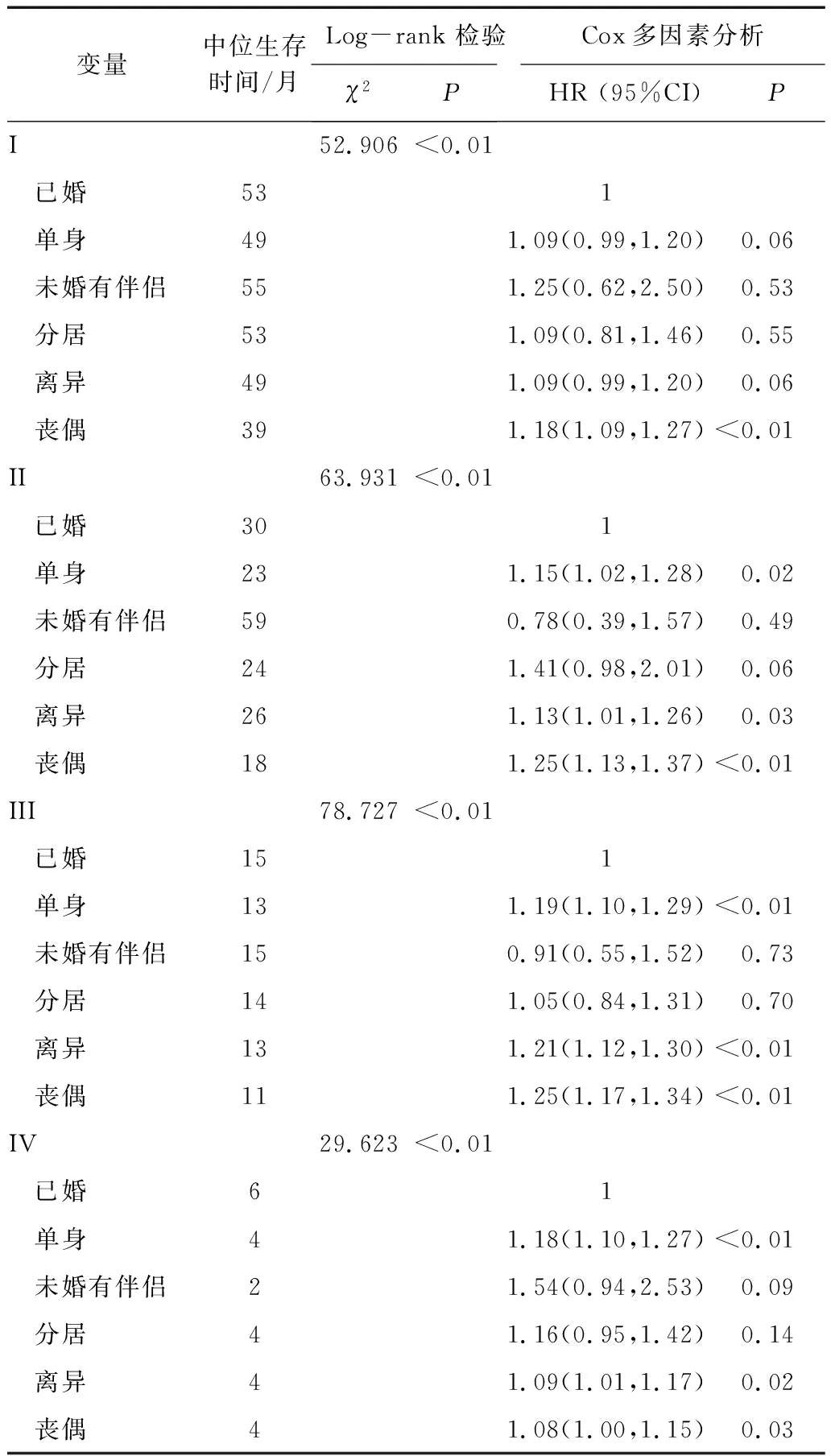
表6 不同TNM分期婚姻状况对总生存期的影响
3 讨论
3.1 已婚患者预后生存率较高
研究发现,年龄、性别、种族、婚姻状况、保险状况、肿瘤大小、TNM分期、手术情况为影响肺鳞癌患者生存期的独立预后因素。其中,已婚患者的生存时间较长,预后生存率较高,这与现有研究结果一致[10]。并且本研究在现有研究基础上将婚姻状况细化后发现未婚有伴侣患者生存期与其他分组患者相比也有生存期较长的现象。
3.2 婚姻状况影响患者的生活方式
调整后的生存曲线显示,已婚和未婚有伴侣组的生存率明显优于其他组,这与司光林等人的研究结果相似[11],说明良好的婚姻状况对个人健康有积极影响。未婚有伴侣和已婚患者都有配偶,生活更稳定,伴侣之间相互监督可以促进养成良好的生活习惯[12],发生癌症转移风险较低。研究发现,吸烟和酗酒现象在未婚和离异患者更常见[13]。此外,与未婚人士相比,已婚患者可能有更强的经济资源,商业保险投保人数比率达到了90%,并且经常参加健康体检,发现时多处于癌症早期,能得到及时治疗和护理。因此,倡导健康生活理念、培养良好卫生习惯显得尤为重要,建议大力开展全民健康生活方式宣传活动,普及健康知识和技能。
3.3 婚姻状况影响患者的治疗依从性
研究结果显示单身、分居、离异、丧偶患者死亡风险高、治疗依从性差,与现有研究结果相同[14],考虑可能是这类人群由于经济问题得不到足够的治疗,从而出现不依从现象。同时他们与已婚患者相比,没有伴侣的陪伴,加上缺乏社会支持[15-16],更容易对治疗产生逆反心理。研究中单身患者手术接受率为36.1%,而已婚患者手术接受率为44.9%,未婚患者对手术和放疗接受性较低,治疗依从性较差,从而导致了较差的预后结果[17]。对此,在制定治疗方案时,应该让患者参与进来,将被动治疗变为主动治疗,充分发挥其主观能动性。对单身、丧偶患者多给予引导协助,与患者形成彼此信任的关系。
3.4 婚姻状况影响患者的心理健康
诊断为癌症比诊断为其他疾病可能对患者引起更大的心理困扰[18]。已婚患者由于有配偶的照顾和支持,心理困扰、抑郁和无助的发生率低于未婚患者。在对性别、TNM分期亚组分析中,发现部分分组丧偶患者生存时间显著低于单身组、离异组,出现这种现象的原因可能是丧偶患者在失去配偶后极度悲伤从而产生消极心理。男性丧偶患者生存期仅12个月,比女性丧偶患者死亡风险更高,这与多数研究结果相同[5-6]。未婚患者由于缺乏支持、患病后心理压力增大,进而影响免疫和内分泌系统功能,加速肿瘤的生长,患者死亡率也进一步升高。鉴于此,在癌症防治时,还应重点关注患者的心理健康状况,增进医生与患者之间的交流,及时疏解患者不良情绪。
本研究存在一定的局限性。首先,SEER数据库只提供了诊断时的婚姻信息,并未提及患者确诊为癌症后婚姻状况是否发生了变化,婚姻状况的变化极有可能影响到患者的预后。第二,现有文献中已知的几个影响因素(如教育、社会经济地位和生活习惯等)并未包括在SEER数据库中。

