HFHD治疗对糖尿病肾病患者临床疗效及IL⁃6、SOD水平的影响
李仪静 曾继兰 尤小英 秦洪祥
糖尿病肾病分为5 期,早期(1~3 期)无明显不适症状,可能伴有尿频,发展至晚期(5 期)会逐渐出现头晕、乏力、水肿、恶心呕吐、下肢浮肿、蛋白尿等症状,长期蛋白尿会引起机体蛋白质代谢失调,引起低蛋白血症,甚至造成尿毒症[1⁃2]。由于糖尿病肾病病情进展十分迅速,临床上尽早诊断、及时治疗,才能有效阻止患者病情的恶化,从根本上提高患者的生存质量[3]。目前,临床上对于终末期肾病常用的治疗方法为血液透析。然而,血液透析虽可以替代肾脏进行排毒、维持水电解质紊乱,但长期透析会引起心律失常、肾性贫血等并发症[4]。有研究发现,高通量血液透析(high⁃flux hemodialy⁃sis,HFHD)相较于常规的透析器,能更有效地减轻患者体内的炎症反应和血管内皮变化,保护残存的肾功能,降低心血管疾病等并发症的发生[5]。本文将分析HFHD 治疗对糖尿病肾病患者临床疗效及白介素⁃6(Interleukin⁃6,IL⁃6)、超氧化物歧化酶(Superoxide dismutase,SOD)水平的影响。
1 资料与方法
1.1 一般资料
选取2020年2月至2021年2月重庆市大足区人民医院收治的116 例糖尿病肾病患者设为研究对象。纳入标准:①均符合《糖尿病肾脏疾病临床诊疗中国指南》诊断标准[6];②均处于终末肾病期需要进行血液透析治疗;③血液透析时间≥3 个月;④患者与家属均已签署知情同意书。排除标准:①存在严重心率失常、心衰患者;②入院前1 个月出现严重出血患者;③重要脏器功能障碍、凝血功能障碍者;④精神疾病患者。根据不同血液透析方法分为对照组(低通量血液透析,52 例)和观察组(高通量血液透析,64 例)。两组一般资料比较,差异无统计学意义(P>0.05),见表1。本研究经院医学伦理委员会批准通过。
表1 两组一般资料比较[n(%),(±s)]Table 1 Comparison of general information between the two groups[n(%),(±s)]
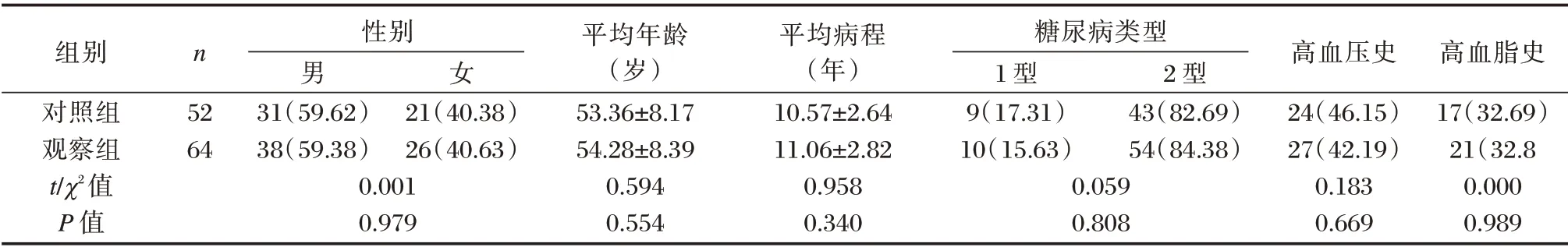
表1 两组一般资料比较[n(%),(±s)]Table 1 Comparison of general information between the two groups[n(%),(±s)]
组别对照组观察组t/χ2值P 值n 52 64性别男31(59.62)38(59.38)0.001 0.979女21(40.38)26(40.63)平均年龄(岁)53.36±8.17 54.28±8.39 0.594 0.554平均病程(年)10.57±2.64 11.06±2.82 0.958 0.340糖尿病类型1 型9(17.31)10(15.63)0.059 0.808 2 型43(82.69)54(84.38)高血压史24(46.15)27(42.19)0.183 0.669高血脂史17(32.69)21(32.8 0.000 0.989
1.2 治疗方法
两组患者入院后,医护人员统一普及相关疾病知识,积极控制血糖,降低血压,调节血脂,严格控制患者饮食,限制蛋白质和钠盐的摄入,正确指导患者用药和运动等。对照组采用低通量血液透析,应用德国Gambro 中空纤维透析器[型号:Polylux 14L,膜面积:1.4 m2,超滤系数:10 mL/(mmHg*h)]。观察组采用HFHD,应用日本尼普洛中空纤维透析器[型号:FB⁃170U,膜面积:1.7 m2,超滤系数:30 mL/(mmHg*h)]。两组患者透析期间均设定透析频次为1 周3 次,每次4 h,血流量为200~300 mL/min,采用常规肝素抗凝,均连续透析6 个月,透析期间注意谨遵医嘱。
1.3 观察指标
1.3.1 临床疗效
两组患者治疗6 个月后,根据临床症状、肾功能、血糖及精神状况等情况作为临床疗效评估标准[7]。显效:患者临床症状完全消失,肾功能指标下降60%以上,血糖稳定,精神状态好;有效:患者临床症状改善明显,肾功能指标下降40%~60%,血糖正常或空腹血糖在7.8 nmol/L 以内,精神状态良好;无效:未达到以上标准,或病情恶化。总有效率=[(显效+有效)/总病例数]×100%。
1.3.2 肾功能情况
分别采集所有患者治疗前、治疗后3 个月和治疗后6 个月的空腹静脉血样8 mL,离心后分离血清样本,置于低温环境中待检。采用全自动血细胞分析仪检测血尿素氮(Blood urea nitrogen,BUN)、血清肌酐(Serum creatinine,Scr)。
1.3.3 抗氧化作用
同理采集治疗前和治疗后6 个月的空腹静脉血样,应用双抗夹心酶联免疫吸附法检测过氧化物歧化酶(Peroxide dismutase,SOD)、丙二醛(Oxide dis⁃mutase,MDA)、谷胱甘肽过氧化物酶(GSH⁃Px)。
1.3.4 炎症因子
与上述方法一致检测血清中白介素⁃6(Inter⁃leukin⁃6,IL⁃6)、超敏c 反应蛋白(hypersensitive C⁃reactive protein,hs⁃CRP)、肿瘤坏死因子⁃α(Tumor Necrosis Factor⁃α,TNF⁃α)。
1.3.5 并发症
比较两组治疗期间发生心血管事件(高血压、心绞痛、心力衰竭、心肌缺血)、恶心呕吐、抽搐、昏迷等并发症发生率。
1.4 统计学方法
采用SPSS 22.0 统计软件包进行统计处理。计量资料以(±s)表示,行t检验;计数资料以n(%)表示,行χ2检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床疗效比较
治疗后6 个月,观察组总有效率明显高于对照组,差异有统计学意义(P<0.05)。见表2。
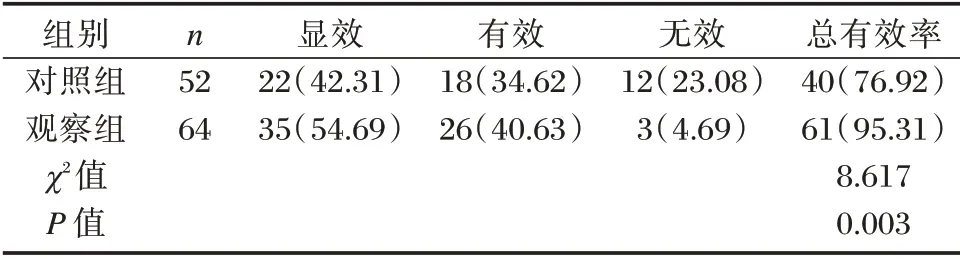
表2 两组临床疗效比较[n(%)]Table 2 Comparison of clinical efficacy between the two groups[n(%)]
2.2 两组肾功能指标比较
与治疗前相比,治疗后3 个月和治疗后6 个月两组患者的BUN、Scr 水平均明显降低,且观察组各指标下降幅度明显大于对照组,差异均有统计学意义(P<0.05)。见表3。
表3 两组治疗前后肾功能指标比较(±s)Table 3 Comparison of renal function indexes of patients before and after treatment between the two groups(±s)

表3 两组治疗前后肾功能指标比较(±s)Table 3 Comparison of renal function indexes of patients before and after treatment between the two groups(±s)
注:与治疗前比较,aP<0.05;与治疗后3 个月比较,bP<0.05。
分组对照组观察组t 值P 值n 52 64 BUN(mmol/L)治疗前25.18±6.37 24.83±6.24 0.298 0.767治疗后3 个月21.43±6.05a 18.25±5.68a 2.912 0.004治疗后6 个月16.41±4.82ab 11.25±3.14ab 6.944<0.001 Scr(μmol/L)治疗前893.17±154.21 896.34±155.62 0.110 0.913治疗后3 个月782.62±140.59ab 731.19±128.43ab 2.056 0.042治疗后6 个月663.51±132.67ab 607.26±122.0564.93ab 2.346 0.021
2.3 两组抗氧化指标比较
治疗后6个月,两组患者SOD、GSH⁃Px均显著上升,且观察组高于对照组,MDA 明显降低,且观察组低于对照组,差异均有统计学意义(P<0.05)。见表4。
表4 两组治疗前后抗氧化指标比较(±s)Table 4 Comparison of oxidation indicators of patients before and after treatment between the two groups(±s)
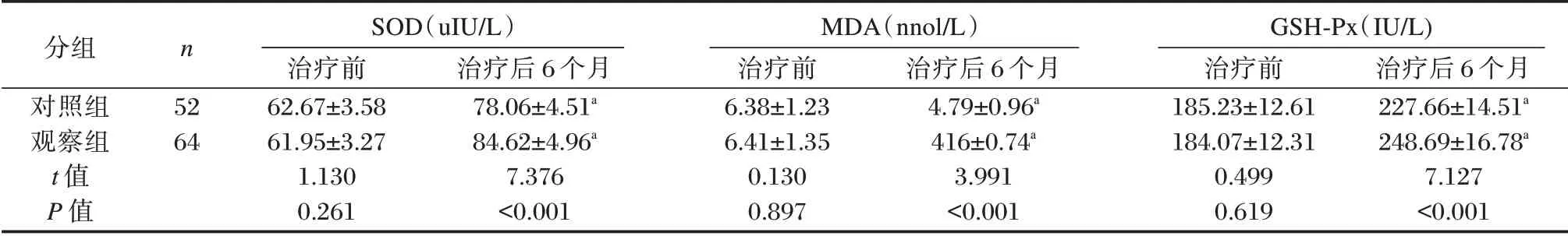
表4 两组治疗前后抗氧化指标比较(±s)Table 4 Comparison of oxidation indicators of patients before and after treatment between the two groups(±s)
注:与治疗前比较,aP<0.05。
分组对照组观察组t 值P 值n 52 64 SOD(uIU/L)治疗前62.67±3.58 61.95±3.27 1.130 0.261治疗后6 个月78.06±4.51a 84.62±4.96a 7.376<0.001 MDA(nnol/L)治疗前6.38±1.23 6.41±1.35 0.130 0.897治疗后6 个月4.79±0.96a 416±0.74a 3.991<0.001 GSH⁃Px(IU/L)治疗前185.23±12.61 184.07±12.31 0.499 0.619治疗后6 个月227.66±14.51a 248.69±16.78a 7.127<0.001
2.4 两组炎性因子水平比较
治疗后6 个月,两组患者各炎性因子IL⁃6、hs⁃CRP、TNF⁃α 水平均显著下降,且观察组患者下降更明显,差异均有统计学意义(P<0.05)。见表5。
表5 两组炎性因子水平比较(±s)Table 5 Comparison of the levels of inflammatory factors between the two groups(±s)
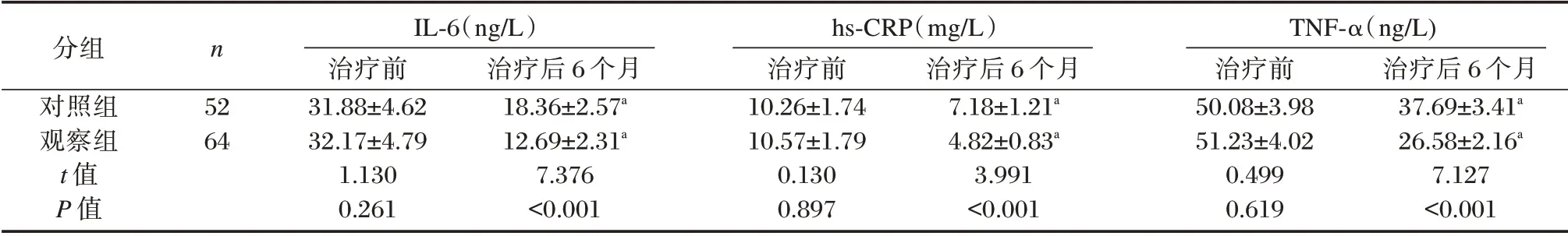
表5 两组炎性因子水平比较(±s)Table 5 Comparison of the levels of inflammatory factors between the two groups(±s)
注:与治疗前比较,aP<0.05。
分组对照组观察组t 值P 值n 52 64 IL⁃6(ng/L)治疗前31.88±4.62 32.17±4.79 1.130 0.261治疗后6 个月18.36±2.57a 12.69±2.31a 7.376<0.001 hs⁃CRP(mg/L)治疗前10.26±1.74 10.57±1.79 0.130 0.897治疗后6 个月7.18±1.21a 4.82±0.83a 3.991<0.001 TNF⁃α(ng/L)治疗前50.08±3.98 51.23±4.02 0.499 0.619治疗后6 个月37.69±3.41a 26.58±2.16a 7.127<0.001
2.5 两组并发症发生率比较
血透期间,观察组并发症总发生率明显低于对照组,差异有统计学意义(P<0.05)。见表6。
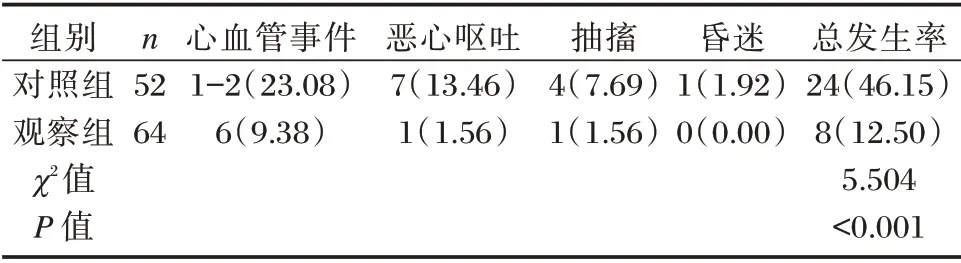
表6 两组并发症发生率比较[n(%)]Table 6 Comparison of the incidence of complications between the two groups[n(%)]
3 讨论
血液透析是治疗糖尿病肾病较为成熟的一种方法,但传统的低通量血液透析对糖尿病肾病患者的治疗效果低于其他血液透析方法[8]。研究显示,低通量血液透析治疗疗效欠佳与患者炎症反应、氧化应激反应过高有关[9]。本文主要研究分析HFHD治疗对糖尿病肾病炎症因子及氧化应激的影响。
近年来,临床上对于肾功能衰竭者常采用HFHD治疗,其半透膜有着超滤系数大、生物相容性好、疏水性、膜面积大等优势,能有效促进患者改善糖、脂代谢紊乱,提高患者生活质量[10]。本文结果显示,治疗后半年,观察组患者的治疗总有效率显著高于对照组,考虑原因为HFHD 透析膜通量大,对体内中、大、小分子毒素均有较高的清除率,更有利于减少毒素的堆积及降低并发症发生率,从而起到提高临床治疗有效率的效果。本文结果显示,治疗后观察组BUN、Scr 水平均明显低于对照组,表明HFHD 能有效减轻肾脏的负担,提高血液透析效果,与高楠等[11]研究结果一致。
相关文献报道称,糖尿病肾病病情进展至终末期常伴随异常增多的炎症因子表达,而长期透析带来的自身代谢紊乱、透析液的微生物污染、透析膜的生物不稳定性等问题,可进一步加重机体炎症状态和氧化应激反应,可能导致心脑血管疾病等并发症,影响患者预后[12]。既往黄佳媛[13]研究结论证实:糖尿病肾病患者接受HFHD 治疗更能有效减轻氧化应激及微炎症状态。本文研究结果显示,观察组SOD、GSH⁃Px 水平均明显高于对照组,MDA 以及炎性因子均显著低于对照组,提示HFHD 更有利于改善糖尿病肾病患者机体应激及炎性反应,与上述黄佳媛研究结果一致。HFHD比低通量血液透析的生物相容性更好,更能减少患者炎性反应及补体激活,同时还更能改善患者的骨髓造血功能,促进患者体内中分子及大分子毒素水平的降低,清除患者体内中分子炎症因子,有效改善患者慢性微炎症状态[14]。
彭李等[15]认为糖尿病肾病患者的预后与炎性因子、抗氧化物等有密切联系。本研究发现,血透期间观察组并发症总发生率明显低于对照组,提示HFHD 能有效降低患者并发症的发生,与既往研究报道相符[16]。笔者认为:低通量血液透析由于自身透析膜的孔径限制,对大分子的炎症因子滤过作用不显著,因而可能导致并发症发生增加,影响远期预后,而HFHD 通过弥散、吸附作用清除毒素,可有效清除炎症因子,改善机体炎症状态,降低心脑血管疾病等并发症发生,有利于预后。
综上所述,HFHD 更有利于保护糖尿病肾病患者肾功能,可更大程度降低患者IL⁃6、hs⁃CRP、TNF⁃α等炎性因子及并发症发生,具有更好的抗氧化应激作用,且具有一定安全性,值得临床推广使用。

