海洋微生物培养新技术研究进展
周春云,张琪,张瀚文,杨昊翼,陆园园
(中国药科大学海洋药学教研室,江苏 南京 211198)
海洋微生物作为一种重要的生物活性天然产物来源,具有种类多、蕴藏量大、可再生的优点,在制药领域备受关注。在过去的10 ~ 15年,基因组学和代谢组学研究表明地球上微生物的生物合成能力远超预期,绝大多数微生物(>95%)含有在实验室培养条件下保持沉默的活性天然产物生物合成基因簇(BGC)[1]。据估计,仅有0.1% ~ 1%的微生物多样性产物已在实验室中成功表达。由于许多生物合成基因在标准培养条件下无法表达,直接限制了通过简单的发酵方法获得的微生物天然产物的多样性[2-3]。前期,研究人员通过单菌多次级代谢产物(OSMAC)方法[4],可有效地诱导微生物产生次生代谢产物,并已取得了不错的研究结果。然而,近年来发现新的化学结构和生物活性物质的几率仍持续下降,为了克服传统培养方法的不足之处,新的微生物培养技术应运而生,主要包括共培养、高通量培养、诱捕器原位培养筛选以及土壤基质膜系统等。本文主要对近年来上述4种方法的研究案例进行归纳总结,希望能为未来微生物培养技术发展提供借鉴,以期发现更多的新型天然产物。
1 共培养方法
共培养技术的研究策略主要包括不同真菌共培养、真菌与细菌共培养以及不同细菌共培养[5]。无论哪一种策略,选取不同来源的微生物,并细化传统的培养方法,通过在培养基中加入不同的媒介,包括使用非传统电子供体、电子受体和碳源等[6],都可以刺激海洋微生物产生不一样的次生代谢产物。近年来,通过共培养海洋微生物得到的多种代谢产物,按化学结构分类可分为生物碱类、蒽醌类、环肽类、黄酮类、大环内酯类、苯丙素类、聚酮类、类固醇类、萜类等[5]。
1.1 生物碱类
2017年,Bao等[7]将海洋真菌Aspergillus sclerotiorumSCSGAF0053的 孢 子(1 mL,约108 CFU · mL-1)和Penicillium citrinumSCSGAF0052的孢子在PDA琼脂培养基上静态孵育30 d(28 ℃)。孵育过程中观察到混合发酵液中出现了纯培养时所没有的独特红色色素,提示新的生物合成途径被激活。将共培养液进行纯化鉴定,得到6个新化合物,包括2个呋喃酮衍生物sclerotiorumins A和B(1 ~ 2)、1个 新 型 的二 氮 衍 生 物sclerotiorumin C(3)、1个吡咯衍生物1-(4-benzyl-1H-pyrrol-3-yl)ethanone(4)和2个 新 曲 霉 酸 的配 合 物aluminiumneohydroxyaspergillin(5) 和ferrineohydroxyaspergillin(6)。所有化合物在菌株单独培养时均未产生。
2018年,El-Hawary等[8]将来自红海海绵的2种放线菌Saccharomonosporasp. UR22和Dietziasp.UR66在无菌海水中冲洗,切成约1 cm3的小块,加入10倍体积的无菌海水,在无菌砂中彻底均质。将上清按10倍、100倍、1 000倍稀释,然后在琼脂平板上涂布。采用M1、ISP2培养基,寡养培养基(OLIGO),放线菌选择性分离合成培养基(AIA)和海洋琼脂类培养基(MA)对放线菌进行分离。30℃孵育6 ~ 8周后,在混合发酵培养液中鉴定了4个生物活性物质,包括2个新型的生物碱类化合物saccharomonosporine A(7)和convolutamydine F(8),这2个代谢物在2种微生物单独培养时均未检测到。
1.2 蒽醌类
2018年,Mandelare等[9]将海洋来源的曲霉菌Aspergillus alliaceus的2种不同发育表型分别在琼脂平板上培养,然后接种到50 mL麦芽液体培养基中。2周后,将2种培养物混合,加入到1 L的麦芽液体培养基中,在28℃、110 r · min-1条件下的振荡培养箱上培养30 d。发现其代谢谱发生显著改变,产生了3个蒽醌类化合物allianthrone A、B、C(9 ~11),其中化合物10和11为一对非对映异构体。
2019年,Abdel-Wahab等[10]将海绵相关真菌Aspergillus versicolor和Bacillus subtilis在静态的大米固体培养基上进行共培养。同时,Aspergillus versicolor与Bacillus subtilis也分别在大米固体培养基进行无菌培养。通过在溶菌肉汤(LB)中过夜培养细菌来制备枯草芽孢杆菌,然后将其接种到的LB液体培养基中,在37℃下以200 r · min-1的速度振荡培养至指数生长期。将细菌培养物加入高压灭菌的水稻固体培养基中,在37℃下培养4 d。将生长出Aspergillus versicolor的麦芽琼脂切成块,加入到已经用枯草芽孢杆菌孵育的各个锥形瓶中。对照以及共培养物在23℃的静态条件下生长,在达到生长的稳定期后,加入乙酸乙酯终止培养物的生长。对共培养产物进行分离鉴定,得到2个新的蒽醌类化合物(Z)(11S,12R)-versicolorin B(12)和6,8-O-dimethylbipolarin(13)。

1.3 环肽
将2种红树林真菌Phomopsissp. K38和Alternariasp. E33菌株在固体玉米粉海水琼脂的斜面上培养,然后将带有菌丝体的琼脂切片,在无菌条件下转移到含有100 mL液体培养基(葡萄糖1%、蛋白胨0.5%、酵母提取物0.1%和NaCl 3%)的250 mL锥形瓶中,锥形瓶在30℃旋转振荡器上培养7 d。同时,将每种真菌的菌丝体转移到含有培养液的锥形瓶中,锥形瓶在30℃下培养25 d 。从混合发酵产物中纯化并鉴定出3个新的环四肽类化合物,分别命名为cyclo-(L-leucyl-trans-4-hydroxy-L-prolyl-D-leucyl-trans-4-hydroxy-L-proline)[11](14)、icyclo(D-Pro-L-Tyr-L-Pro-L-Tyr)(15) 和 cyclo-(Gly-LPhe-L-Pro-L-Tyr)[12](16)。
2014年,Ebada等[13]将从褐藻中分离出的2种海洋藻类衍生真菌Aspergillussp. BM-05和BM-05ML的共培养物在10个1L锥形瓶(锥形瓶中培养基每瓶500 mL,包括大豆0.4%、玉米粉1%、MgSO40.36%、NaCl 2%、酵母提取物0.2%和CaCO30.18%,使用软化水配制而成)中,28℃下,静态培养4周。然后将平板培养的琼脂块接种到培养基中,当发现分生孢子有深褐色色素生成时即达到发酵时间,并从中分离出1个新的环三肽类化合物psychrophilin E(17)。

1.4 大环内酯类
2019年,Yu等[14]使用ISP2培养基(麦芽提取物1%、无水葡萄糖0.4%、酵母提取物0.4%和1 L人工海水,pH值7.0),在28℃,180 r · min-1条件下,共培养放线菌S.rocheiMB037和真菌R.similis35。在第3 d,将200 mL放线菌培养物接种到200 mL真菌培养物中启动共培养实验。利用反相高效液相色谱(HPLC)分析对比共培养和单一培养之间次级代谢产物产生的变化。培养11 d后,提取共培养物,得到12 g的红棕色油状物质,并从中成功分离出5个代谢物,包括2个新的脂肪酸borrelidins J和K(18 ~ 19)。Borrelidins J和K只在共培养物中获得,且为自然界中罕见的含氮脂肪酸。

1.5 苯丙素类
研究人员在玉米粉海水琼脂培养基上,共培养红树林真菌Phomopsissp. K38和Alternariasp. E33。切断菌丝生长的琼脂块,加入到含有100 mL液体培养基(葡萄糖1%、蛋白胨0.5%、酵母提取物0.1%和NaCl 3%)的250 mL锥形瓶中。将锥形瓶在旋转振荡器上30℃孵育5 ~ 7 d,将菌丝体无菌转移到含有培养液(200 mL)的锥形瓶中,30℃孵育25 d。在混合物中发现了2个苯丙素类化合物ethyl-5-ethoxy-2-formyl-3-hydroxy-4-methylbenzoate[15](20)和8-hydroxy-3-methyl-9-oxo-9H-xanthene-1-carboxylic acid methyl ether[16](21),其中化合物21对植物病原菌禾蓝菌、枯萎病菌、炭疽菌和疫霉菌表现出广谱的抗菌活性。

1.6 聚酮类
2013年,Kossuga等[17]在2%的麦芽培养基中于25℃,100 r · min-1条件下,共培养海源真 菌Penicilliumsp. Ma(M3)V和Trichodermasp.Gc(M2)1,以相同条件下每种真菌的单独培养作为对照,发现共培养产物中增加了2个新的聚酮类化合物(Z)-2-ethylhex-2-enedioic acid(22)和(E)-4-oxo-2-propylideneoct-7-enoic acid(23)。这2种新发现的聚酮都含有共轭羧酸基团,是通过海洋微生物共培养方法诱导产生新颖碳骨架结构的极好案例。

2018年,Anjum等[18]将2株来自海洋土壤样品的海洋细菌Janthino bacteriumsp. ZZ145和ZZ148在水稻固体培养基中进行共培养,并对共培养产物进行纯化鉴定,得到了2个新的聚酮类化合物janthinopolyenemycins A和B(24 ~ 25),两者对白色念珠菌具有相同的抑菌活性。

1.7 类固醇
2014年,Ebada等[19]将 海 藻 来 源 真 菌Aspergillussp. BM05和一种未知的细菌BM05BL置于锥形瓶中,于28℃静态条件下共培养4周。培养基(由大豆蛋白胨0.4%、玉米粉1%、MgSO40.36%、NaCl 2%、酵母提取物0.2%、CaCO30.18%和去离子水配制而成)在121℃下灭菌20 min,冷却后接种来自铺板培养物的琼脂块。观察到分生孢子产生深色色素即达到发酵时间,从共培养液中分离出1个新的类固醇类化合物7β-hydroxycholesterol-1βcarboxylic acid(26)。

1.8 萜类
2012年,Cho等[20]将从韩国深海藻类根部分离的海洋放线菌Streptomyces cinnabarinusPK209在TBFeC介质(胰蛋白胨0.3%、酪蛋白胨0.5%、葡萄 糖0.4%、Fe2(SO4)3· 4H2O 0.004%、KBr 0.01%、琼脂1.8%和海水1 L,pH值为7.8)中培养96 h,加入少量培养16 h的竞争菌株Alteromonassp. KNS-16,发现可诱导二萜环丙烯醇的快速产生,终产量是PK209单独培养时的10.4倍。
2020年,Meng等[21]将2种海洋来源真菌P.bilaiaeMA-267和P. chermesinumEN-480分别接种于PDA培养基中,28℃下生长4 d,然后将EN-480接种到1 L锥形瓶中(每个含有100 mL大米培养基,包括大米7%、蛋白胨0.03 %、0.01%玉米糖浆和100 mL过滤海水),在室温下培养3 d,将MA-267无菌转移到含EN-480的各个培养瓶中,室温下孵育28 d。从共培养产物中分离并鉴定了2个新的美硫萜衍生物chermebilaenes A和B(27 ~ 28),以及3个已知的倍半萜。值得注意的是,化合物27代表了一类前所未有的腺烷型倍半萜与十八碳二烯酸的杂交骨架,它被证明是一种对抗水生病原体或植物病原体的抗生素[21]。

2 高通量培养法
2.1 灭绝培养高通量培养法
1993年,Button等[22]首次提出了灭绝培养(extinction culturing)的概念,并分离培养出了2种新的寡营养浮游细菌,即Sphingomonas alaskensis和Cyclo-clasticus oligotrophus。Connon等[23]在此基础上建立了高通量培养法(high-throughput culturing),即将接种物在天然海水培养基中稀释到痕量后,以每孔1 mL的量填充至48孔微滴定板,在要求的时间和条件下进行培养之后,使用细胞阵列检测生长情况。
随着该方法的发展,Huber等[24]在2009年构建了一种高通量自动化培养平台。该平台能够将进行系统性高通量实验的反应器和分析处理系统进行结合,实现自动化。
2020年,Benítez等[25]利用液体处理机器人EVO100将海绵(Haploscler-idaorder)匀浆接种在被海生菌肉汤培养基(marine broth)填充的384孔聚苯乙烯板中,28℃下280 r · min-1孵育5 d,以选择性培养Labrenzia(拉布伦茨氏菌)属的菌株。使用POLARstar Omega读数器检测培养孔600 nm处的OD值,当OD值达到0.3后,利用液体处理机器人MicroLab Star从384孔板中回收培养物,并接种到被新鲜海生菌肉汤培养基填充的96孔板上,28℃下280 r · min-1孵育5 d,以诱导菌株产生次级代谢产物。对次级代谢产物进行分析后得到一个类似pederin的化合物(29)。

2.2 微包埋高通量培养法
2002年,Zengler等[26]首次将微包埋技术应用于海洋浮游微生物的培养与分离。该技术将细胞封装在稀释的细胞悬浮液与预热琼脂糖混合处理后形成的凝胶微滴中,在低营养条件下进行大规模平行微生物培养,然后通过流式细胞仪检测含有微菌落的微滴,实现高通量培养。2006年,Akselband等[27]成功利用微包埋技术从混合样品中培养分选出生长缓慢的海洋微生物。
微包埋技术还可以与其他微生物培养技术结合,进而实现没有被成功培养的海洋微生物的分离与培养。例如2009年,Aoi等[28]利用凝胶微滴包埋微生物细胞,并将其置于中空纤维室[29]中,在模拟自然环境的条件下培养,使用细胞分类系统对含有微菌落的凝胶微滴分类后进行后续培养,实现高通量培养。
2.3 扩散盒高通量培养法
扩散室是由孔径0.03 mm的聚碳酸酯膜覆盖垫圈的顶部和底部,形成一个与环境隔离的腔室。微生物稀释后,与含有海水的温琼脂混合,放置在扩散室中培养,并将扩散室放置在自然环境中。聚碳酸酯膜会限制细胞的移动,但是会允许扩散室与环境之间进行化学物质的交换[30]。扩散为细胞提供了获取其自然生长成分的途径,包括营养物质和可能的信号化合物,并去除代谢产物,因此扩散室可以提高菌株的可培养性和多样性[31]。
虽然通过这种方法所获得菌株的多样性高于标准培养皿培养的菌株[32],但该方法操作起来比较费力,无法对微生物物种进行高效、高通量的集体分离[33]。因此,在实际药物的发现过程中,该方法有一定的限制性。
针对以上问题,Bollmann实验室在扩散室的基础上,进一步开发了一种由数百个扩散室组成的隔离芯片(iChip),该芯片由中心板和2个对称的顶板和底板组成,这些板均由聚甲醛块加工而成,并且具有384个直径为1 mm的通孔。中心板由直径为25或47 mm的滤膜覆盖,膜的外侧再覆盖一层带有匹配孔的顶板和底板。这种结构使得每个通孔都成为一个微型扩散室,因此这种芯片可以获得大量的以前无法获得的微生物[33]。
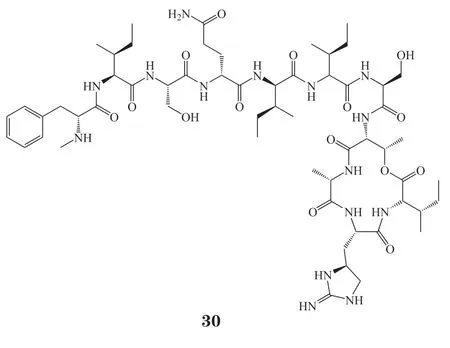
2015年,Ling等[34]将土壤样品在去离子水中剧烈搅拌并静置后,取上清液至熔融状态的SMS培养基中,并稀释到浓度为每20 mL培养基约含有1个细胞,然后将样品分配到iChip的孔中。iChip与原环境土壤直接接触,经过1个月的孵化后,从iChip中获得单个菌落并划线到SMS琼脂培养基上。通过这种方法成功分离到E. terrae菌株,并从它的培养物中得到了抗生素teixobactin(30)。Teixobactin是一种包含Enduracididine、甲基苯丙氨酸和4种D-氨基化合物的缩酚肽,其对包括耐药菌株在内的革兰阳性菌具有良好的抑菌效果。
2019年,Macintyre等[35]从桶状海绵(Xestospongia muta)上切下一小部分,均质后将匀浆倒入无菌尼龙过滤器(100 μm;高压灭菌)以产生细菌悬浮液。悬浮液用45 ℃、1/10 R2A 培养基分别稀释至每毫升5 000、2 500、1 000、500和100个细胞。然后接种于iChip,并将芯片置于海绵中孵育7 d。芯片拆卸后,每个通孔的琼脂块转移到48孔板的单独孔中并用无菌木棒顶端将琼脂块压平,22 ℃、黑暗孵育8周。8周后,经1/10 R2A连续传代纯化含有不同形态菌落的孔。经过鉴定,发现1种名为Alteromonassp.RKMC-009的新型细菌。该菌株能够产生1种新型的N-酰基酪氨酸(N-acyltyrosine,31),其氨酰基部分含有α-甲基取代基,正是α-甲基取代基使该化合物具有较强的抗革兰阳性菌活性。

2020年,Zhang等[36]用2.0%琼脂将MA培养基固化后,在55℃下与稀释后的红树林沉积物样品混合,加入到iChip的孔中。然后,将iChip置于红树林沉积物原位培养2周后,从芯片上挑取无色菌落,反复重划线纯化。成功分离并培养出Gallaecimonas mangroviHK-28菌株,从其发酵液的乙酸乙酯提取物中发现了3种新的二酮哌嗪类化合物,命名为gallaecimonamide A、B、C、D(32 ~34)[37]。进行体外实验后发现,化合物32对哈维弧菌显示出抑菌活性(MIC = 50 μmol · L-1),而对副溶血性弧菌(MIC>300 μmol · L-1)和恶性疟原虫W2(EC50>100 μmol · L-1)无抑菌活性。化合物33和34对哈维弧菌(MIC>300 μmol · L-1)、副溶血性弧菌(MIC>300 μmol · L-1)和恶性疟原虫W2(EC50>100 μmol · L-1)均无抑菌活性。

2020年,Quigley等[38]将土壤样品在去离子水中剧烈搅拌并静置后,取上清到熔融状态的SMS培养基中,然后将试样分配至iChip的孔中。iChip直接与土壤接触,孵育4周后,拆解 iChip,将菌落挑取到SMS培养基上纯化。利用该方法成功分离出未培养过的土壤微生物,并在培养物中分离出3种化合物,分别为Streptomycobactin(阳离子缩肽)、Kitamycobactin(需要P1P2C1蛋白酶的C1亚基才能发挥活性的套索肽)和Amycobactin(新型抗菌剂,其靶向分枝杆菌分泌系统的SecY蛋白)。
3 诱捕器原位培养法
诱捕器的概念最初是由美国东北大学生物与抗菌研究中心Gavrish等[39]在2008年提出,是在经典的原位培养方法扩散室的基础上改良得到的方法。众所周知,放线菌是一种革兰阳性细菌,也是抗生素的丰富来源,如果能够在自然环境中分离培养出之前“不可培养”的放线菌株,那么就能为新抗生素的发现提供可能。为了增强原位培养方法对放线菌的选择性,Gavrish等基于放线菌能够形成菌丝并且渗透固体环境的能力,设计并开发了这种专门捕捉和培养放线菌的诱捕器。
2019年,Zhang等[40]用这种方法分离并鉴定出一种耐高温的氨酰基高丝氨酸内酯酶AidB,这是一种群体猝灭酶(quorum quenching enzyme,QQ酶),作用于群体感应机制。
群体感应(quorum sensing,QS)是一种细胞与细胞间的通信机制,它依赖于小分子信号的产生、分泌来调节基因的表达,从而影响群体密度的变化[41]。有许多革兰阴性细菌将氨酰基高丝氨酸内酯(AHL)的1个或者多个衍生物作为QS系统的信号,以此来调节多种生物功能,而这些功能中有一些对于细菌的致病性是必不可少的[42-43]。因此,通过干扰或者阻断QS系统来预防细菌感染成为一种可行的策略,也被称作群体猝灭,具有这种生物活性的酶也就是QQ酶。用诱捕器的方法对土壤细菌进行大规模筛选,从大约4 000株分离菌中获得了68株具有AHL降解活性的菌株。其中鉴定并命名了Boseasp. strainF3-2和Boseasp. strain12C这2株菌株,并对F3-2菌株进行了进一步的研究,发现其具有较强的AHL降解活性。
2021年,Mai等[44]提出了一种固相萃取嵌入透析(SPEED)技术,与最初诱捕器的设计思路有异曲同工之妙。这种技术的核心策略是利用Amberlite XAD-16树脂捕获有机物的方法来提取微生物的代谢产物。放线菌、真菌等被认为是有价值的生物活性物质的主要提供者[45-46],但用XAD-16树脂原位捕获相应次级代谢产物时,常有大量树脂珠包埋在菌丝体形成的网状结构中,使得二者的分离十分复杂。如果采用洗脱的方法对树脂-菌丝体混合物进行分离,会造成化合物污染,影响后续目的产物纯化。而SPEED技术的思路是通过外部的微生物生物膜与内部的树脂之间的物理分离来简化回收和纯化过程。SPEED管是由外部的尼龙滤布(NFC)和包含树脂珠的内部透析管(DT)2个屏障所组成。其中,NFC担当生物支持的作用,使得微生物能在其上形成生物膜,与固体培养类似。NFC充当载体的作用会影响放线菌和真菌等丝状微生物的生命周期,同时细胞周期阶段的调控因子也会影响专一代谢物簇的表达[47-48]。而DT具有分子截断的功能,可以区分次级代谢产物和生物大分子,1 400的分子截断保证了对所有专一代谢物家族的渗透性[49]。通过试验,分离出了Streptomyces albidoflavus19-S21菌株,并将其特异代谢产物用乙酸乙酯和甲醇提取后提交UPLC-MS/MS分析,获得的数据利用基于特征的分子网络(GNPS)进行研究分析[50]。除了鉴定出一些已知化合物外,还检测到一簇在GNPS中未知的化合物。该思路不同于之前将扩散室应用于分离捕获菌株,而是在外部支持培养形成生物膜的同时,内部直接通过树脂原位捕获次级代谢产物,为分离出放线菌等丝状体微生物后的次级代谢产物的提取提供了十分便利的平台。
4 土壤基质膜系统
土壤基质膜系统(soil substrate membrane system,SSMS)是一种新型的可用于分离和富集土壤中多种微生物的技术。传统富集微生物大多是采用专一营养素的方法,存在分离时间较长、分离效果有限等诸多缺点,而SSMS方法可克服传统培养方法的上述不足。
SSMS方法是把环境中的微生物群落进行稀释后,接种于无菌PC膜上,通过TCM膜隔开加入的土壤泥浆与微生物群落,使得只有土壤中的营养物质可以接触到PC膜上的菌落,经过一段时间的培养之后,取出PC膜进行扩大培养。当菌群成长到一定程度,再加入到所需要的培养基中,获得目的菌落。近年来已有多篇文献报道通过SSMS方法来筛选和分离土壤微生物。
2016年,Dorst等[51]使用SSMS方法培养柴油降解菌,该研究发现在高柴油燃料浓度土壤中,通过SSMS富集了76%的土壤总种群数的微生物,而对照土壤仅为26%。在门分类水平上,SSMS富集的微生物群落主要由变形菌构成(占总相对丰度的88% ~ 91%),其次是厚壁菌和放线菌(占总相对丰度的2% ~ 10%)、拟杆菌和酸杆菌(<5%总相对丰度)。通过后续观察富集微生物与柴油的相互作用,发现SSMS富集到的微生物中有12个属被显著抑制、6个属被显著刺激。相比之下,在土壤中鉴定的属中有71个属受到显著抑制,但只有5个属受到显著刺激。
2017年,Zhao等[52]使用SSMS方法分离出菲降解菌,对菲的利用率高于传统的培养方法。从分离出的细菌种类来看,传统方法与SSMS方法分离出来的细菌种类存在不同,采用传统的富营养培养方法分离出的细菌主要为假单胞菌,而使用SSMS方法培养出的细菌主要由鞘氨醇单胞菌组成。鞘氨醇单胞菌是一种革兰阴性细菌,其细胞膜由鞘脂糖组成,可降解多种化合物,包括联苯、萘、芴、菲、芘、呋喃等,具有污染处理方面的潜力。
在早期实验中,SSMS方法多用于从环境中分离培养细菌。2017年,Pudasaini等[53]研究显示,SSMS还可以用于从环境中分离和培养真菌,特别是软腐菌。研究人员通过SSMS培养了30种软腐菌,包括毒枝孢属、外裂孢属、大麦属和背芽突霉属,这也是第一次利用SSMS方法培养软腐菌的尝试。与标准的培养方法相比,采用SSMS培养后,软腐菌的分类操作单元多样性从14个增加到57个。该实验也证实了在实验条件下未能富集到的蓝藻、绿菌门、绿弯菌门等光合自养细菌,可通过改变光源等条件来实现其分离。
2019年,Kwon等[54]通过SSMS法分离出了甲烷营养菌。在之前的研究当中,用传统微生物分离方法分离甲烷营养菌是通过在培养基顶部添加甲烷来富集可以利用甲烷的微生物,之后通过琼脂平板来进行重复的单菌落筛选。但因为分离时间较长,通常只会选择快速生长的甲烷营养菌而忽略生长较慢的甲烷营养菌,而且即使是在以甲烷为唯一碳基质的培养基中,甲烷营养菌也倾向于与甲基营养菌及生活在甲烷营养菌分泌的代谢物上的其他异养菌形成聚集体,从而使后续的分离变得困难。SSMS分离技术与传统方法相比,缩短了分离所需的时间,并产生了更多类型的分离物。
5 结语与展望
随着各种新型的微生物培养技术在海洋微生物研究方面的应用,越来越多的新颖次级代谢产物不断被人们所发现,为海洋来源创新药物的研发提供了物质基础,也为解决病原菌抗生素的耐药性不断增加的问题贡献了新的研究思路。
虽然微生物培养新技术已经取得了一定的研究成果,但仍然面临着诸多的挑战与限制。在共培养技术中,如何筛选相互作用的菌株?微生物之间如何在群体感应系统中识别自诱导信号和外诱导信号?新产生的次级代谢产物对共培养的菌株有何影响?共培养菌株的投放时间及投放顺序对共培养结果会产生什么样的影响[55]?两种或两种以上微生物共同培养时的代谢物的生产者如何确定[5]等,上述一系列问题仍然困扰着研究者。目前,已知共培养的结果大多具有偶然性,缺乏可预见性和可重复性。因此,需要新的技术和设备,如代谢组学分析和分子网络技术等来进一步推动共培养技术的完善。
高通量培养法在分离培养之前无法采用常规培养方法的微生物方面有着比较成熟的应用,这极大地促进了研究者们对海洋微生物种类的探索。但是高通量培养法在发现新型化合物方面应用有限,这有待研究者们对该方法进一步改进。Benítez等[25]对基于灭绝培养的高通量培养方法流程做了改进后,得到了新的化合物,这是该方法发展过程中的突破。
诱捕器原位培养法是在土壤环境中选择性分离放线菌的方法,通过分离出之前“未培养”的新放线菌株,为新抗生素的发现提供可能性。这种方法的核心启示是原位捕获的策略,通过滤膜的分离机制直接从菌株最适应的天然环境中分离捕获菌株。SPEED技术是相似策略的最新方法,捕获对象与诱捕器的菌株不同,是分子更小的次级代谢产物,同时也应用了树脂的富集作用,值得学习和发展。
SSMS作为一种新型的微生物培养技术,可以培养多种土壤微生物,包括之前使用传统方法难以培养或分离困难的微生物。在环境污染的防治、微生物群落的分析等方面具有重要作用,并且在获得稀有微生物方面具有巨大的应用潜力。

