真菌沉默基因簇激活策略研究进展
吕建明,曹志秦,黄嘉华,陈国栋,胡丹*,高昊, **
(1. 暨南大学药学院中药及天然药物研究所,广东 广州 510632;2. 沈阳药科大学中药学院,辽宁 沈阳 110016)
真菌物种资源丰富,据估计自然界中存在的真菌多达220万到380万种[1]。丰富的真菌资源蕴藏了巨大的活性物质合成潜能,真菌在药物发现中扮演着极其重要的角色[2],如青霉素、环孢菌素、洛伐他汀等均是从真菌中发现的明星药物分子[3]。然而,自20世纪80年代以来,人们从真菌中发现活性新天然产物的概率越来越低[4],加之制药公司在天然药物研发上的投入越来越少[5],天然产物化学研究进入到一个漫长的低谷期。近年来,随着高通量测序技术以及生物信息学的飞速发展,人们发现真菌基因组中编码天然产物的基因簇数目远远大于已从中所发现的天然产物数量,提示真菌中尚存在大量的沉默基因簇有待进一步的发掘。因此,如何最大限度地激活沉默基因簇,已成为后基因组时代高效利用真菌资源的关键。本文系统总结了真菌沉默基因簇激活策略的研究进展,以期为充分释放真菌蕴含的化学潜能提供参考。
根据次生代谢产物激活的可预测性和不可预测性,我们将目前的激活策略分为非定向的沉默基因簇激活策略和定向的沉默基因簇激活策略(见图1):非定向激活策略包括基于培养基成分改变或培养条件优化的激活策略、基于微生物共培养的激活策略、基于表观遗传调控的激活策略、基于全局调控因子的激活策略以及基于代谢分流的激活策略等;定向激活策略包括基于启动子置换的激活策略与基于异源表达的激活策略等。

图 1 真菌沉默基因簇激活的代表性策略Figure 1 Representative strategies for activation of fungal silent gene clusters
1 真菌沉默基因簇的非定向激活策略
非定向的沉默基因簇激活是指通过物理刺激、化学诱导或表观遗传调控等手段非定向地激活次生代谢产物合成的调控方法。该策略可以同时激活多个不同的生物合成基因簇,有助于快速高效地挖掘结构多样的真菌活性天然产物。
1.1 基于培养基成分改变或培养条件优化的激活策略
1.1.1 改变培养基种类从同一菌株获得多样的次生代谢产物,最简单直接的方式就是采用不同的培养基对目标菌株进行发酵培养,也就是我们经常所说 的OSMAC策 略(one strain many compounds)(见图1)。Zheng等[6]从一株地衣内生真菌Nodulisporiumsp.的大米固体发酵培养物中分离鉴定了2个4-甲基孕甾类化合物nodulisporisteriods A和B。随后,Zhao等[7]采用PDB培养基(potato dextrose broth)对上述菌株进行了重新发酵,结果从其胞外提取物中获得了8个新的绿胶霉素类化合物nodulisporiviridins A ~ H,其 中nodulisporiviridin G具有Aβ42聚集抑制活性(IC50= 1.2 μmol · L-1)。此外,该类化合物还可提高Aβ转基因果蝇的短期学习记忆能力。Wang等[8]从松口蘑中分离获得了一株真菌Trichoderma harzianum,发现其在4种培养基中的代谢产物明显不同,并从这4种培养基的提取物中分离鉴定了8个新化合物,其中2,3-dialkylchromone具有突出的昆虫诱捕与致死活性。
1.1.2 培养基中添加金属离子和卤素向培养基中添加一定量的金属离子、卤素等也会使目标菌株的代谢产物发生变化。金属离子通过影响生物体的生理结构与酶的功能来使其代谢产物发生变化[9]。研究人员发现向培养基中加入钴离子[10]、铁离子[11]、锌离子[11]、铜离子[12]等均有可能改变菌株的代谢,从而获得新的代谢产物。卤素的添加会改变培养基的渗透压,因此有可能激活因渗透压失衡而沉默的基因,特别是对于海洋来源的真菌,其激活效果更为明显。Sureram等[13]发现向红树林来源的真菌Aspergillus unguis的液体发酵培养基中添加KBr或KI后,其可合成多个新的具有芳香酶抑制活性的代谢产物。Yu等[14]通过添加NaI的方式从一株植物内生真菌Pestalotiopsis lespedezae的大米发酵提取物中分离鉴定了10个新的ambuic acid类聚酮化合物,其中pestallic acid Q是首次从内生真菌中分离鉴定的碘化天然产物。
1.1.3 培养条件的优化合适的培养条件,如培养温度、pH、溶氧量等是真菌正常生长代谢的关键,因此培养条件的改变也会对基因的表达产生影响。Scherlach等[15]通过改变培养基组成、培养周期、温度以及溶氧量,从Aspergillus nidulans的发酵液中分离获得了2个新的异吲哚啉酮类生物碱aspernidines A和B。Siridechakorn等[16]发现将SDB培养基(Sabouraud dextrose broth)的pH调至5.0时,植物内生真菌Rhytidhysteron rufulum可合成2个新的具有抗肿瘤活性的聚酮化合物rhytidenones G和H,其中rhytidenone H的活性显著高于rhytidenone G,其对淋巴瘤细胞Ramos和非小细胞肺癌细胞H1975的IC50分别达到了0.018和0.252 μmol · L-1。
1.2 基于微生物共培养的激活策略
在自然条件下,微生物之间存在着复杂的相互作用,可诱导彼此合成结构多样的代谢产物。然而,由于通过改变培养基成分或培养条件很难模拟这种复杂的相互作用,因此,通过将不同的微生物进行混合培养,模仿微生物所处的天然生态环境,有望获得单独培养时无法产生的天然产物(见图1)。
自1989年Sonnenbichler等[17]首次通过混合培养从Heterobasidion annosum中分离获得多个具有抗菌活性的代谢产物以来,研究人员在近30年间通过采用真菌与真菌或真菌与细菌的混合培养方式获得了大量的活性天然产物[18-19]。人们认为微生物混合培养时主要通过3种作用方式来激活沉默基因[20]。第一种方式是一种微生物合成底物或前体,然后被另一种微生物所利用来合成特定的代谢产物。如Rhizopussp.在合成植物毒素根霉素(rhizoxin)时,需要其内生细菌Burkholderiasp.提供前体化合物WF-1360F[21-22]。第二种是一种微生物合成信号分子,诱导另一种微生物的基因表达。如植物病原细菌Ralstonia solanacearum通过合成脂肽类化合物ralsolamycin来激活植物病原真菌Fusarium fujikuroi中bikaverin等化合物的生物合成基因,从而保护真菌免受细菌的侵染[23]。第三种是混合培养的微生物通过细胞之间的物理接触来激活沉默基因。如放线菌Streptomyces hygroscopicus通过菌丝体之间的相互作用,激活A. nidulans的苔色酸合成酶基因[24]。
不论是基于培养基成分改变或培养条件优化的激活策略,还是基于微生物共培养的激活策略,人们都需要通过大量的筛选才能获得合适的激活条件。因此,为了提高沉默基因簇的激活效率,研究人员又发展了干预靶点明确的非定向激活策略。
1.3 基于表观遗传调控的激活策略
表观遗传是指在不改变基因序列的情况下,基因的表达发生了可遗传的变化[25]。在真菌中,表观遗传修饰与次生代谢产物的合成密切相关,如DNA的甲基化对基因的转录有抑制作用[26],组蛋白的乙酰化通常会激活基因表达,但在少数情况下会抑制基因的表达[27],组蛋白的甲基化也会影响基因的表达[28]。因此,表观遗传调控也被广泛用于真菌沉默基因簇的激活(见图1)[29]。
1.3.1 表观遗传小分子抑制剂的添加基于已鉴定的表观遗传修饰酶,人们筛选获得了多个表观遗传小分子抑制剂,包括DNA甲基化酶(DNA methyltransferase,DNMT)抑 制 剂5-氮 胞 苷(5-Aza)与N-phthalyl-L-tryptophan(RG108),组 蛋白去乙酰化酶(histone deacetylase,HDAC)抑制剂辛二酰双羟肟酸(SBHA)、辛二酰苯胺异羟肟酸(SAHA)、烟酰胺(nicotinamide)、丁酸钠(sodium butyrate)、丙 戊 酸(valproic acid)和octanoylhydroxamic acid,以及组蛋白乙酰转移酶(histone acetyltransferase,HAT)抑制剂漆树酸(anacardic acid)。为了通过表观遗传调控来激活沉默基因簇,研究人员将这些抑制剂单独或以组合的方式添加到真菌培养体系中,获得了多个新的天然产物(见表1)。
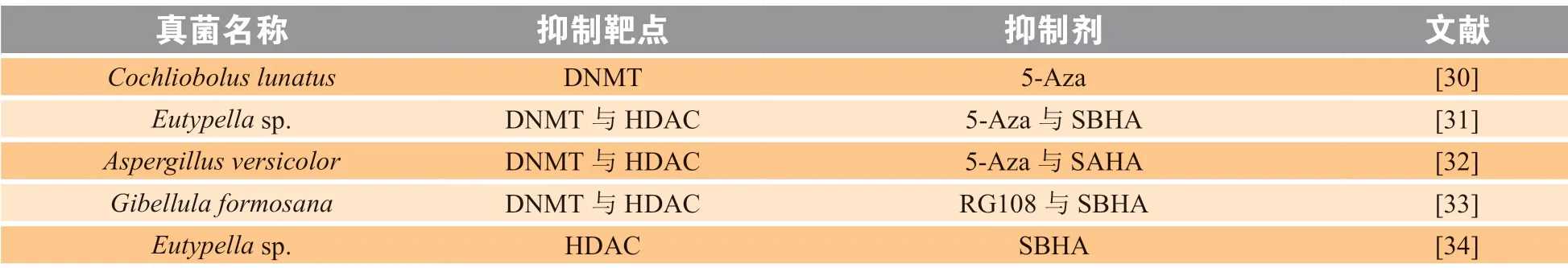
表 1 表观遗传修饰酶抑制剂在真菌沉默基因簇激活中的应用Table 1 Application of epigenetic modification enzymes inhibitors in the activation of fungal silent gene clusters

续表1
1.3.2 表观遗传调控基因的敲除虽然利用小分子抑制剂进行表观遗传调控简单方便,但由于一些抑制剂的特异性较差,可能会抑制其他酶的功能,从而影响真菌的生长代谢。因此,利用基因编辑方法对真菌中的表观遗传修饰酶基因进行定向敲除或过表达也是一种重要的调控手段。目前,研究人员通过对真菌中的HDAC、HAT以及组蛋白甲基化酶(histone methyltransferase,HMT)编码基因的敲除或过表达,发现了多个新的天然产物(见表2)。

表 2 表观遗传修饰酶基因敲除或过表达在真菌沉默基因簇激活中的应用Table 2 Application of knockout or overexpression of epigenetic modification enzymes-encoding genes in the activation of fungal silent gene clusters
1.4 基于全局调控因子的激活策略
除了表观遗传修饰酶,全局调控因子也可同时调控多个基因的表达(见图1)。全局调控因子是一类在特定的诱导条件下(如周围环境的变化),可同时调控多个基因表达的调控因子[48]。2004年,BoK等[49]从曲霉属真菌中找到了一个全局调控因子基因laeA,发现敲除laeA可以抑制部分基因的表达,从而使菌株不再合成相应的天然产物,而laeA的过表达则可以促进相关化合物的合成。随后,全局调控因子LaeA被广泛用于真菌沉默基因簇的激活[50-52]。除LaeA之外,目前用于真菌沉默基因簇激活的全局调控因子还有RsmA[53]、MeaB[54]、PacC[55]、HapX[56]、McrA[57]、AreA[58]、LaeB[59]、CreA[60]、TRI6[61]等。
1.5 基于代谢分流的激活策略
代谢分流是指通过敲除菌株中主要代谢产物的生物合成关键基因,使得更多的前体流向其他化合物生物合成代谢流的一种激活策略(见图1)。Wei等[62]通过生物信息学分析,发现一株植物内生真菌Penicillium dangeardii的基因组中含有43个次生代谢产物生物合成基因簇,但该菌株在多种培养条件下主要高产红青霉毒素类化合物(rubratoxins)。随后,Wei等采用表观遗传调控的方法来激活该菌株的其他沉默基因簇,但结果显示代谢产物并没有发生明显的变化。Wei等推测可能是由于该菌株在合成rubratoxins时消耗了大量的底物,从而抑制了其他化合物的合成。随后,Wei等敲除了P. dangeardii中参与rubratoxins合成的聚酮合酶基因rbtJ,并最终从敲除菌株中分离获得了23个新化合物,部分化合物表现出突出的细胞毒、抗炎或抗氧化活性。与表观遗传调控策略以及全局调控因子策略不同,代谢分流策略并不是通过调节基因的表达来激活沉默基因,而是通过调节代谢流使得沉默基因可以获得足量的前体,从而合成相应的产物。
2 真菌沉默基因簇的定向激活策略
定向的沉默基因簇激活是指对特定沉默基因簇进行靶向激活,不同于非定向激活策略,定向激活策略通常只能激活某一特定的生物合成基因簇。
2.1 基于启动子置换的激活策略
启动子置换是指利用新的启动子替换沉默基因原有的启动子,从而使得沉默基因可以在原宿主中进行正常表达。考虑到真菌次生代谢产物可能会对原宿主产生毒性,因此为了不影响真菌的生长,同时又能激活沉默基因获得新的活性天然产物,研究人员通常选用诱导型启动子来替换沉默基因原有的启动子。
2.1.1 生物合成基因启动子的置换该策略主要是利用诱导型启动子,如乙醇脱氢酶启动子(alcohol dehydrogenase promoter,alcA)[63],置换沉默的生物合成基因原有的启动子,然后在诱导剂的作用下驱动目标基因表达,从而合成新的代谢产物。然而,由于真菌中每一个基因的表达通常都需要一个启动子来驱动[64],因此在进行启动子置换时,需要对基因簇中所有沉默的生物合成基因的启动子进行替换(见图1)。Yeh等[65]从A. nidulans的基因组中发现了一个含有6个基因的沉默基因簇,为了研究这个基因簇的功能,作者用alcA同时替换了这6个基因的启动子,最后发现这个沉默的基因簇负责蛋白酶抑制剂fellutamide B的生物合成。
2.1.2 转录调控基因启动子的置换真菌的生物合成基因簇中通常含有多个转录调控基因,其主要负责合成转录调控因子,然后与基因簇中其他基因的启动子序列特异性结合,从而激活特定基因簇的表达[66]。因此,当沉默的基因簇中含有转录调控基因时,人们只需将转录调控基因的启动子置换便可激活该基因簇,不需要对基因簇中所有生物合成基因的启动子进行置换。目前,研究人员已鉴定的真菌中负责调控特定基因簇的转录调控因子包括Zn(II)2Cys6、Cys2His2、Basic leucine zipper(bZIP)、Ankyrin repeat、Winged helix等类型(见表3)。其中,最普遍的特异性调控因子为Zn(II)2Cys6类型。据统计,近90%参与调控真菌聚酮类化合物生物合成的特异性转录调控因子均属于Zn(II)2Cys6型[67]。

表 3 转录调控基因启动子置换在真菌沉默基因簇激活中的应用Table 3 Application of promoters replacement of transcriptional regulatory genes in the activation of fungal silent gene clusters
Chiang等[77]从A. nidulans中发现了一个沉默的含有2个聚酮合酶基因以及多个修饰酶基因的基因簇,然后将基因簇中的Zn(II)2Cys6型转录调控基因afoA的启动子替换为alcA启动子,并最终发现该沉默基因簇负责聚酮类化合物asperfuranone的生物合成,该化合物可通过阻止细胞周期进程和诱导凋亡来抑制非小细胞肺癌A549细胞的增殖[78]。此外,人们还可将启动子与转录调控基因在体外连接,然后再转染到原始菌株中,从而靶向激活沉默的基因簇。Bergmann等[79]从A. nidulans中发现了一个沉默的含有8个基因的基因簇,作者将该基因簇中的Zn(II)2Cys6型转录调控基因apdR与alcA启动子连接,随后导入至A. nidulans中,最后在环戊酮的诱导下分离鉴定出2个新的聚酮-非核糖体肽杂合体aspyridones A和B。
2.2 基于异源表达的激活策略
异源表达是指将沉默的基因与高效启动子连接,然后导入到遗传操作简单的异源宿主中,在特定的条件下诱导基因表达产生新天然产物的一种策略(见图1)。由于启动子置换策略无法用于难以建立遗传操作体系的菌株,因此异源表达成为另一种被广泛使用的沉默基因簇靶向激活策略。目前,用于表达真菌沉默基因簇的异源宿主主要有酿酒酵母(Saccharomyces cerevisiae)和曲霉属真菌(Aspergillusspp.)。
2.2.1 基于酿酒酵母异源表达的激活策略酿酒酵母是一种被广泛研究的单细胞真菌,在异源激活真菌沉默基因簇方面有着重要的应用[80]。目前,研究人员已对酿酒酵母的遗传信息与生命活动规律有了较为深入的认识,并开发了一系列针对酿酒酵母遗传改造的分子生物学技术与工具[81]。因此,极易利用合成生物学技术调控酿酒酵母的代谢流,构建不同的底盘细胞,为激活不同类型天然产物生物合成的基因簇提供高效的异源宿主。Bian等[82]为了利用酿酒酵母激活沉默的倍半萜环化酶基因,首先在酿酒酵母中过表达了甲羟戊酸途径中的3-羟基-3-甲基戊二酸单酰辅酶A还原酶基因tHMG1,随后同时将法尼基焦磷酸(farnesyl-PP,FPP)合成酶基因ERG20以及从Fusarium graminearum基因组中挖掘到的倍半萜环化酶基因FgJ03939导入到上述底盘酵母菌中,最终获得了8个不同类型的倍半萜类化合物。然而,由于酿酒酵母只能识别不含有内含子的基因序列,因此在利用酿酒酵母进行异源表达时通常需要准确去除真菌基因中的内含子序列。
2.2.2 基于曲霉属真菌异源表达的激活策略近20年,研究人员通过紫外诱变、基因敲除等技术手段获得了多个具有营养缺陷的曲霉属菌株,包括米曲霉Aspergillus oryzaeNSAR1[83]、构巢曲霉Aspergillusnidulans[84-85]等,为开展真菌天然产物的异源合成提供了新的选择。与酿酒酵母不同,曲霉属真菌可以准确识别和去除真菌基因中的内含子序列,因此只需从目标菌株基因组中扩增沉默基因,然后与淀粉酶启动子amyB或乙醇脱氢酶启动子alcA等连接后导入到曲霉中,最后在淀粉或环戊酮等的诱导下即可驱动基因的表达[86]。目前,研究人员以曲霉属真菌作为异源宿主已激活了大量的真菌沉默基因簇,并发现了多个活性突出、结构新颖的萜类[87-88]、聚酮类[89-90]以及生物碱类化合物[91]。然而,由于人们对曲霉属真菌的生命活动规律认识较少,且曲霉属真菌中大量的修饰酶可能作用于异源合成的产物[92],因此曲霉属真菌作为异源宿主合成真菌天然产物仍有一定的局限性。
3 结语与展望
真菌是药物发现的重要源泉。特别是近年来研究人员通过生物信息分析发现真菌中含有大量未被激活的次生代谢产物生物合成基因簇,因此如何激活这些沉默基因簇已成为研究人员关注的焦点。针对这一问题,研究人员开发了多种非定向与定向的沉默基因簇激活策略,并在此基础上获得了大量结构新颖、活性突出的天然化合物。然而,这些策略有各自的优势及局限性(见表4),单独使用一种策略很难全面激活真菌中的沉默基因簇。因此,为了实现真菌资源的高效利用,应同时采用多种策略以最大限度地激活真菌沉默基因簇。

表 4 不同沉默基因簇激活策略的优缺点Table 4 Advantages and disadvantages of various strategies for activating silent gene clusters

续表4
此外,尽管真菌中存在大量的沉默基因簇,但这些基因簇是简单的处于沉默状态,还是发生了基因突变失去了功能,现有的生物信息分析手段还无法进行有效的区分。未来有必要引入人工智能及大数据分析手段,提高对沉默基因簇和失活基因簇的辨别,并在此基础上开发失活基因的修复技术,从而提高沉默基因簇的激活效率。其次,针对大多数的非模式菌株,无法建立其高效的遗传操作体系是限制其沉默基因簇激活的瓶颈,包括外源基因无法导入,或无合适的筛选基因用于转染菌株的筛选,因此,需进一步开发非模式真菌的遗传转化方法以及筛选技术。最后,异源表达是定向激活沉默基因簇的重要手段,但目前用于真菌沉默基因簇表达的异源宿主种类相对较少,未来还需要开发不同的异源宿主,以适应特定来源的真菌沉默基因表达。

