miR-26b在ob/ob小鼠组织中的表达研究*
范智勇,薛 永,赵亚萍,徐广峰
江苏省淮安市第三人民医院检验科,江苏淮安 223001
世界范围内,肥胖已经演变成为不可忽视的公共卫生问题。而近年来,microRNA(miRNA)在肥胖症的发生、发展过程中的作用受到广泛关注。研究表明,miRNA-26b(miR-26b)在肿瘤的发生、发展过程中发挥重要作用[1]。而既往有研究显示,miR-26b在脂肪细胞分化过程中上调,在成熟脂肪细胞中高表达,其在脂肪细胞分化过程中发挥重要的调节作用[2]。瘦素基因遗传性缺陷ob/ob小鼠是常用的研究肥胖的动物模型,它是瘦素基因纯合突变的小鼠,特征为肥胖、多食、高血糖和胰岛素抵抗。本研究通过观察miR-26b在ob/ob小鼠心脏、肝脏、胰、脾、肺、肾脏、骨骼肌、小肠及脂肪组织中的表达变化,以及检测瘦素干预小鼠成熟脂肪细胞后miR-26b的表达变化,探讨miR-26b在肥胖发生、发展中的作用。
1 材料与方法
1.1实验动物 雄性16周龄野生型C57/BL6J小鼠8只、瘦素基因遗传性缺陷ob/ob小鼠12只,购自南京大学模式动物研究所。
1.2标本采集 动物禁食12 h后,称体质量、测体长,以5%水合氯醛溶液腹腔内注射麻醉,小鼠仰卧位固定,剪去胸前区被毛,乙醇消毒皮肤后,将左手食指放于左侧第3~4肋间触摸到心搏处,右手持带有4号针头的注射器,选择心搏最强处穿刺,收集血液至离心管,室温放置离心管至有血清析出,离心(2 000 r/min,10 min)取上清液。右手抓住鼠尾用力向后拉,同时左手拇指与食指向下按住鼠头,将脊髓与脑髓拉断,脱臼处死小鼠后,乙醇消毒腹部和胸部皮肤,然后将腹腔和胸腔剪开,取心脏、肝脏、脾、胰、肾脏、肺、小肠、生殖器周围皮下白色脂肪组织、肩胛间区棕色脂肪组织、骨骼肌适量,—80 ℃冰箱保存组织用于后续的实验。
1.3血糖、甘油三酯(TG)、总胆固醇(TC)检测 将离心好的小鼠血清,分别采用葡萄糖氧化酶法、甘油磷酸氧化酶-过氧化物法、胆固醇氧化酶法在TBA-2000FR全自动生化分析仪(日本东芝)上完成血糖、TG、TC的检测,严格按照相应试剂盒说明书操作。
1.4细胞培养 小鼠3T3-L1细胞株购自上海细胞生物研究所,采用脂肪前体细胞完全培养液[DMEM+10%胎牛血清(加拿大Wisent公司)]在37 ℃孵箱(5%CO2) 中培养,每两天换液1次。待细胞生长至完全融合后2 d(第0天)开始诱导分化,培养液换用含0.5 mmol/L 1-甲基-3-异丁基黄嘌呤(MIX)、1 μmol/L地塞米松和5 mg/L胰岛素的完全培养液(美国Sigma公司)。48 h后换成只含5 mg/L胰岛素的完全培养液,每两天换液1次,至第 8 天,经油红O(北京天根生物科技有限公司) 染色法鉴定,90%以上细胞分化为成熟脂肪细胞后进行后续的干预实验。
1.5瘦素干预 在3T3-L1脂肪前体细胞诱导分化为成熟脂肪细胞后,采用磷酸盐缓冲液(PBS,加拿大Wisent公司)清洗细胞两次,然后用含100 ng/mL 瘦素(美国Sigma公司)的细胞培养液继续培养16 h后,在12孔细胞培养板的每孔中加入700 μL Trizol总RNA提取试剂(美国invitrogen生命技术有限公司)收集细胞,于—80 ℃低温冰箱(日本三洋)冻存备用。实验均设立对照组,瘦素干预组设6个平行孔。
1.6miR-26b表达水平检测 将含700 μL Trizol总RNA提取试剂的细胞冻存管置于室温环境下,待融化后静置5 min。取50 mg左右小鼠组织进行充分匀浆,加入700 μL Trizol总RNA提取试剂,室温静置5 min。在上述各试管中加入140 μL氯仿振荡15 s,静置5 min,4 ℃低温离心机12 000×g离心15 min,取上清液,采用离心柱法抽提细胞和组织总RNA(Qiagen公司),操作严格按照说明书进行。采用微量分光光度计(One Drop OD 1000)对RNA进行定量和纯度分析,要求A260/A280值为1.8~2.0。采用miRNA反转录试剂盒(ABI公司,15 μL体系)将总RNA反转录成cDNA,严格按照说明书进行操作。采用实时荧光定量聚合酶链反应(qRT-PCR)技术检测miR-26b水平,选择snRU6为内参照。miR-26b和snRU6内参基因Taqman探针均购自美国Life Technology公司。应用2—ΔCT方法计算目的基因的相对表达水平。
2 结 果
2.1ob/ob小鼠及C57/BL6J小鼠糖脂代谢情况比较 ob/ob小鼠的体质量、血糖、TG及TC水平明显高于C57/BL6J小鼠,差异均有统计学意义(P<0.05)。见表1。
表1 C57/BL6J小鼠及ob/ob小鼠糖脂代谢情况比较
2.2C57/BL6J小鼠miR-26b表达的组织学特征 采用qRT-PCR 技术检测C57/BL6J小鼠心脏、肝脏、胰、脾、肺、肾脏、骨骼肌、小肠及脂肪组织中miR-26b表达,发现miR-26b在C57/BL6J小鼠心脏、脂肪、胰组织中表达水平较高,而在小肠、肾脏、骨骼肌组织中表达水平较低,组织间表达差异较大,表达水平最高的是心脏组织(0.049±0.008),最低的为肾脏组织(0.000 21±0.000 05),两者相差200余倍,见图1。
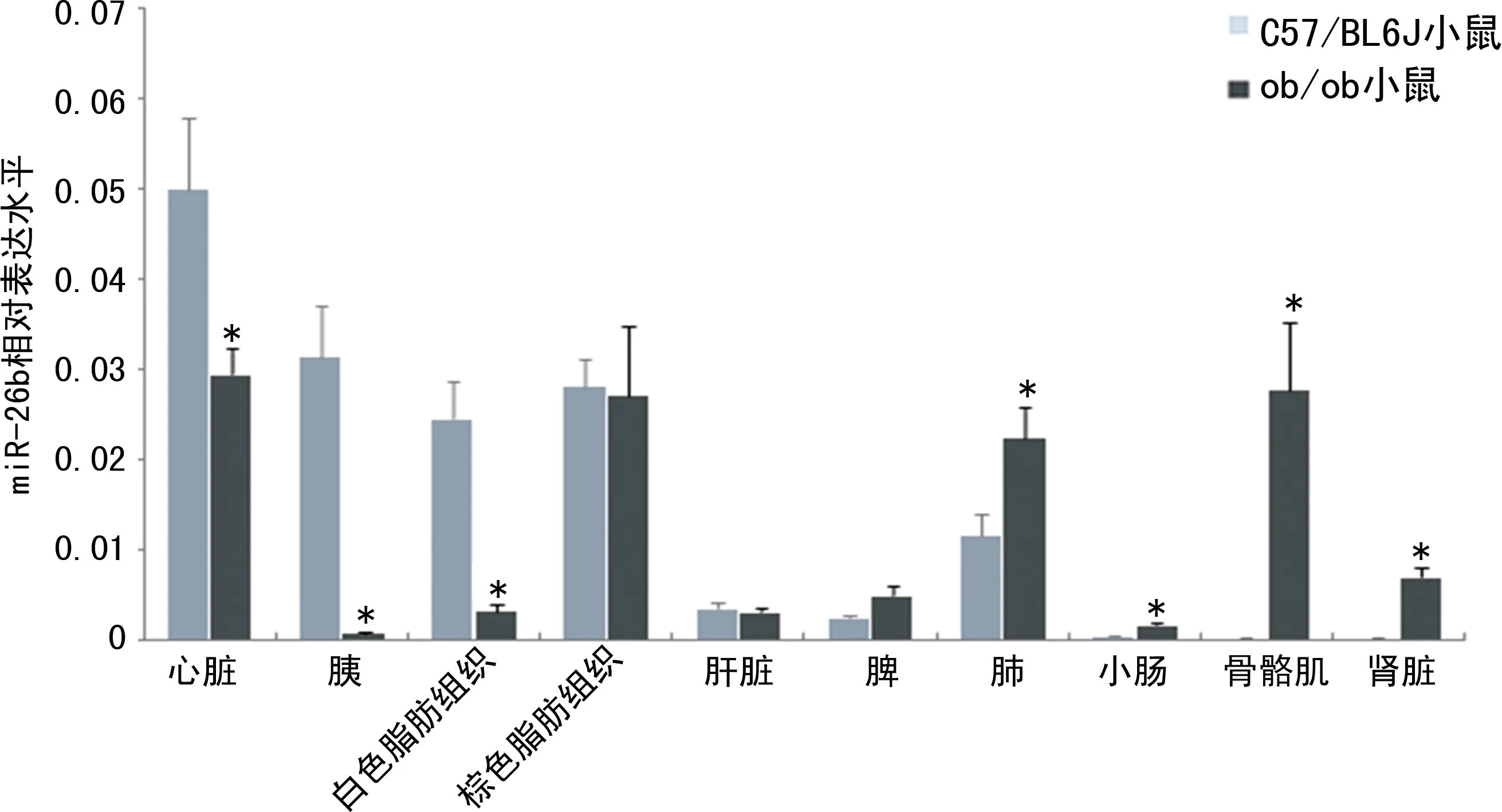
注:与C57/BL6J小鼠比较,*P<0.05。
2.3ob/ob小鼠及C57/BL6J小鼠miR-26b表达的比较 ob/ob小鼠各种组织中miR-26b的表达见图1。与C57/BL6J小鼠比较,miR-26b在ob/ob小鼠心脏、胰、白色脂肪组织中表达水平明显下降(P<0.05),在肺、骨骼肌、肾脏及小肠组织中表达水平明显升高(P<0.05);而两种小鼠miR-26b在肝脏、脾、棕色脂肪组织中表达水平差异无统计学意义(P>0.05)。
2.4瘦素对小鼠成熟脂肪细胞 miR-26b表达的影响 将3T3-L1脂肪前体细胞(图2A)诱导分化为成熟脂肪细胞(图2B), 100 ng/mL瘦素干预16 h后,采用qRT-PCR技术检测脂肪细胞中miR-26b表达水平,结果发现瘦素可明显下调脂肪细胞miR-26b表达水平(图2C)。
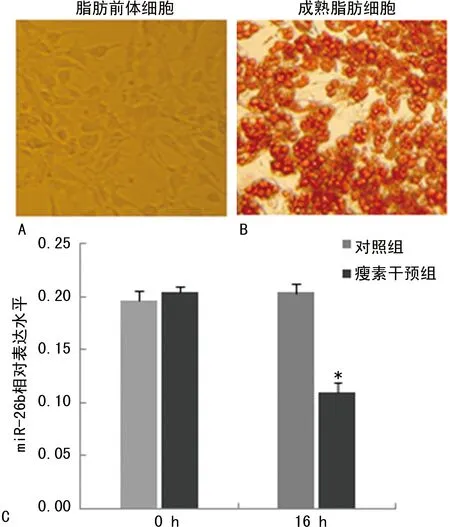
注:A为脂肪前体细胞油红O染色图;B为成熟脂肪细胞油红O染色图;C为瘦素干预小鼠成熟脂肪细胞0 h及16 h后miR-26b表达水平;与对照组比较,*P<0.05。
3 讨 论
肥胖已逐渐演变成全球性的公共卫生问题,世界卫生组织的数据显示,1975年以来,世界肥胖人数已增长近3倍,截至2016年,18岁及以上的成年人中逾19亿人超重,其中超过6.5亿人肥胖,超过3.4亿例5~19岁的儿童和青少年超重或肥胖;截至2019年,3 800万例5岁以下儿童及婴幼儿超重或肥胖[3]。而我国的情况更加严重,2015年《中国居民营养与慢性病状况报告》显示,截至2012年我国18岁及以上成人超重率为30.1%,肥胖率为11.9%,6~17岁儿童和青少年超重率为9.6%,肥胖率为 6.4%。最近的一项研究表明,我国18岁以上的居民中,有29.1%(2.778亿)为中心性肥胖(腹部肥胖),其中男性约为1.40亿,女性约为1.38亿,而腹部肥胖与代谢综合征密切相关[4]。肥胖是遗传、环境和生活方式相互作用的结果,肥胖无论采用保守疗法还是外科手术治疗效果均不理想,这可能与肥胖相关的代谢紊乱有关。因此,阐明肥胖的发生机制,寻找有效的肥胖防治方法已迫在眉睫。
miRNA是真核生物体内一类长度约为22个核苷酸(nt)的内源性非编码单链小RNA,其主要通过作用于靶基因的3′非翻译区(3′-UTR)转录后水平调控基因的表达[5],miRNA几乎参与调节一切生命活动和大多数疾病过程[6]。近年来miRNA在肥胖及其相关并发症发病过程中的作用受到广泛关注。多项研究表明,脂肪组织分泌的外泌体miRNA可能在肥胖导致的脂肪肝方面发挥作用,另外,肥胖可导致脂肪因子和肥胖相关的miRNA失调,而脂肪因子和miRNA的相互调节作用在肥胖及其相关疾病的发生、发展过程中亦发挥调控作用[7-8]。早期研究表明肥胖与胰岛素抵抗、2型糖尿病密切相关,但有研究也提示肥胖与Ⅰ型糖尿病关系十分密切[9]。miRNA的表达往往呈现明显的组织特异性,并可影响其在特定组织中的调节功能。本研究结果表明miR-26b在C57/BL6J小鼠心脏、脂肪、胰等组织中表达水平较高。SONG等[10]发现miR-26b随着脂肪前体细胞的诱导分化,表达水平逐渐升高,而在脂肪前体细胞中敲低miR-26b可明显抑制其分化为成熟脂肪细胞。XU等[11]发现miR-26b过表达对人成熟脂肪细胞胰岛素敏感性具有促进作用。有研究报道,miR-26b通过靶向作用于PTEN基因促进3T3-L1脂肪细胞的分化[12]。由此可见,miR-26b可能是一条与机体代谢功能密切相关的miRNA。
ob/ob小鼠由于瘦素基因突变致其表达产物瘦素活性丧失,发生自发性肥胖,其发病过程与人类肥胖相似,因此成为研究人类肥胖最常用的动物模型之一。本研究中,16周龄的ob/ob小鼠体质量为野生型C57/BL6J小鼠的2倍多,并出现高血糖、高血脂,呈现明显的肥胖表型并伴有代谢紊乱。与C57/BL6J小鼠比较,ob/ob小鼠心脏、胰、白色脂肪组织中miR-26b表达水平明显下降(P<0.05),肺、骨骼肌、肾脏及小肠组织中miR-26b表达水平明显升高(P<0.05),而在肝脏、脾、棕色脂肪组织中的表达水平差异无统计学意义(P>0.05)。ob/ob小鼠miR-26b表达变化呈现不同的组织学特征,提示肥胖机体miR-26b表达调控机制复杂,其在不同组织中发挥的生物学作用是否存在差异尚待进一步探讨。
3T3-L1细胞在体外诱导后能特异性地分化为成熟脂肪细胞,被广泛应用于脂肪细胞特性和功能的研究。鉴于ob/ob小鼠瘦素功能缺失,而3T3-L1脂肪细胞中miR-26b的表达调控研究鲜有报道,本研究采用瘦素干预3T3-L1成熟脂肪细胞,观察miR-26b表达的变化,结果发现瘦素可明显下调miR-26b表达水平,提示瘦素功能缺失并非ob/ob小鼠白色脂肪组织中miR-26b表达下调的直接原因。研究表明,炎症因子、激素、游离脂肪酸等对人脂肪细胞中的miR-26b表达均具有调控作用,肿瘤坏死因子(TNF)-α、游离脂肪酸、地塞米松可下调人脂肪细胞中miR-26b表达水平,而生长激素可促进人脂肪细胞中miR-26b表达[13-14]。ob/ob小鼠脂肪代谢严重失调,同时伴有慢性炎症,血清游离脂肪酸及TNF-α等炎症因子水平明显升高[15],这些因子可能与其白色脂肪组织、心脏、胰中miR-26b表达水平下降有关。
miRNA生物学作用大,表达调控复杂。进一步分析本研究结果发现,miR-26b在C57/BL6J小鼠骨骼肌中表达水平极低,为白色脂肪组织的1/10,但在ob/ob小鼠骨骼肌中表达水平升高极为明显,为白色脂肪组织的8倍之多。骨骼肌、脂肪组织同为胰岛素作用的靶器官,但miR-26b的表达变化模式却截然相反,其原因尚不清楚。白色脂肪组织是TG的贮存场所,miR-26b在白色脂肪组织中发挥促进葡萄糖摄取、TG合成的作用,其在骨骼肌中的作用有待进一步阐明。

