RAD54L在肝细胞癌中的表达及临床意义
虞豪骋,张嘉凯,张水军,2,郭文治,2
(1.郑州大学第一附属医院肝胆胰外科,河南 郑州 450052;2.河南省消化器官移植重点实验室,河南 郑州 450052)
2020年全球癌症报告指出,肝癌是全球死亡率高居第3位的恶性肿瘤[1]。肝癌中85%以上为肝细胞癌(hepatocellular carcinoma,HCC)[2]。目前,早期的HCC患者主要通过手术切除病灶,可是术后的高复发率却使患者的总体预后欠佳。因此,需要寻找特定的生物标志物改善早期HCC的检测、评估预后和预测治疗反应。RAD54L基因编码的蛋白质属DEAD-like解螺旋酶超家族,它的结构与RAD54蛋白很类似,且二者同属DNA的重组及修复蛋白[3]。RAD54L蛋白可以提高同源DNA配对,从而促进DNA的重组修复。既往的研究表明,RAD54L高表达水平与膀胱癌患者的癌症进展和不良预后显著相关[4],RAD54L基因的单核苷酸多态性与胰腺癌的存活率降低有关[5]。然而,RAD54L在HCC中的相关研究尚未见报道。本研究通过生物信息学方法分析了RAD54L在HCC中的表达水平、诊断和临床预后价值,旨在为RAD54L作为HCC诊断指标、治疗靶点及预后标志物提供理论支持。
1 材料与方法
1.1 数据下载、差异表达及生存分析从癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库[6](https://portal.gdc.cancer.gov/repository)下载50例癌旁组织样本和369例HCC组织样本的基因表达谱数据(工作流类型:HTSeq-FPKM))。另外,还从TCGA下载了377例HCC患者的临床特征数据和生存资料。采用Wilcoxon秩和检验比较TCGA数据库中HCC及癌旁样本之间RAD54L基因的表达差异,并分析50例配对HCC及癌旁样本中的表达差异。采用受试者工作特征(receiver operating characteristic,ROC)曲线判断RAD54L对HCC的诊断价值,并计算曲线下面积(area under curve,AUC)值。提取HCC患者生存状态和总生存期,删除1例生存资料不完整的样本,保留368例样本。按照HCC组织中RAD54L表达量的中位数,把患者分为低表达组(184例)和高表达组(184例),再通过Kaplan-Meier法描绘生存曲线,最后通过log-rank试验对比两组之间的差异。
1.2 RAD54L表达水平与临床特征的相关性分析收集了HCC患者性别、年龄、病理学分级、TNM分期、血管侵犯、血清甲胎蛋白(alpha-fetoprotein,AFP)等临床特征,删除临床数据不完整的样本,保留248例样本进行后续分析。采用χ2检验比较RAD54L基因表达水平在不同临床特征组间的差异,采用单因素Cox回归计算所研究变量的风险比率(hazard ratio,HR),采用多因素Cox回归探索RAD54L表达水平作为预后因素的独立性。
1.3 RAD54L表达水平与HCC中免疫细胞浸润丰度的相关性分析肿瘤免疫评估数据库(Tumor Immune Estimation Resource,TIMER)[7](https://cistrome.shinyapps.io/timer/)是用于全面分析肿瘤免疫细胞浸润的在线工具,可通过基因表达数据计算免疫细胞浸润的丰度。使用TIMER数据库分析RAD54L表达水平与HCC组织中免疫细胞浸润丰度的相关性,使用Spearman相关系数评估相关性。
1.4 基因富集分析运用基因组富集分析(Gene Set Enrichment Analysis,GSEA)[8]软件(4.1.0版)进行京都基因与基因组百科全书[9](Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析,预测RAD54L在HCC中涉及的相关通路。选择基因集(c2.cp.kegg.v7.2.symbols.gmt)作为参考基因集,用缺省加权富集法计算富集分数(enrichment score,ES)和规范化富集分数(normalized enrichment score,NES),每个分析运行基因组排列1 000次。以P<0.05和错误发现率(false discovery rate,FDR)<0.25为条件选择显著富集的通路。
1.5 统计学处理本研究中采用R 4.0.2软件进行统计学分析和图形可视化。使用Wilcoxon秩和检验对癌旁和HCC组织进行差异比较。使用Kaplan-Meier法和Cox回归分析进行生存及预后分析。使用χ2检验分析RAD54L表达水平与临床特征之间的关系。使用Spearman相关系数评估RAD54L表达水平与HCC中免疫细胞浸润丰度的相关性。假设检验采用双边检验,P<0.05为差异有统计学意义。
2 结果
2.1 差异表达及生存分析与癌旁组织比较,
RAD54L基因在HCC中的表达水平升高(P<0.001)(图1A),且在50例配对样本的肝癌组织中的表达也上调(P<0.001)(图1B)。通过ROC曲线分析可得,RAD54L基因表达水平对HCC具有诊断价值(AUC=0.954,95% CI:0.926 ~0.981)。见图2。对比RAD54L高、低表达组患者的整体存活状况,可以发现高表达组患者的整体生存率更差(P<0.001)。见图3。
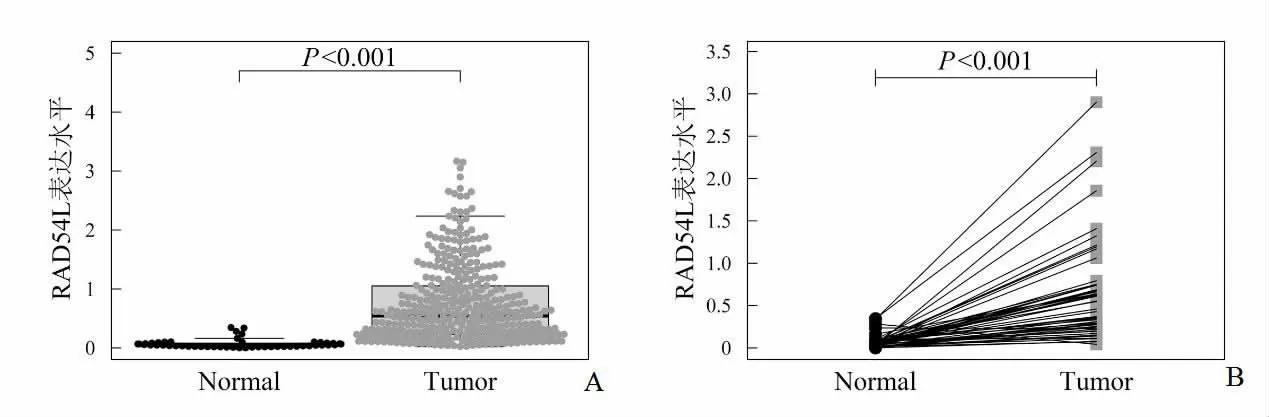
图1 RAD54L在HCC组织及癌旁组织中的表达水平

图2 RAD54L在HCC中诊断价值的ROC曲线

图3 RAD54L表达与HCC患者生存之间的关系
2.2 与HCC患者临床特征的关系χ2检验结果显示,RAD54L表达水平与患者性别(P=0.025)、病理学分级(P<0.001)相关,而与年龄(P=0.636)、TNM分期(P=0.553)、有无血管侵犯(P=0.810)和血清AFP水平(P=0.123)不相关。见表1。单因素Cox回归研究结果显示,RAD54L高表达、TNM分期为III~IV期、有血管侵犯的患者总体生存期更短。多因素Cox回归显示,RAD54L表达水平(P=0.016)和TNM分期(P=0.008)是影响HCC患者预后的独立危险因素。见表2。

表1 RAD54L基因表达水平与HCC患者临床特征的相关性(n)

表2 RAD54L基因表达水平及临床特征与HCC患者预后的单因素和多因素分析
2.3 与HCC中免疫浸润细胞水平的关系利用TIMER数据库分析表明,RAD54L表达水平和HCC中B细胞(r=0.461)、CD4+T细胞(r=0.272)、CD8+T细胞(r=0.387)、巨噬细胞(r=0.440)、中性粒细胞(r=0.363)和树突细胞(r=0.499)的浸润水平均呈正相关(P<0.05)。
2.4 GSEA富集结果利用GSEA预测RAD54L在肝癌中参与调控的通路发现RAD54L高表达显著富集于细胞周期、同源重组、DNA拷贝、错配修复、碱基序列剪切修复、单核苷酸剪切修饰等DNA修复相关的通路,以及p53信号通路等与癌症相关的通路。见表3。

表3 RAD54L高表达的GSEA富集结果
3 讨论
HCC是肝脏主要的恶性肿瘤,也是全球最常见的致死性癌症之一。由于HCC的隐匿性发病,大多数患者在疾病中期或晚期才得以确诊,错过了最佳的治疗时机[10]。中晚期HCC缺乏安全有效的治疗方法,导致了疾病快速进展和患者死亡率的增加[11]。因此,早期检测对于降低HCC死亡率至关重要,尽管超声、计算机断层扫描、磁共振成像、血清AFP等检查已广泛应用于HCC的监测,但HCC的早期诊断率仍不高[12]。其中AFP的敏感度仅为39% ~65%,并且其在疾病早期的表现并不理想[13]。因此,迫切需要鉴定更特异和敏感的HCC生物标志物优化HCC的早期诊断和治疗。
RAD54L基因位于人类染色体1p34,具有19个外显子,其编码的RAD54L蛋白是使同源重组正常运作的关键蛋白之一,在细胞的DNA修复中发挥着重要作用。细胞中的DNA不断受到环境中(如紫外线、电离辐射等)或细胞内(如作为常规代谢过程副产物的活性氧)产生的毒性物质的损伤[14]。其中对细胞损害最大的DNA损伤类型便是DNA双链断裂,因为即使是单个未修复的DNA双链断裂也可能导致细胞死亡,而且DNA双链断裂的错误修复与基因组不稳定性增加以及肿瘤的发生有关[15]。同源重组是DNA双链断裂的主要修复途径之一,是一种在模板引导下严格调控的修复过程,它利用完整的同源序列(如姐妹染色单体或同源染色体)提供的信息替换损伤周围丢失或切除的DNA[16]。然而在癌细胞中同源重组活性的增加将导致对化学治疗的抵抗[14,17]。Mun等[4]通过研究发现,在膀胱癌中,E2F1可直接与RAD54L的启动子区域结合,并调节RAD54L的转录。在体外细胞实验中,使用丝裂霉素C处理膀胱癌细胞使之产生DNA双链断裂,证实了E2F1可诱导RAD54L的表达,通过同源重组途径修复DNA断裂。Mun等[4]还通过分析了GSE13507膀胱癌数据集(共165例膀胱癌患者)发现RAD54L高表达的膀胱癌患者预后不良。放疗对肿瘤细胞的主要作用也是靶向DNA双链并诱导DNA损伤。肿瘤细胞的DNA修复途径可以增强治疗抵抗从而影响放疗的疗效[18]。Bai等[19-20]通过体外细胞实验表明,CHEK1、CDC7可调节RAD54L在胶质母细胞瘤细胞中的表达,从而增强细胞的放射抗性。Nathansen等[21]研究发现,敲低RAD54L的表达可降低头颈部鳞状细胞癌的自我更新能力和放射后克隆形成细胞的存活率。这些研究结果表明RAD54L表达的失调可能与某些癌症的发病机制有关,但目前尚未有文献对RAD54L与HCC的关系进行综合分析。
本研究利用TCGA数据库发现,RAD54L在HCC中有较高的表达,差异具备诊断价值,且生存分析提示RAD54L较高表达的患者预后不良。临床特征的相关性分析表明,RAD54L在HCC中的表达水平与性别和病理学分级等相关,提示RAD54L可能在HCC的进展中起着一定的作用。单因素Cox回归和多因素Cox回归说明RAD54L表达水平是HCC患者的独立预后因素,靶向RAD54L治疗或可提高患者的生存时间和生活质量。以上结果显示RAD54L可作为HCC潜在的诊断和预后标志物。
近年来,随着对免疫微环境认识的提高,研究者发现HCC的发生、进展、转移和复发与免疫反应密切相关[22-23]。本研究显示RAD54L表达与肝癌组织中巨噬细胞、树突细胞等多种免疫细胞的浸润水平呈正相关关系。肿瘤微环境中的一些分子和细胞成分能够引起树突细胞的功能异常,从而促进了肿瘤的免疫逃逸[24]。RAD54L可能通过刺激树突状细胞等的致癌能力促进HCC进展。肿瘤相关巨噬细胞可调控HCC细胞免疫应答以及产生各种细胞因子,并参与了HCC的进展[25]。巨噬细胞大量浸润,常与HCC患者的预后较差相关[26]。RAD54L在HCC免疫微环境中可能发挥着复杂的免疫功能,从而影响患者的预后。本研究还通过GSEA分析表明,RAD54L高表达显著富集于细胞周期、同源重组、DNA拷贝、错配修复、碱基序列剪切修复等DNA修复相关的通路,以及p53信号通路等与癌症相关的通路。这个结论和RAD54L作为同源重组与DNA修复中的关键蛋白是一致的,可见RAD54L可能是通过同源重组等多种途径影响HCC的进展、复发和治疗抗性,其中具体的作用及机制则有待进一步研究。
本文的不足之处在于仅用生物信息学方法推断RAD54L与HCC的关系,缺乏免疫组化等生物学实验验证,后续仍需要通过实验进一步研究RAD54L与HCC的病理关系。总之,RAD54L表达水平与HCC患者的临床特征相关,有望成为HCC的诊断和预后标志物。

