基线与中期18F-FDG PET代谢参数对弥漫大B淋巴瘤疗效及预后评价
李书家 高克克 李昱旻 赵 彤 孙爱君
弥漫性大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)是非霍奇金淋巴瘤中最常见的亚型,占30%至40%[1]。近年来,在环磷酰胺、多柔比星、长春新碱和泼尼松龙治疗方案(CHOP)中加入利妥昔单抗形成的标准一线治疗方案(R-CHOP),使DLBCL的治疗效果得到明显改善,但仍有约1/3的患者在接受6个周期的R-CHOP治疗后出现进展。为了达到更好的疗效,常需要根据患者情况,给予不同周期的R-CHOP化疗加放疗、靶向治疗。并且随着基因技术的推广,以基因分型为基础进行的R-CHOP加靶向治疗取得了一些新的进展。但这些方案的选择则成为一项重要的临床问题。因此,需要精确、可靠地进行疗效预测和监测,从而制订并能够在治疗中及时调整R-CHOP附加治疗方案,以达到更优化的治疗[2]。
18F-脱氧葡萄糖(18F-FDG)PET/CT近年来在临床肿瘤诊疗中发挥的作用越来越重要,已被美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)和中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)等指南推荐用于DLBCL的初始分期、疗效监测和预后评估。其中,标准化摄取值(standardized uptake value,SUV)是临床最常用方法。早期研究认为,肿瘤病灶中最大标准化摄取值(maximum standard uptake value,SUVmax)可反映肿瘤中最具侵袭性肿瘤细胞的代谢活动,常预示肿瘤恶性程度高[3]。但SUVmax仅反映肿瘤组织中代谢最活跃的瘤细胞的状态,不能代表肿瘤整体情况。因此,新的PET代谢参数被提出并已逐步应用于临床。肿瘤代谢体积(MTV)是一种从PET/CT影像中计算出的客观指标,被定义为肿瘤组织中具有较高代谢活性组织的体积,它集代谢及体积为一体,能反映异常代谢的肿瘤细胞数量。可计算出活动性疾病负担的体积,已被证明可以预测DLBCL的无进展生存期(PFS)[4]。基线PET扫描时,高的MTV提示预后较差[5]。而将MTV与肿瘤内平均SUV(SUVmean)进行相乘所获得的肿瘤糖酵解总量(total lesion glycolysis,TLG)则能够有机地结合形态学和功能信息,反映病灶整体的代谢特点,对于预测DLBCL预后较SUVmax和MTV具有更高的价值[6-8]。但治疗前的基线PET仅能够预测治疗效果而无法直观地反映出治疗后肿瘤的变化。为此,化疗2~4个周期后的中期18F-FDG PET(interim18F-FDG PET,iPET)代谢参数及其较基线PET时的变化量则成为反映疗效的更佳方法[2,9-11]。一项大样本研究发现,化疗2个周期iPET的SUVmax相较基线的变化量ΔSUVmax能够非常好地反映治疗效果,与患者的2年无进展生存期具有良好的负相关性,表明i PET对于疗效监测和预后评估的重要价值[12]。
虽然研究大部分结论都认为PET的代谢参数能够很好地评估疗效、预测患者预后,但参数较多,结果不够稳定,且缺乏统一标准,甚至存在一些争议。因此,尚需更多的临床研究,建立更充分的数据模型,以最终逐步获得统一的参数指标或方案。另外,目前国内外的研究大多集中在对某个单代谢参数进行分析,综合对比分析研究非常少,更缺乏多因素数学模型对预后进行更加准确的评估。
因此,本研究将采用更加可靠的测定方法对基线和化疗2个周期后的iPET进行感兴趣区(ROI)勾画并计算多个代谢参数[13],对其生存期进行相关性分析,对比不同参数对DLBCL化疗效果及预后进行评估的能力,以初步提出18F-FDG PET对于DLBCL疗效评估及预后预测的观察指标,并为后续研究提供依据。
方 法
1. 研究对象
本研究经我院医学研究伦理委员会批准后进行。回顾性收集了2015年1月1日至2020年12月31日在本院进行过18F-FDG PET/CT检查和治疗后复查的DLBCL患者信息,并进行了随访,随访时间截至2021年5月31日。
纳入标准:①年龄≥18岁;②病理确诊为DLBCL,且病理免疫组织化学染色CD20阳性;③根据Lugano分期系统(2014)进行了分期;④完成基线和中期PET/CT扫描,且检查记录完整,扫描方案规范;⑤基线PET扫描前未经过任何治疗,包括化疗、放疗、靶向治疗等;⑥基线扫描后接受R-CHOP化疗2个周期后进行中期PET/CT扫描;⑦治疗均完成了至少6个周期R-CHOP或3个周期R-CHOP结合放疗;⑧进行了NCCN-IPI标准评分;⑨治疗结束后根据CSCO指南中规定的Lugano标准进行了疗效评价。
排除标准:①同时存在急性或慢性感染;②并存有其他恶性肿瘤或有其他恶性肿瘤病史;③同时接受了其他靶向治疗和自体造血干细胞移植治疗者。
2.18F-FDG PET/CT扫描及图像处理
2.1 显像仪器、显像剂和图像采集
PET-CT型号为Discovery ST8(GE,美国),示踪剂为18F-FDG,由中心自主制备,放射化学纯度>95%。18F为PETTrace回旋加速器(GE,美国)生产。
检查前患者均禁食6 h,空腹血糖低于11.1 mmol/L,按5.5 MBq/kg计算注射剂量,经静脉注射18F-FDG。注射后,安静休息60 min后进行行全身PET图像采集。扫描参数:CT扫描层厚3.75 mm,管电压120 kV,管电流210 mA,CT重建层厚3.27 mm。PET扫描参数:3 min/床位,3D采集,床位重叠6%。采集结束后以有序子集最大期望值迭代法(OSEM)进行图像重建,并将数据传入图像后处理工作站进行处理。
2.2 PET/CT代谢参数的测量与分析
将入组患者的PET/CT数据以DICOM标准格式由数据库导入LIFEx软件进行代谢参数测定[14]。由2名经验丰富的PET/CT诊断医师在不知道患者疗效及预后信息的情况下,分别使用LIFEx软件进行分析。首先通过图像分析,获得SUVmax、肿瘤的最大径(maximum tumor diameter,MTD)和 体 重 指 数(body mass index,BMI)校正的最远病灶距离(BMI corrected maximum lesion distance,sDmax)等基础代谢参数。然后将SUV最小值设定为2.2,最大值保持软件默认进行ROI初始化,随后设定SUVmax绝对值为2.5和41%SUVmax为阈值,并由软件自动产生2组ROI,2名医师分别手动去除正常肝脏、脑、膀胱、肾脏、椎体等生理摄取区域以及非肿瘤病灶区域ROI,确定后,软件将自动计算并给出MTV和TLG。如2名医师的测量结果误差小于二者间最大者的10%,则取两者测量结果的平均值作为最终值;如误差超过10%则请第3名医师进行测量,取最接近的2个数据的平均值作为最终测量值。ΔSUVmax、ΔMTV、ΔTLG分别由中期PET的SUVmax、MTV、TLG值与基线PET参数间的差值除以基线PET参数后乘以100%而获得。
3. 统计学分析
采用SPSS 23.0软件对研究数据进行统计分析。描述性分析,对于定性资料,采用率或构成比表示;对于定量资料,采用均数±标准差或中位数(四分位间距)形式表述。对于不满足正态分布的定量资料,采用秩和检验,两组间的比较采用Mann-WhitneyU检验,多组间的比较采用Kruskal-Wallis检验。对于定性资料和分类资料的组间比较,采用卡方检验。统计学检验水准设为α=0.05,P<0.05认为差异有统计学意义。
采用受试者操作特征(ROC)曲线来确定SUVmax、MTD、sDmax、MTV、TLG、ΔSUVmax、ΔMTV、ΔTLG对3年无进展生存(progression-free survival,PFS)和3年总生存(overall survival,OS)的最佳截断值、曲线下面积(area under curve,AUC)、灵敏度和特异度。单因素生存分析用Kaplan-Meier(K-M)生存分析法完成,组间差异用Log Rank检验。多因素分析采用COX回归。
结 果
1. 临床特征
本研究从我院PET/CT数据库中检索2015年1月1日至2020年12月31日进行PET/CT检查并且诊断为DLBCL患者数据846例,最终根据入组和排除标准,纳入82例数据进行数据分析。其中男性40例,女性42例,年龄21~84岁,平均(55.4±16)岁,其中60岁以上患者40例(48.8%)。随访时间的中位数为28个月(5~60个月),总体3年PFS为72.0%,3年OS为75.6%。R-CHOP治疗6周期者45例,8周期者21例,3周期加放疗者16例。Lugano分期局限期(Ⅰ、Ⅱ期)45例,进展期(Ⅲ、Ⅳ期)37例。
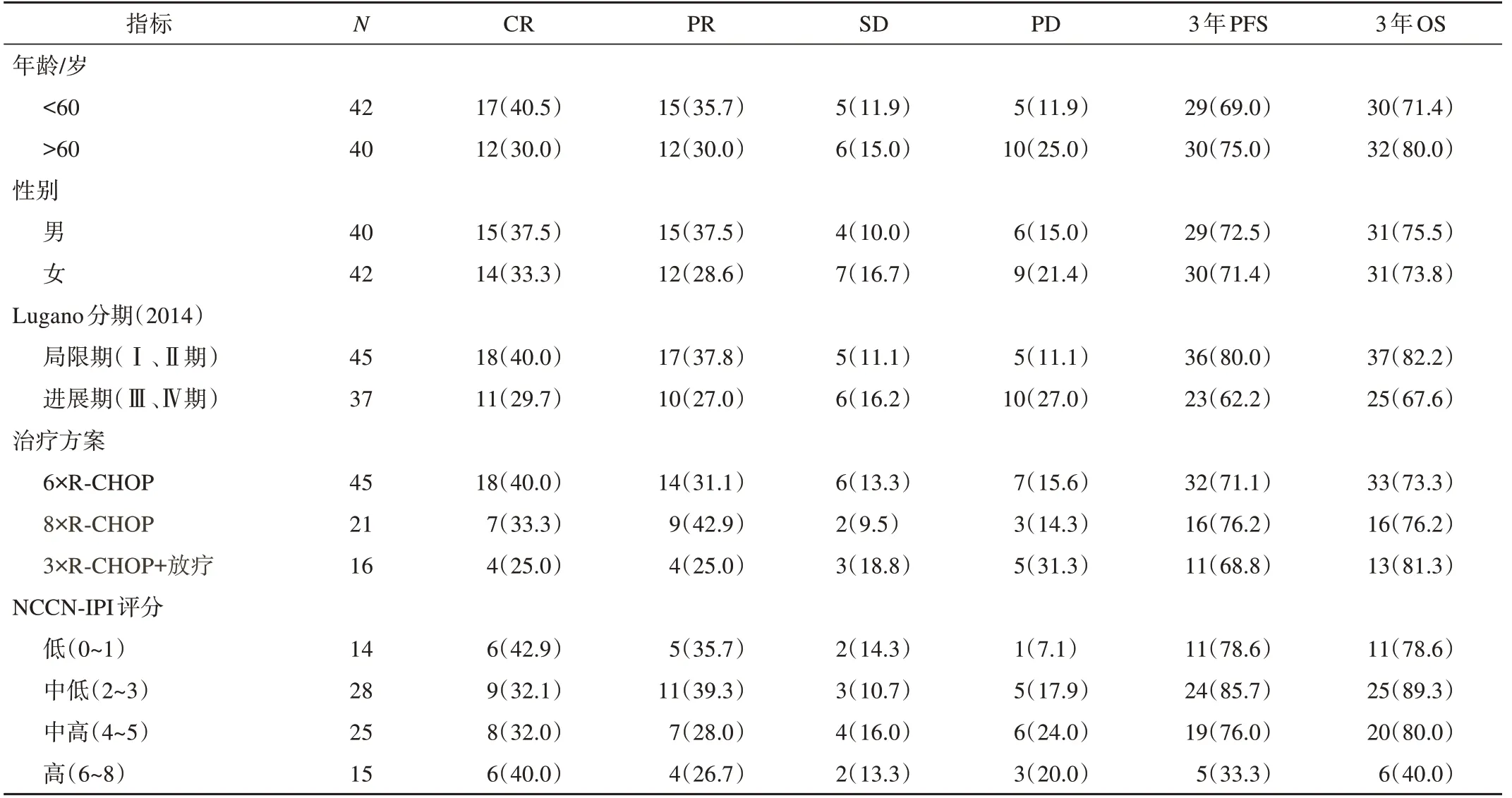
表1 入组病例基本信息表n(%)
2.PET代谢参数
2名医师所勾画获得的PET代谢参数经一致性检验,相关系数为0.98,认为所得PET参数具有良好的一致性和稳定性。对所有入组病例按治疗反应分成完全反应(CR)、部分反应(PR)、疾病稳定(SD)和疾病进展(PD)4组,对比各组间基线PET代谢参数的差异,结果(图1)表明,CR组与非CR组(PR、SD、PD)的SUVmax、MTD、sDmax、MTV、TLG均有显著差异(均P<0.05)。同时,sDmax和TLG在除SD与PD外的多个治疗反应组间具有显著差异(均P<0.05)。表明SUVmax、MTD、sDmax、MTV和TLG均能够对治疗后可能出现CR的患者区别出来,而通过sDmax和TLG则能进一步将CR与PR、SD、PD,及PR与SD、PD进行预测分层,体现出更佳的疗效预测价值。
通过ROC曲线对基线PET的主要代谢参数进行分析,获得了各参数对于PFS和OS预测的最佳截断值以及对应的灵敏度、特异度和AUC。结果(表2)表明,基线PET扫描所有代谢参数的AUC均在0.7以上。基线PET参数中,TLG对于PFS和OS的预测能力最佳,其AUC值分别为0.82和0.86,灵敏度分别为0.86和0.74,特异度分别为0.87和0.73,最佳阈值为5 970。而治疗2个周期后的中期PET代谢参数较基线水平减低百分比(ΔSUVmax、ΔMTV、ΔTLG)则对于PFS和OS具有更高的AUC值,分别为0.79、0.83、0.84和0.81、0.87、0.89。ΔTLG对于PFS和OS的预测能力最佳,特异度分别为0.88和0.75,灵敏度分别为0.77和0.83,最佳阈值为较基线PET降低31.9%。
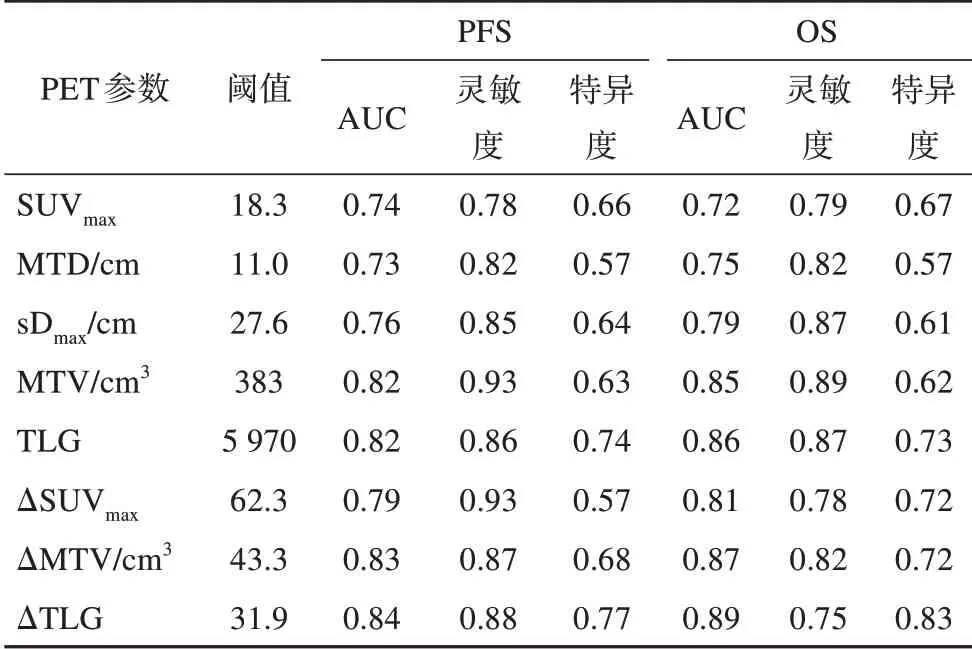
表2 各项PET代谢指标的ROC分析结果
根据ROC曲线(图2)确定的阈值,进行K-M单因素生存分析,结果提示各项PET代谢指标均能够对DLBCL患者生存(PFS和OS)进行风险分层。高基线SUVmax(>18.3)、MTD(>11.0 cm)、sDmax(>27.6 cm)、MTV(>383 cm3)、TLG(>5 970)的患者的预后比低SUVmax、MTD、sDmax、MTV、TLG的患者差,差异具有显著性。低ΔSUVmax(<62.3%)、ΔMTV(<43.3%)、ΔTLG(<31.9%)与较短的PFS明显相关(均P<0.05)。进一步采用COX多因素回归分析发现,基线TLG与中期ΔTLG是影响预后的风险因素(P<0.005)。
在所分析的PET参数中,选择AUC最佳的形态学参数sDmax和代谢参数TLG,根据是否有高sDmax(>27.6 cm)或TLG(>5 970)构建3组风险级别模型:第1组无危险因素(n=32),第2组仅有任意1个危险因素(n=19),第3组有2个危险因素(n=31)。K-M曲线(图3)分析显示:第1、2组与第3组的PFS和OS有明显差异(均P<0.001);第1组与第2组的PFS和OS差异没有达到显著性(P=0.13)。
讨 论
弥漫性大B细胞淋巴瘤(DLBCL)患者的疗效评估和预后分层一直以来都是临床研究的重要方向。有效预判和评估DLBCL患者对R-CHOP方案反应,并识别具有高复发风险的患者并为其选择更合适的治疗策略至关重要。NCCN国际预后指数(NCCN-IPI)是目前国际主要预后分层体系[14-15],被广泛用于治疗前的风险分层,但在利妥昔单抗治疗时代,其预后价值受到一定程度的挑战,多项研究表明,IPI不是一个独立的预测因素,其并不能用于辨别DLBCL的生物学异质性,尚存在一定的局限性。因此,需要更加系统的个体化特征来解决这一问题。与IPI相比,PET/CT代谢参数可以通过量化个体的肿瘤糖代谢,能够更加客观地判断DLBCL肿瘤的侵袭性和瘤负荷,对预测预后和指导个性化治疗方案更有优势。已有多项临床试验研究了不同的PET代谢参数对DLBCL疗效和预后的预测价值,一致认为18F-FDG PET/CT在DLBCL中的作用非常重要,其也被NCCN、CSCO等国际、国内指南推荐应用于临床。但指南中均未能明确采用何种指标、何种水平进行评估。因此还需要更多的研究给出更具体的临床实践方案。
本研究通过对大量病例进行筛选,严格设置入组条件,最终回顾分析了82例DLBCL患者的PET/CT数据,并对预后进行了随访,研究了目前PET/CT主要代谢参数与疗效及预后的关系,获得了一些较为有临床价值的信息。首先,SUVmax和MTD是PET显像中最易于获得的参数,通常反映肿瘤负荷程度。本研究结果发现,较高的SUVmax(截断值18.3)和较大的肿瘤最大径MTD(截断值11.0 cm)提示较差的预后。其次,本研究用BMI对肿瘤病灶间的最远距离Dmax进行了归一化处理,以考虑到每个患者的体型和身高,得出了标准化的Dmax(sDmax)。结果表明sDmax具有独立的预测价值,高sDmax(>27.6 cm)提示预后较差。sDmax直观地反映了肿瘤向不同部位的空间迁移能力,表明DLBCL的扩散的程度。此外,也有研究表明,sDmax在预后方面优于Ann Arbor分期,sDmax较大的患者的早期复发风险显著高于sDmax小的患者[15-16]。虽然SUVmax、MTD和sDmax都能够对DLBCL疗效和预后进行评估,但这些参数的计算是从一个(最大或最高的SUV)到两个肿瘤部位获得的,而淋巴瘤经常涉及淋巴结和结外部位,因此,SUVmax、MTD和sDmax不能充分反映肿瘤的整体情况,尤其是其异质性。因此需要通过更多的参数反映肿瘤的综合情况。
MTV和TLG量化总的肿瘤体积及肿瘤的总的糖代谢水平,而不是对单一最大直径的肿块进行评估,能够更好地对肿瘤负荷作出估计。一些已发表的研究结果一致认为MTV和TLG作为DLBCL预后因素的价值明确,然而,由于计算方法不同,这些报告中给出的最佳截断值相差较大,尚未能获得统一结论[16-18]。因此,研究者们致力于将各种方法统一在一个可接受的预设范围内,目的是使MTV和TLG测量具有更好的重复性和稳定性成为可能,并在常规临床实践中保持一致。本研究中,采用国际认可度较高的方法对MTV和TLG进行了计算,并分析了其与疗效的关系,结果表明,MTV和TLG较SUVmax、MTD和sDmax具有更高的准确度,TLG的预测能力最佳。
通过对比各疗效组间PET参数的分布,发现SUVmax、MTD、sDmax、MTV、TLG均能够对治疗后可能出现CR的患者与其他疗效组区别出来。而sDmax和TLG则能够进一步区分PR与SD、PD,其仅在SD与PD组间差异无统计学意义。表明sDmax和TLG对于DLBCL患者可能出现的疗效加以预测分层,对于治疗临床治疗具有重要的价值。
对于疗效的评估,化疗2个周期后的中期PET/CT扫描能够直观地反映肿瘤形态学及代谢水平的变化,从而更加清楚地判定疗效。也正已逐步进入临床常规实践应用,但对于形态学和代谢水平变化的量化指标尚未能形成统一标准。近2年仅有几项临床研究分别探讨了中期PET较基线PET变化量对预后的影响,包括ΔSUVmax、ΔMTV和ΔTLG,中期PET变化指标对于预后的预测可能较基线PET参数更加准确。本研究更加全面地对比了多个PET参数,最终发现ΔTLG小于31.9%时,对于PFS和OS的预测价值最高,AUC分别为0.84和0.89。
为了进一步探讨PET参数对于预后预测的能力,我们联合了代谢参数TLG和形态参数sDmax构建了简单的风险模型,发现同时具有高TLG和sDmax患者的生存显著比低TLG和sDmax及其中一个值高的患者的生存差。然而受限于入组的样本量不够大且分布不能满足多元回归分析条件,本研究未能对多个参数进行数学建模,提出更好的预测预后方法。但本研究结果也初步为后续多参数建模研究提供了有价值的线索。
综上所述,早期预测R-CHOP方案有效性及患者预后对于临床DLBCL治疗具有重大价值,本研究较为全面地对比分析了多个PET/CT参数的预测价值,结果提示基线及中期PET/CT的多个参数对于DLBCL患者疗效预测与监测、生存评估具有确切的价值,其中基线PET/CT测量的sDmax与TLG能够较好地对RCHOP治疗有反应的患者进行风险分层、预测预后,而联合中期PET/CT计算的ΔTLG则能够更加可靠地对疗效进行判定和生存期预判。这为后续建设更加完善的风险评估模型和方法提供了参考。但还需进一步开展多中心大样本研究,充分验证PET参数在DLBCL治疗评估及预后中的价值并建立更加准确的数学评估模型。

