双能量CT在评估鼻咽癌颅底骨侵犯中的价值研究
占 杨 王 鹏 唐作华 姚振威 段 斐 王宇喆
鼻咽癌(nasopharyngeal carcinoma,NPC)起源于鼻咽上皮细胞,极易侵犯鼻咽上方的颅底骨质[1],并成为影响鼻咽癌患者预后的重要指标。当前,鼻咽癌的治疗方式主要采用放疗联合化疗法,其对肿瘤邻近侵犯精确性评估的要求进一步提高。鼻咽癌一旦出现骨质侵犯时,患者预后通常较差,能否精确勾画靶区成为制定临床化疗方案、保护重要正常结构及改善患者预后的首要条件[2]。因此,术前通过影像精准评估鼻咽癌颅底骨质侵犯范围已成为临床亟需解决的问题,其对减少局部复发率及提高患者生存率至关重要。
头颈部颅底骨质解剖结构复杂,且一些相对较薄的颅底骨质在影像诊断中常常显示不佳,常见于蝶窦体、岩尖等处骨质[3]。传统的单能量CT(singleenergy CT,SE-CT)和MRI是诊断鼻咽癌及评估颅底骨质破坏的主要影像诊断方法。SE-CT可直接分辨硬化型和溶骨型骨质破坏灶,但它易漏诊早期的骨髓侵犯,尤其是这些尚未出现骨皮质破坏的病灶[4]。相反,MRI软组织分辨率较高,且可灵敏地显示肿瘤向颅底骨质的早期骨髓浸润。然而,MRI难以区分骨硬化和骨破坏病变,难以识别一些微小的骨侵犯灶,且不适用于有MRI检查禁忌证的患者(如有颅内及眶内金属植入物,起搏器装置或者幽闭恐惧症等)。
双能量CT(dual-energy CT,DE-CT)可采集不同管电压下各物质的能量吸收数据集,以此将不同的物质区分开来,并在图像后处理中重建出彩色编码的碘图(iodine overlay image,IO image)和虚拟平扫图像(virtual non-contrast image,VNC image)[5],从而降低幅射剂量,并使病灶更加可视化。与此同时,定量DE-CT参数如病灶碘浓度(iodine concentration,IC)、有效原子序数(effective atomic number,Zeff)及不同能量下虚拟单色图像(virtual monochromatic images,VMI)值等为疾病诊断提供了重要的形态学及功能学信息。例如,碘浓度可反映组织的血管丰富程度,原子序数值则与血容量和组织密度息息相关,而VMI值则可进一步突出不同组织特征并减少伪影,提供最佳碘衰减测量值。因此,较常规SE-CT及MRI检查技术而言,DE-CT可提供更多有用的诊断信息,且DE-CT重建出的彩色碘图能敏锐显示骨髓衰减的变化[6]。然而,目前尚无研究采用双能CT来评估鼻咽癌颅底骨质的侵犯情况及范围,因此本研究回顾性分析了31例鼻咽癌患者的颅底骨质侵犯情况,比较了DE-CT与SE-CT在颅底骨质侵犯评估中的诊断性能,明确可用于诊断受侵犯骨质的DE-CT参数,提高临床发现早期颅底骨侵犯范围的能力。
方 法
1. 临床资料
本研究连续选取自2018年1月至2020年12月于复旦大学附属眼耳鼻喉科医院就诊经病理学确诊为鼻咽癌,经影像学参考金标准诊断为骨质侵犯的患者31例[男16例,女15;平均年龄(52.52±12.02)岁],未患头颈部疾病的对照组31例[男16例,女15例;平均年龄(50.55±15.93)岁]。
2. 影像检查方法
SE-CT及DE-CT图像均采用螺旋CT(Somatom Definition;Siemens Healthcare,Erlangen,Germany)扫描,双能量模式的管电压峰值分别为80 kV及140 kV。所采用的扫描参数:层厚0.6 mm,间距0.6 mm。碘图获取是采用320 mgI/mL碘对比剂(Isovue;Bacco Diagnostics,Inc.,Singen,Germany),以4 mL/s的速率经桡静脉注射11 s后,紧接着以2 mL/s的速率注射13 s,并在开始注射70 s后进行扫描。通过线性混合比0.3虚拟出120 kV SE-CT图像。
3. 图像分析
2名有5年以上工作经验的影像科医生在不了解患者临床信息及病理结果的前提下,利用西门子影像工作站(Syngo.via,Siemens Healthcare,Erlangen,Germany)对图像进行后处理,并依次在病例组及对照组碘图、有效原子序数图及虚拟单色图上相应受侵犯骨质区域绘制相同形状及大小的感兴趣区(ROI),选取病变的最大层面,如图1和2所示。此外,根据碘光谱衰减曲线计算曲线斜率K值[计算公式:K=(CT值40keV-CT值100keV)/60 keV]。采用病灶区碘浓度值除以颈动脉碘浓度值以获得标准碘浓度值(normalized iodine concentration,nICn)。计算2名医师测得的各个参数的平均值以用于统计分析。
因受侵犯颅骨病理取材较难,影像学参考金标准由1名具有20年以上丰富工作经验的神经影像学专家全面评估影像资料(SE-CT、DE-CT及T1WI、增强T1WI脂肪抑制、T2WI、DWI等MRI序列)后确定。
4. 统计学分析
采用SPSS 23.0统计学软件对数据进行分析并绘制ROC曲线,各项计量资料均以±s表示,采用配对样本t检验。采用ROC曲线分析评估各参数的灵敏度、特异度、准确度及曲线下面积(AUC),明确评价骨质破坏的最佳参数及阈值。
结 果
1.颅底受侵犯骨质与正常骨质间各影像参数比较
如表1和图1、2所示,与对照组的正常骨质相比,DE-CT在鼻咽癌患者颅底骨质硬化区域的nIC值、Zeff值、K值以及50~90 keV的VMI值显著增高(均P<0.01),在骨质破坏区域的nIC值、Zeff值、K值以及50 keV的VMI值显著降低(均P<0.05)。与对照组的正常骨质相比,SE-CT在鼻咽癌患者颅底骨质硬化区域的120 kV SE-CT值显著增高,在骨质破坏区域的120 kV SE-CT值显著降低(均P<0.05)。
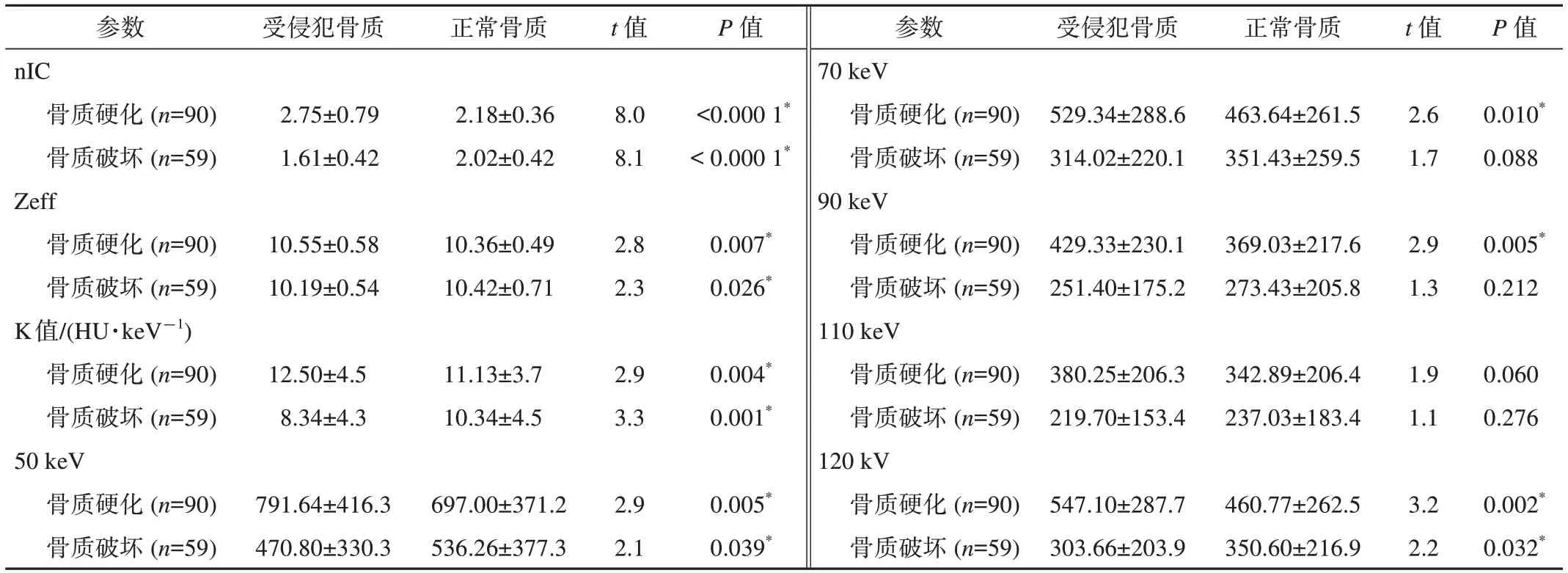
表1 受侵犯骨质与正常骨质间各影像参数比较
2.DE-CT与SE-CT评估颅底骨质侵犯的诊断效能比较
如图3A及表2所示,颅底硬化骨质与正常骨质间各影像参数诊断效能的ROC分析结果显示:DECT多参数联合的诊断效能最佳(AUC:0.889;灵敏度:84.48%;特异度:82.03%),其次分别为K值、nIC值、50 keV的VMI值、120 kV SE-CT值、Zeff值、70~110 keV的VMI值。
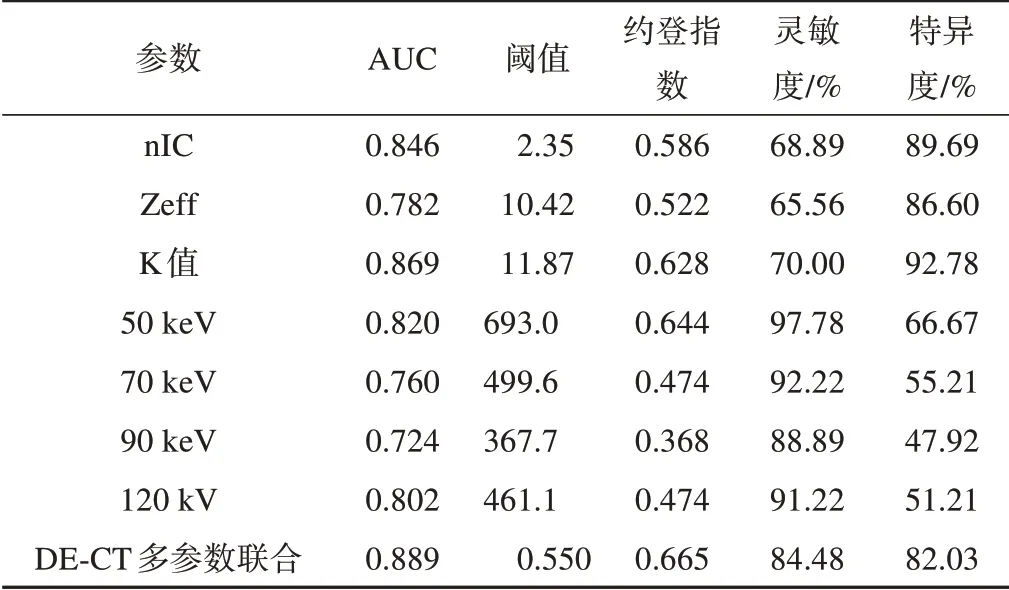
表2 硬化骨质与正常骨质间各影像参数诊断效能比较
如图3B及表3所示,颅底破坏骨质与正常骨质间各影像参数诊断效能的ROC分析结果显示:DECT多参数联合的诊断效能最佳(AUC:0.976;灵敏度:96.55%;特异度87.50%),其次分别为nIC值、50 keV的VMI值、K值、70 keV的VMI值、120 kV SE-CT值、Zeff值、90~110 keV的VMI值。且研究结果发现:在31例NPC患者中,有4处颅底骨质侵犯灶SE-CT显示为阴性,而DE-CT显示为阳性。

表3 破坏骨质与正常骨质间各影像参数诊断效能比较
讨 论
在此研究中,我们评估了鼻咽癌患者颅底受侵犯骨质与对照组正常骨质间各影像参数的差异,并比较了DE-CT与SE-CT评估鼻咽癌颅底骨质侵犯的诊断效能。研究结果证明:较对照组正常骨质而言,鼻咽癌患者颅底受侵犯骨质区域的nIC值、Zeff值、K值以及50 keV的VMI值均存在显著差异。较SE-CT而言,DE-CT多参数联合评估鼻咽癌颅底骨质侵犯的诊断效能更佳。
鼻咽癌是头颈部肿瘤中发病率最高的恶性肿瘤,其恶性程度较高,病灶向上发展易侵犯颅底骨质[7]。颅底骨质富含骨髓,是远处转移的发源地,当前认为鼻咽癌颅底骨质侵犯的病理学机制主要包括骨髓侵犯、松质骨破坏到穿破密质骨的骨质破坏过程以及肿瘤细胞引起的炎症反应导致的骨质硬化过程[8]。由于碘作为DE-CT扫描对比剂的主要成分,因此IO图中测量的nIC值可用来反映组织中对比剂的含量以及微血管的密度及通透性。本研究发现鼻咽癌患者颅底骨质硬化区域的nIC值为2.75±0.79,显著高于对照组中正常骨质的nIC值(2.18±0.36)。而骨质破坏区域的nIC值为1.61±0.42,要显著低于对照组中正常骨质的nIC值(2.02±0.42)。与此同时,ROC分析结果显示硬化及破坏骨质区nIC的AUC分别为0.846及0.894,证明nIC具有较高的诊断效能。这些结果与Kuno等[9]有关DE-CT评估骨质病变的研究结果一致。颅底骨质侵犯部位的nIC参数改变可能与肿瘤骨的病理生理基础密切相关,一方面肿瘤骨中血管内皮生长因子受体的高表达导致新生血管的生成和纤维素的增加,从而使得硬化骨质区的nIC值升高,另一方面肿瘤骨微环境中的钙解离以及骨溶解可能是造成破坏骨质区nIC值降低的原因之一。这些结果证明nIC值可灵敏地反映侵犯骨质的组织结构,有利于准确评估鼻咽癌患者的颅底骨质侵犯情况,为临床治疗方案提供更加准确的信息。因此,DE-CT的nIC是评估颅底骨质侵犯的重要参数。
K值即组织光谱衰减曲线的斜率值,可反映组织CT值随keV值变化的情况,从而将各组织区分开来[5]。此研究中,鼻咽癌患者颅底骨质硬化区域的K值为(12.50±4.5)HU/keV,显著高于对照组中正常骨质的K值[(11.13±3.7)HU/keV]。而骨质破坏区的K值为(8.34±4.3)HU/keV,要显著低于对照组中正常骨质的K值[(10.34±4.5)HU/keV]。此外,ROC分析结果显示硬化及破坏骨质区K值的AUC分别为0.869及0.857,证明K值具有较高的诊断效能。这些数据与Guggenberger等[10]DE-CT相关研究的结果一致。以上结果证明K值可准确地将受侵犯骨质与正常骨质进行鉴别,为临床评估病灶范围提供更加详细的信息。因此,DE-CT的K值是评估颅底骨质侵犯的又一重要参数。
VMI值可模拟不同单色X线束条件的实际图像,用来反映不同keV值时组织的碘含量[11]。本研究中,鼻咽癌患者颅底骨质硬化区域50~70 keV的VMI值显著高于对照组中正常骨质50~70 keV的VMI值,而骨质破坏区50~70 keV的VMI值则显著低于对照组中正常骨质50~70 keV的VMI值。此外,ROC分析结果显示硬化及破坏骨质区50 keV的VMI值的AUC分别为0.820及0.858,证明50 keV的VMI值具有较高的诊断效能。这些结果与Pache等[12]的研究结果一致,显示了VMI值可精准定量检测受侵犯骨质中的碘浓度,有利于发现一些早期微小的病灶。因此DE-CT的VMI值是评估颅底骨质侵犯的重要定量指标。
Zeff值代表着体内组织中元素的平均原子数,可用来反映不同组织的组织密度[5]。本研究发现:硬化骨质的Zeff值(10.55±0.58)显著高于正常骨质(10.36±0.49),而破坏骨质的Zeff值(10.19±0.54)则显著低于正常骨质(10.42±0.71)。ROC分析显示Zeff在评估骨质硬化及骨质破坏中的AUC为0.782及0.785,这些结果与之前Thomas等[13]的研究一致,证明了Zeff可作为评价骨质侵犯的另一重要指标。
传统的SE-CT在评估鼻咽癌患者颅底骨质侵犯中发挥着重要作用,而DE-CT可以从同一数据集中同时提供多种形态学和功能信息,可更全面准确地评估病变情况[14]。本研究ROC分析显示,在所有影像学参数中,DE-CT多参数联合的诊断效能最佳,其在评估硬化骨质及破坏骨质中的AUC分别为0.889及0.976,显著高于SE-CT(硬化骨质:0.802;破坏骨质:0.804)。且研究结果发现:在31例NPC患者中,有4处颅底骨质侵犯灶SE-CT显示为阴性,而DE-CT显示为阳性,这进一步证实了较SE-CT而言,DE-CT具有更高的诊断效能。因此,较SE-CT而言,DE-CT有望成为更加准确有效的颅底骨质侵犯影像评估手段,从而精准地评价鼻咽癌颅底骨质侵犯范围,减少病灶的漏诊率及复发率,并提高患者的生存率。
本研究存在以下局限性:①因病理取材困难,仅以所有影像学资料的全面评估作为金标准;②为回顾性研究,可能存在选择偏倚;③未纳入形态学特征的评估,有待在未来的研究中进一步完善。
综上所述,DE-CT的nIC、Zeff、K值、50 keV的VMI值等参数可准确评估鼻咽癌患者的颅底骨质侵犯情况,且较SE-CT而言,DE-CT的多参数联合具有更高的诊断效能,有助于临床选择最佳治疗方案,改善患者的预后。

