黑木耳“面包菌”病致病菌株的分离鉴定及生物学特性
隋昆澎 李长田 李 丹 李 玉
黑木耳“面包菌”病致病菌株的分离鉴定及生物学特性
隋昆澎 李长田 李 丹*李 玉
(吉林农业大学食药用菌教育部工程研究中心,吉林 长春 130118)
黑木耳“面包菌”病是一种发生在黑木耳代料栽培中的竞争性病害,其发病特征不易察觉、传播蔓延速度快,发病后的菌包将无法出耳,给企业和种植户造成较大损失。通过对吉林省黑木耳栽培主产区发生的疑似黑木耳“面包菌”病的菌包进行调查,以及对染病菌包致病菌株的分离纯化、形态学和分子生物学鉴定、系统发育分析以及致病性检测,确定引起黑木耳“面包菌”病的致病菌株为黄孢原毛平革菌()。对致病菌株进行生物学特性研究,发现其菌丝的最适生长条件为:温度30 ℃,可溶性淀粉作碳源,蛋白胨作氮源,pH 6.0,完全黑暗。光照对菌丝体生长有一定的抑制作用。
黑木耳;“面包菌”病;黄孢原毛平革菌;生物学特性
黑木耳(),又名木耳、光木耳,隶属于担子菌门、蘑菇纲、木耳目、木耳科、木耳属[1]。黑木耳多糖含量极高,还富含蛋白质、脂肪、维生素、无机盐和粗纤维等成分[2],具有抗肿瘤、抗肝炎、抗溃疡、抗辐射、抗衰老、降血脂、抗凝血、增强人体免疫功能等作用[3-5]。
作为精准扶贫的重要抓手之一,近年来我国食用菌种植量大幅增长[6],其中,黑木耳已成为我国第二大食用菌品种,2018年产量达674.03万吨,占我国食用菌总产量的17.54%[7]。而黑木耳病虫害的发生,给企业和菇农造成巨大损失。
黑木耳病害主要可分为侵染性病害和竞争性病害,两者在病原物种类、发生时期、发病条件、危害情况和防控技术等方面存在诸多差异。侵染性病害会直接导致菌丝萎缩、凋亡,如黑木耳黑疔病等[8]。竞争性病害则与黑木耳菌丝争夺养料,阻碍菌丝体在培养基质中的正常生长,对黑木耳栽培生产危害大,一旦发生就很难防治,造成黑木耳的产量和质量下降[9,10]。黑木耳栽培过程中的主要竞争性致病菌有绿色木霉[11]、青霉spp.[12]、曲霉spp.[13]、脉孢霉spp.[14]等。
黑木耳“面包菌”病也是竞争性病害,研究表明其致病菌为黄孢原毛平革菌[15],此致病菌适应性强,传播蔓延速度快,染病初期为白色斑块,后连成片,白粉状,与黑木耳菌丝不易区分,后期局部灰黄色,一周左右即可长满菌袋。染病后栽培基质袋料分离,消耗明显,如同面包一样松软,因而得名。黑木耳菌包被绿色木霉或链孢霉污染,虽然会造成减产,但不影响菌包继续出耳。而“面包菌”一旦爆发,菌包将不再出耳,病害严重时几乎绝收。
目前,研究报道仅限于对该病害的分离鉴定,迫切需要对其生物学特性、适宜发生条件及防治方法等进行系统研究,以提出综合防控措施。
本文对吉林省黑木耳主产区的黑木耳“面包菌”病进行调查,对其致病菌株进行分离纯化、形态学和分子生物学鉴定、系统发育分析以及致病性检测,并对致病菌株的生物学特性进行了研究,以期为该病害的早期诊断和科学防治提供理论依据。
1 材料与方法
1.1 病害调查
2019年6月,分别对吉林省蛟河市、汪清县和安图县的黑木耳基地进行“面包菌”病害调查,共调查黑木耳菌包900袋,分3次重复。选取不同地区的黑木耳棚,每个棚100袋,记录发病菌包的数量和症状等。共采集典型病例的黑木耳菌包样本10个,带回实验室用于病菌分离培养。
1.2 致病菌株的分离、纯化及保存
将采集到的发病菌包先用酒精擦拭菌包表面,然后用经消毒的解剖刀切开发病部位,用接种针挑取离正常木耳菌丝1~2 cm处的发病部位的袋料,接种到平板培养基中,恒温箱内培养。观察培养情况,并不断挑取单一菌落转皿分离保存。经多次纯化后获得纯培养物,此时培养皿内只存在单一的菌落形态[16]。挑取纯培养的菌块接种到试管内,待长满整个试管后,4 ℃保藏备用。试验对10个发病菌包分别进行病菌分离培养,共获得10个菌株。
1.3 致病菌株的鉴定
(1)形态学鉴定。将从栽培基料上分离纯化得到的致病菌株菌丝或分生孢子挑到PDA平板上,置于25 ℃恒温培养箱中培养并观察,待菌落形成而分生孢子刚产生时制片,在显微镜下观察分生孢子梗和分生孢子的形态特征,并进行数码照相。
随机选取一个视野,测量记录致病菌株的分生孢子梗、分生孢子、分生孢子器的大小,观察致病菌株的产孢方式以及分生孢子的形状、颜色等,并在40倍、100倍下进行数码显微拍摄。参照文献[15]所描述的致病菌株的形态特征,进行致病菌株种类鉴定,以明确致病菌株的分类地位。
(2)分子生物学鉴定。将待测致病菌株在PDA平板活化后,挑取其平板培养物(7 mm小菌块3块)接种到铺有玻璃纸的PDA平板上,在25 ℃下避光培养5 天。使用基因组DNA提取试剂盒(天根生化科技有限公司,北京)提取致病菌株菌丝体基因组DNA,方法详见说明书。经1 %琼脂糖凝胶电泳检测后,确定基因组提取质量。
选用真菌通用引物ITS1-F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS4-B(5'-CAGGAGACTTGTACACGGTCCAG- 3'),进行rDNA ITS-PCR扩增。PCR扩增体系(20 μL):11.4 μL双蒸无菌水,2 μL 10×buffer,2 μL MgCl2(25 mmol/L),0.4 μL dNTP(10 mmol/L),引物ITS1和ITS4各1 μL,2 μL模板DNA,0.2 μL Taq酶(Thermo)。PCR反应条件:94 ℃预变性5 min,然后94 ℃变性50 s,55 ℃退火50 s,72 ℃延伸1 min,共28个循环,最后72 ℃延伸10 min。PCR扩增产物经1 %琼脂糖凝胶电泳检测确认,送至华大基因公司进行测序。将测序结果在GenBank(NCBI,http://www.ncbi.nlm.gov)中进行BLAST序列分析,从GenBank中选取合适的序列下载,经ClustX 1.83软件进行多重序列对比,再用PAUP软件构建系统发育树。依据系统发育关系,确定菌株的分类地位。
1.4 致病性检测
将纯化后的致病菌株和黑木耳的菌丝同时分别接种在菌袋(26 cm×15 cm)两端的培养料中,共接种9个菌袋,于25 ℃下避光培养15 天后观察并记录发病情况。若出现病症,对发病部位再次进行分离和鉴定[17],检测发病菌包中能否分离出黑木耳菌株,同时通过质构仪和电子秤对发病菌包进行硬度和重量测定。
1.5 致病菌株的生物学特性研究
(1)培养基配方。碳源试验培养基:3.0 g磷酸二氢钾、2.0 g酵母膏、2.0 g蛋白胨、1.5 g硫酸镁、15.0 g琼脂、20.0 g碳源、1.0 L蒸馏水,pH自然。分别以葡萄糖、蔗糖、麦芽糖、糊精粉、可溶性淀粉作为碳源,并设立空白对照。
氮源试验培养基:1.5 g硫酸镁、3.0 g磷酸二氢钾、20.0 g葡萄糖、15.0 g琼脂、20.0 g氮源、1.0 L蒸馏水,pH自然。分别以蛋白胨、酵母膏、酵母浸粉、磷酸氢二铵、亚硝酸钠作为氮源,并设立空白对照。
pH试验培养基:使用1.0 mol/L盐酸和1.0 mol/L氢氧化钠将灭菌后PDA培养基的pH分别调至5.0、6.0、7.0、8.0、9.0。
温度及光照试验采用PDA培养基,pH自然。
(2)温度对致病菌株菌丝长速的影响。将15.0 mL PDA培养基倒入培养皿(φ=9.0 cm)中,将直径为7.0 mm的接种块接入到PDA培养基中央,每组设置6次重复,分别置于15 ℃、20 ℃、25 ℃、30 ℃、35 ℃的恒温培养箱中进行黑暗培养。采用“十”字交叉法,在菌丝萌发后每隔12 h测量菌丝长度并记录试验数据。当培养2 d后,根据菌丝在培养皿上标记的菌落直径,计算菌丝生长速率。
菌丝生长速率=(第2 d所测菌落直径− 接种块直径)/ 2。
所得数据用SPSS 1.9软件进行方差分析。
(3)不同碳源对致病菌株菌丝长速的影响。分别将15.0 mL不同碳源的试验培养基倒入培养皿(φ=9.0 cm)中,将直径为7.0 mm的接种块接入到PDA培养基中央,每组设置6次重复,置于25 ℃恒温培养箱中进行黑暗培养。测量分析方法同1.5(2)。
(4)不同氮源对致病菌株菌丝长速的影响。分别将15.0 mL不同氮源的试验培养基倒入培养皿(φ=9.0 cm)中,将直径为7.0 mm的接种块接入到PDA培养基中央,每组设置6次重复,置于25 ℃恒温培养箱中进行黑暗培养。测量分析方法同1.5(2)。
(5)pH对致病菌株菌丝长速的影响。将15.0 mL pH不同的试验培养基倒入培养皿(φ=9.0 cm)中,将直径为7.0 mm的接种块接入到PDA培养基中央,每组设置6次重复,置于25 ℃恒温培养箱中进行黑暗培养。测量分析方法同1.5(2)。
(6)光照对菌丝体生长的影响。将直径为7.0 mm的接种块接入到PDA培养基(φ=9.0 cm)中央,分别设置完全光照(24 h光照)、完全黑暗(24 h黑暗)、光暗交替(12 h光照,12 h黑暗)3个处理,每个处理6次重复,25 ℃恒温培养。测量分析方法同1.5(2)。
2 结果与分析
2.1 病害的发生情况
对吉林省蛟河市、汪清县、安图县黑木耳栽培基地进行病害调查的结果显示,该地区黑木耳“面包菌”病的平均发生率为7%左右(表1)。致病菌菌丝白色,很难与黑木耳菌丝相区分。调查时用手触摸菌包,正常菌包质地坚硬,而发病菌包由于基质被病菌快速分解利用,体积缩小,质地软化,手感似软面包,并出现严重的袋料分离现象。
表1 不同调查基地黑木耳“面包菌”病的发病情况
地点调查时间调查袋数发病袋数发病率/% 吉林省蛟河市2020.6.9100 5 5.00 吉林省蛟河市2020.6.10100 7 7.00 吉林省蛟河市2020.6.11100 6 6.00 吉林省汪清县2020.6.16100 8 8.00 吉林省汪清县2020.6.17100 5 5.00 吉林省汪清县2020.6.181001010.00 吉林省安图县2020.6.21100 4 4.00 吉林省安图县2020.6.22100 6 6.00 吉林省安图县2020.6.23100 9 9.00
2.2 致病菌株分离与鉴定结果
本试验对10个染病菌包进行了致病菌株分离培养,获得10个菌株,观察结果显示各菌株菌落形态和显微形态特征均一致,判断为同一种真菌。并对代表菌株PC01进行形态学和分子鉴定。
(1)形态学鉴定。普通光学显微镜下40×菌株PC01的菌丝和孢子形态图如图1(A、B、C)所示,100×如图1(D)所示。显示菌株PC01菌丝具有以下特征:菌丝体发达,在平板上呈扩散状生长,有隔有分枝,小分枝顶端着生孢子或厚垣孢子,小分枝大小一般为7.5~10 μm×5~7.5 μm。
厚垣孢子呈浅黄色,通过小枝与菌丝体连接,一般着生于菌丝体分枝的起始位置,呈亚圆形或椭圆形。分生孢子呈梨形、亚圆形或椭圆形,表面光滑,无隔,无色,大小为7~10 μm×5~7.5 μm。宏观看,产孢量极大,呈白色粉末状遍布整个菌落表面。
(2)分子生物学鉴定。经对菌株PC01的rDNA ITS-PCR扩增和测序,获得片段长度为604 bp的DNA序列(序列已上传至GenBank,登录号为SUB8393371)。经NCBI数据库Blast搜索比对,发现该序列与的序列相似性达99%,应为同一个物种。利用PAUP与同属的44个不同种采用最大简约法构建了系统发育树(图2)。分析结果表明,菌株PC01的序列比对结果与匹配。结合宏观经典分类学数据,进一步确定该致病菌株为黄孢原毛平革菌。其生物学分类为:担子菌门Basidiomycota、蘑菇纲Agaricomycetes、多孔菌目Polyporales、伏革菌科Phanerochaetaceae、显革菌属。
2.3 致病性检测
将回接病原菌PC01的菌包与对照在25 ℃下避光培养15 天后,回接菌包出现与病原地所采集样品同样的发病症状(图3)。再次对回接菌包进行菌株分离,可得到致病菌株PC01,而无法分离得到黑木耳菌株。硬度和重量测定结果表明,染病菌包平均硬度和重量分别为663.54 g和491.65 g,较正常健康菌包的硬度(2091.31 g)和重量(608.57 g)分别减少68%和19%。可见,黄孢原毛平革菌为黑木耳“面包菌”病的致病菌株。
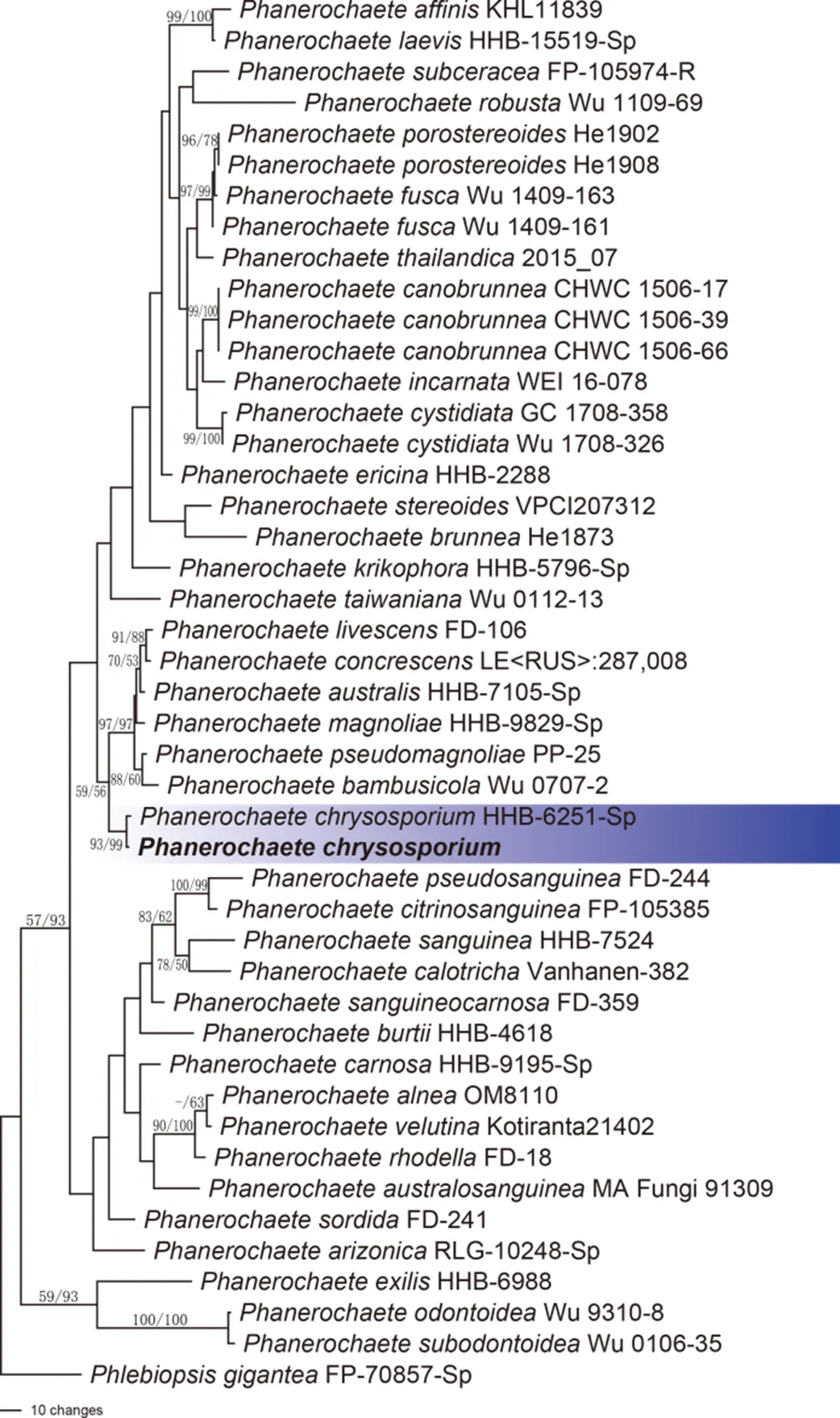
图2 基于ITS和LSU基因序列联合分析的最大简约树
注:阴影处为致病菌株的系统发育位置,MLBP(左)>50%和MPBP(右)>50%的值在图中标注。
2.4 致病菌株生物学特性
(1)温度。不同温度下菌株PC01的菌丝生长速率见图4,差异显著,从大到小依次为30 ℃> 35 ℃>25 ℃>20 ℃>15 ℃。30 ℃下菌丝生长最快,也最浓密。
(2)碳源。菌株PC01的菌丝在5种碳源培养基上的生长速率总体差异不大(表2),但长势有不同,以可溶性淀粉培养基的菌丝长势好、浓密且生长速率显著快于其他处理。不同碳源培养基的生长速率由大到小为:可溶性淀粉>蔗糖>麦芽糖>糊精>葡萄糖,最适碳源为可溶性淀粉。
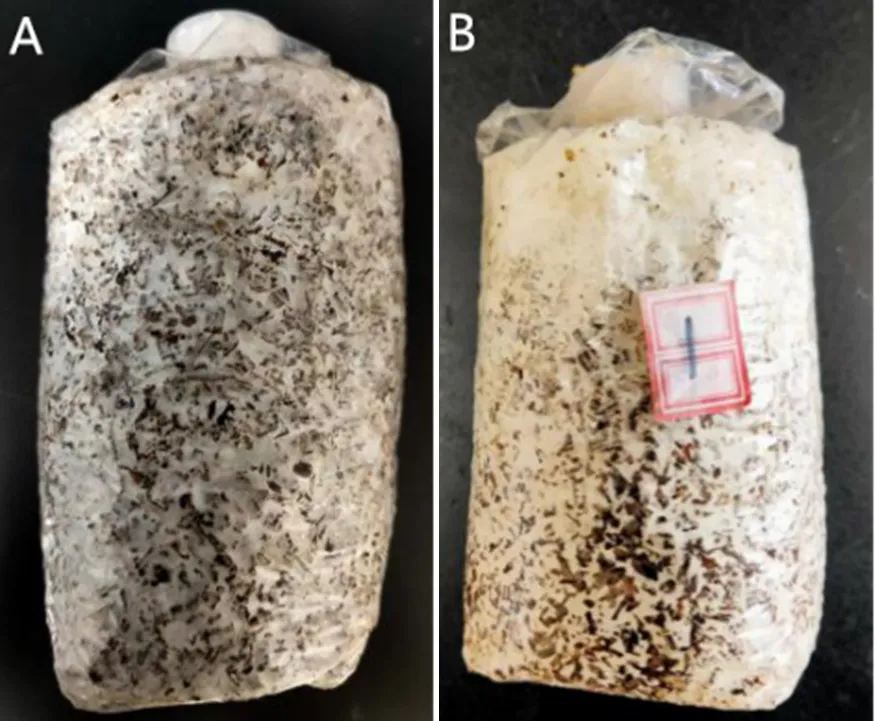
A. 健康黑木耳菌袋(CK);B. 回接致病菌株菌包

图4 温度对菌丝生长的影响
(3)氮源。菌株PC01的菌丝在不同氮源培养基上的长势差异较大,并且生长速率和菌丝密度各不相同(表3)。蛋白胨培养基上的菌丝生长速率最快,菌丝最为浓密;而亚硝酸钠培养基上的菌丝未生长。菌株PC01菌丝在不同氮源培养基中生长速率由大到小为:蛋白胨>酵母浸粉>酵母膏>磷酸氢二铵>亚硝酸钠,最适氮源为蛋白胨,而选择亚硝酸钠作为氮源对该菌丝有明显的抑制作用。
表2 不同碳源对黄孢原毛平革菌菌丝体生长的影响
碳源菌落颜色菌落边缘整齐度菌丝长势菌丝生长速率*/(cm/d) 葡萄糖白整齐+4.44±0.0750 b 蔗糖白整齐++4.67±0.0828 b 麦芽糖灰白整齐++4.66±0.0577 b 糊精灰白整齐++4.58±0.0619 b 可溶性淀粉白整齐+++5.00±0.1892 a 对照(CK)白整齐++4.41±0.0210 b
注:同列数据后小写字母不同表示在<0.05水平上差异显著;+++表示菌丝浓密、健壮,++表示菌丝较密、长势一般,+表示菌丝长势弱;*数据为6次的平均值和标准差。表3同。
表3 不同氮源对黄孢原毛平革菌菌丝体生长的影响
氮源菌落颜色菌落边缘整齐度菌丝长势菌丝生长速率/ (cm/d) 蛋白胨白整齐+++5.35±0.0799 a 酵母膏灰白整齐++5.01±0.0968 b 酵母浸粉灰白整齐+++ 5.23±0.1137 ab 磷酸氢二铵白不整齐+3.41±0.0498 c 亚硝酸钠---- 对照(CK)灰白整齐++5.00±0.1931 b
注:“-”代表菌丝未生长。
(4)pH。pH对菌株PC01菌丝生长速率影响大(图5)。当pH为6.0时,菌丝生长最快;pH为5.0时,生长最慢。不同pH培养基菌丝生长速率由大到小为:6.0>7.0>8.0>9.0>5.0。pH在5.0~8.0范围内,菌丝生长均较浓密。
(5)光照。菌株PC01菌丝体生长受光暗条件影响较大,不同光照处理间存在显著差异(图6)。以完全黑暗条件下菌丝体生长速率最快,为3.99 cm/d,表明光照对菌丝体生长有一定的抑制作用。
3 结论与讨论
近年来,吉林地区黑木耳“面包菌”病时常爆发,对黑木耳生产造成不良影响。本研究确定了从吉林省收集的黑木耳“面包菌”菌包致病菌为黄孢原毛平革菌,并发现该菌喜温暖(最适温度为30 ℃)、偏酸性(pH 6.0)生长条件,而黑木耳菌丝生长最适温度则为25~28 ℃,最适pH 5.0~6.0[18]。因此,中温培养更能在抑制黄孢原毛平革菌菌丝体生长的同时,促进黑木耳菌丝体生长。
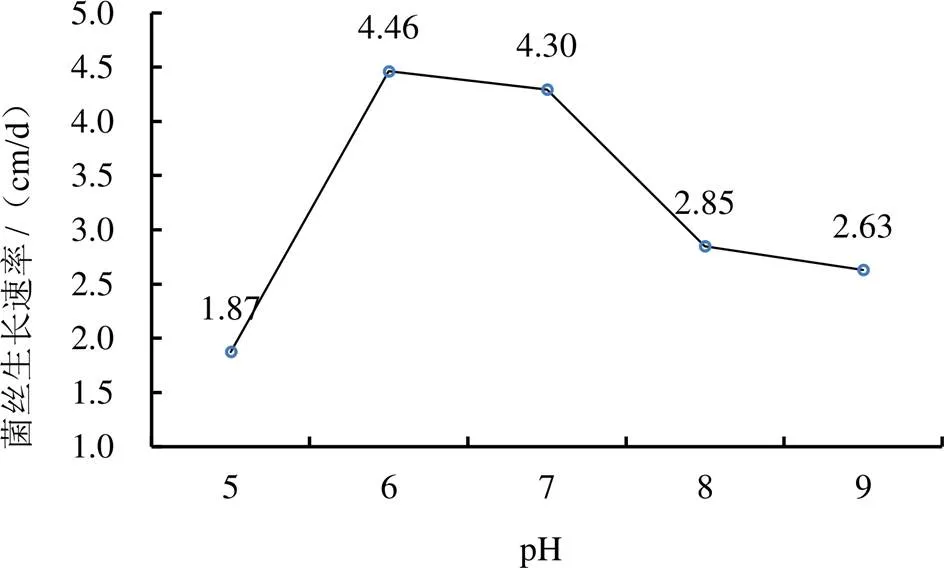
图5 pH对黄孢原毛平革菌菌丝长速的影响

图6 光照对黄孢原毛平革菌菌丝体生长的影响
本研究结果显示,黑暗环境更有利于黄孢原毛平革菌菌丝体生长,光照存在一定的抑制生长作用,这与灵芝蛛网病病原菌[19]和斑玉蕈蛛网病病原菌[20]的研究结果类似。因此,在不影响黑木耳菌丝正常生长的情况下,提供一定时间的光照,避免长时阴暗,有利于“面包菌”病害的防控。
黄孢原毛平革菌菌丝生长的最适碳、氮源分别为可溶性淀粉和蛋白胨,而亚硝酸钠作为氮源对其有明显抑制作用。黑木耳菌丝生长最佳碳源是蔗糖,葡萄糖次之;最佳氮源是酵母浸粉[21]。可利用此差异,在黑木耳培养过程中选择添加适当的碳、氮源。
黄孢原毛平革菌具有分泌木质素过氧化物酶(Lip)[22]、锰过氧化物酶(Mnp)[23]及其他酶类的能力,被广泛应用于造纸、污水处理等工业研究领域[24-27]。但其作为黑木耳生产中的竞争性杂菌,降解培养基质速度及菌丝生长速度远超黑木耳,导致黑木耳菌丝体无法生长而绝收,造成较大经济损失[15]。目前,关于“面包菌”病害的种类还存有争议,尚无证据证明致病过程中黑木耳菌丝被黄孢原毛平革菌菌株侵染,是否发生重寄生现象还有待验证。
由于黄孢原毛平革菌与黑木耳同属于白腐真菌,两者生长所需的环境条件相似,对该病害的防治造成较大困难。建议在黑木耳栽培生产过程中,严格把控每个环节,培养料要充分拌匀,预湿透彻,灭菌彻底;筛选使用优良菌种,规范菌种制作及接种操作;调控好菇房内环境,注意通风。
目前,食用菌生产中可使用的杀菌剂很少,一些杀菌剂如百菌清等虽然对病原真菌有强抑制作用,但也同样抑制食用菌菌丝生长。矿质元素铜是食用菌栽培中理想的杀菌剂,可有效抑制病原真菌生长,对食用菌生长影响较小,但其会提高食用菌的铜含量。铜元素在人机体代谢中起着生物催化剂作用,铜摄入量过低会导致贫血、发育不良等症状,严重时可引起白癜风等疾病[28],而铜摄入过量又会危害人体健康[29]。因此,利用铜元素作为食用菌杀菌剂还有待于进一步研究。
[1] 李玉, 李泰辉, 杨祝良, 等. 中国大型菌物资源图鉴[M]. 郑州: 中原农民出版社, 2015: 216.
[2] Li L, Zhong C, Bian Y. The molecular diversity analysis ofin China by nuclear ribosomal DNA intergenic spacer[J]. Electronic Journal of Biotechnology, 2014, 17(1): 27-33.
[3] Wu Q, Tan Z, Liu H. Chemical characterization ofpolysaccharides and its pharmacological effect on heart antioxidant enzyme activities and left ventricular function in aged mice[J]. International Journal of Biological Macromolecules, 2010, 46(3): 284-288.
[4] Nguyen L, Wang D, Hu D. Immuno-enhancing activity of sulfatedpolysaccharides[J]. Carbohydrate Polymers, 2012, 89(4): 1117-1122.
[5] Sun S, Zhang X, Chen W. Production of natural edible melanin byand its physicochemical properties[J]. Food Chemistry, 2016, 196(APR.1): 486-492.
[6] 食药用菌编辑部. 浅谈中国食用菌产业如何实现可持续发展——中国工程院李玉院士在第十二届中国蘑菇节上的演讲节录[J]. 食药用菌, 2019, 27(1): 1-8.
[7] 前瞻经济学人. 2019年中国食用菌行业细分市场发展现状分析主要菌类仅黑木耳产量下滑[EB/OL]. https://baijiahao.baidu.com/s?id=1656234370721764470&wfr=spider&for=pc. 2020-01-20.
[8] 边银丙. 食用菌病害鉴别与防控[M]. 郑州: 中原农民出版社, 2016: 78-80.
[9] 黄年来, 林志彬, 陈国良. 中国食药用菌学[M]. 上海:上海科学技术文献出版社, 2010: 405-432.
[10] 边银丙. 食用菌菌丝体侵染性病害与竞争性病害研究进展[J]. 食用菌学报, 2013, 20(2): 1-7.
[11] 桑峰, 边银丙. 木耳杂交菌株对绿色木霉菌的抗性测定[J]. 菌物研究, 2011, 9(3): 168-171, 175.
[12] He X L, Peng W H, Miao R Y, et al. White mode on cultivated morels caused by Paecilomyces penicillatus[J]. Fems Microbiology Ecology, 2017, 364 (5) :1-5.
[13] 刘尧, 冮洁, 邓海平, 等. 基于高通量测序的贵州铜仁黑木耳菌棒污染真菌的多样性分析[J]. 食用菌, 2020, 42(4): 59-64.
[14] 吴小平, 彭建升, 谢宝贵, 等. 与食用菌生产相关脉孢菌的分离鉴定及其生物学特性[J]. 食用菌学报, 2008 (1): 79-82.
[15] 刘佳宁, 王玉文, 孔祥辉, 等. “黑木耳代料栽培培养基软化病”病原菌鉴定[J]. 黑龙江科学, 2014, 5(11): 10-13, 25.
[16] 陈铭. 生物信息学[M]. 北京: 科学出版社, 2015: 288-304.
[17] 孙婕. 毛木耳油疤病病原物分离鉴定及其致病性分析[D]. 武汉: 华中农业大学, 2012.
[18] 温亚丽. 木耳属种质资源的遗传鉴定与遗传多样性评价[D]. 南京: 南京农业大学, 2004.
[19] 许蓉, 刘正慧, 付永平, 等. 灵芝蛛网病病原菌及其生物学特性[J]. 菌物学报, 2019, 38(5): 669-678.
[20] 张琪辉, 王威, 李成欢, 温志强. 斑玉蕈蛛网病的病原菌及其生物学特性[J]. 菌物学报, 2015, 34(3): 350-356.
[21] 王敬, 姚方杰, 王小娥, 等. 木耳属4个野生菌株的培养特性研究[J]. 中国食用菌, 2014, 33(2): 15-16, 19.
[22] Tien M, Kirk T. Lignin-degrading enzyme from the hymenomycete hanerochaeteBurds[J]. Science, 1983, 221(4611): 661-663.
[33] Sundaramoorthy M, Kishi K, Gold M H, et al. The crystal structure of manganese peroxidase fromat 2.06-A resolution[J]. Journal of Biological Chemistry, 1994, 269(52): 32759-32767.
[24] Wolfaardt F, Taljaard J, Jacobs A, et al. Assessment of wood-inhabiting basidiomycetes for biokraft pulping of softwood chips[J]. Bioresource Technology, 2004, 95(1): 25-30.
[25] Zhang Y, Geiβen S U. In vitro degradation of carbamazepine and diclofenac by crude lignin peroxidase [J]. Journal of Hazardous Materials, 2010, 76: 1089-1092.
[26] Marco-Urrea E, Perez-Trujillo M, Vicent T, et al. Ability of white-rot fungi to remove selected pharmaceuticals and identification of degradation products of ibuprofen by[J]. Chemosphere, 2009,74: 765-772.
[27] Sakai K, Matsuzaki F, Wise L, et al. Biochemical Characterization of CYP505D6, a Self-Sufficient Cytochrome P450 from the White-Rot Fungus[J/OL]. Applied and Environmental Microbiology, 2018.DOI: https:// doi.org/10.1128/AEM.01091-18.
[28] 童晓玲. 中国高血压基层管理指南(2014年修订版) [J]. 中国医学前沿杂志, 2015, 7(7): 18-40.
[29] 吴敏. 铜在饮水和饮食条件下对小鼠生理效应的影响及机理研究[D]. 杭州: 浙江工商大学, 2018.
Identification and biological characteristics of “bread fungus” disease of
Sui Kunpeng Li Changtian Li Dan1*Li Yu
(Engineering Research Center of Chinese Ministry of Education for Edible and Medicinal Fungi, College of Agronomy, Jilin Agricultural University, Changchun, Jilin 130118, China)
The “bread fungus” disease ofis a competitive disease that occurs insubstituting cultivation. The characteristics of the disease are not easy to detect at the beginning, and spread quickly, greatly impacts on yield after infection. This study identified a pathogenic strain from cultivation substrate ofinJilin Province where is one of the main production regions in China. Isolation and purification test of pathogenetic fungi was conducted, and the results showed thatleads “bread fungus” disease through morphological, phylogenetic and pathogenicity test. The study of biological characteristics of pathogenic strains showed that the optimum growth conditions were as follows: temperature 30 ℃, soluble starch as carbon source, pH 6.0 and peptone as nitrogen source. The light inhibited the growth of mycelial, while darkness stimulated mycelial growth. This study provides a useful reference for effective control of the “bread fungus” disease ofr.
; “bread fungus” disease;; biological characteristics
S646
A
2095-0934(2022)02-119-08
国家重点研发计划(2021YFD1600401);中国科学院战略性先导科技专项(XDA28080304)
隋昆澎(1995—),男,在读硕士,主要从事食用菌栽培与病害防治。E-mail:skp744459033@163.com。
李丹(1983—),女,博士,实验师,现主要从事食药用菌病害研究工作。E-mail:lidan@jlau.edu.cn。

