钽和钛材料的亚慢性毒性研究
王旖,张玲,孙媛之,蒋波,曾荣荣,杨柳,范能全(通信作者)
重庆市食品药品检验检测研究院 (重庆 401121)
随着科技的发展,骨科植入材料经历了从不锈钢、钴铬合金到多孔钽和钛及钛合金的发展过程。近年来的各研究发现,多孔金属材料的三维立体空间构型可为成骨细胞及富含血管的纤维组织提供良好的生长空间和环境,且孔隙直径300~600 μm、孔隙率>75%对于成骨极为有利。多孔金属钽材料的孔径为400~600 μm,孔隙率为75%~80%,具有良好的骨传导性,且与人类松质骨的结构类似[1],具有生物相容性良好、孔隙率高、弹性模量与正常骨相似等特性,是理想的骨科植入物材料[2]。目前,钛材料因其具有质轻、弹性模量低、无磁场、抗腐蚀性等优点,在临床上应用广泛,已成为最有发展前途的人体硬组织理想替代医用生物金属材料[3]。但是作为长期植入体内的医疗器械产品,目前钽、钛两种材料仍存在弹性模量过高、抗腐蚀性和抗菌性较差[3]的缺点,同时存在体液环境中微粒析出、动态环境中材料脱落等风险[4],因此,对这两种材料进行合理的安全性评价具有重要意义。本研究将钽、钛材料制成特定形状植入实验动物肌肉内,通过进行血细胞、血清生化指标、脏器体质量比等检测,综合评价两种材料的亚慢性毒性反应,为这两种材料的进一步实验研究及临床应用提供动物实验证据,现报道如下。
1 材料与方法
1.1 实验材料
钽、钛材料均为直径10 mm、厚1 mm的圆片,由西南医院提供。
1.2 实验动物
36只普通级新西兰兔(雌雄各半);适应期结束后体质量为2.0~2.73 kg,由济南金丰实验动物有限公司提供[生产许可证号:SCXK(鲁)2018-0006];实验动物饲养在受控环境中,温度20~26 ℃,日温差不超过4 ℃,维持12 h明暗交替的光照循环,单笼喂养,自由饮水。
1.3 实验方法
1.3.1实验分组
36只新西兰兔随机分为假手术对照组、钽材料组、钛材料组,每组12只(雌雄各半)。
1.3.2植入途径与方法
实验共进行120 d,其中植入期90 d(将植入手术当天定义为实验第1天),恢复期30 d。植入手术:将钽、钛材料高温(121 ℃)灭菌30 min后,置于烘箱[德国,美墨尔特,型号UN 55]中烘干备用;用脱毛器脱去新西兰兔两侧脊柱旁肌被毛,用3%戊巴比妥钠(上海上药新亚药业有限公司,批准文号 国药准字H31021725, 规格0.1g)1 ml/kg静脉注射麻醉;常规碘伏消毒后,在距脊中线1.5 cm、脊柱中部偏下2 cm处纵行切开皮肤、皮下组织、筋膜,钝性分离竖脊肌(深度为2 cm),假手术对照组不植入任何物体,钽、钛材料组分别植入备用的钽、钛材料(与肌肉紧密接触),然后逐层缝合切口;术后做好伤口消毒,连续给予注射用头孢曲松钠(华北制药河北华民药业有限责任公司,批准文号 国药准字H20045219,规格1.0 g/瓶)肌内注射3 d,0.055 g/(kg·d)。第90天,解剖每组各8只实验动物(雌雄各半)。第91天(恢复期第1天),取出剩余实验动物(每组各4只)的植入物,处理好伤口,连续给予注射用头孢曲松钠3 d,继续喂养至恢复期结束。第121天,解剖剩余实验动物。
1.4 观察指标
1.4.1一般观察
实验期间,每天观察1次实验动物的伤口愈合情况(有无红肿、溃烂等)、外观体征、行为、饮食、对刺激的反应、分泌物、排泄物等,以及死亡情况(包括死亡时间、濒死前反应等)。
1.4.2血细胞与血清生化指标检测
第90、121天,检测各组解剖动物的血细胞与血清生化指标。血细胞指标包括凝血酶原时间(prothrombin time,PT)、活化部分促凝血酶原激酶时间(activated partial thromboplastin time,APTT)、白细胞(white blood cell,WBC)、红细胞(red blood cell,RBC)、血红蛋白(hemoglobin,HGB)、红细胞比容(hematocrit,HCT)、红细胞平均体积(mean corpuscular volume,MCV)、红细胞平均血红蛋白含量(mean corpuscular hemoglobin,MCH)、红细胞平均血红蛋白浓度(mean corpuscular hemoglobin concentration,MCHC);血清生化指标包括肌酐(creatinine,CREA)、谷氨酰胺转肽酶(glutamine transpeptidase,GGT)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、总蛋白(total protein,TP)、白蛋白(albumin,ALB)、总胆红素(total bilirubin,TBIL)、血糖(blood glucose,GLU)、胆固醇(cholesterol ,CH)、甘油三脂(triglyceride,TG),以及各种微量元素(K、Na、Cl、Ca、P)。
1.4.3病理组织学与蛋白芯片检测
第90、121天,解剖剩余实验动物时,对其各脏器进行肉眼观察,同时取肾上腺、肾、脑、心、肝、胸腺进行称重,计算脏器体质量比(脏器湿重/体质量);采集解剖动物的血清,采用RayBiothch提供的蛋白芯片(型号QAL-CYT-1-4,批号123120 0564)检测各组实验动物的差异蛋白;解剖固定后的各组织[包括肝、心、脾、肺、肾、脑(大脑、小脑、脑干)、肾上腺(双侧)、胸腺、脊髓(颈椎、中段胸椎、腰椎)、颌下腺、垂体、气管、食管、甲状腺/甲状旁腺、胆囊、坐骨神经、骨骼肌、胰腺、膀胱、主动脉、睾丸(双侧)、附睾(双侧)、前列腺、精囊腺、卵巢(双侧)、输卵管(双侧)、子宫角(双侧)、子宫颈、乳腺、阴道、胃、十二指肠、空肠、回肠、盲肠、结肠、直肠、骨髓(胸骨)、眼、主支气管、皮肤和实验部位肌肉]通过常规石蜡切片(切片厚4 μm),HE染色,于光镜下进行病理组织学观察。
1.5 统计学处理
2 结果
2.1 一般观察
植入期,假手术对照组、钽材料组、钛材料组分别有2、1、1只实验动物出现伤口红肿、轻微流脓现象,11 d后全部恢复正常;恢复期,钛材料组有1只实验动物出现伤口红肿现象,13 d后恢复正常;植入期与恢复期的体质量以及进食均未见任何异常;两次解剖前,实验动物外观体征、行为活动、毛色、粪便、尿液、呼吸及对外界反应均未见明显异常,处死后解剖观察各个脏器组织均未见明显异常。
2.2 血细胞与血清生化指标
植入期与恢复期,3组的血细胞与血清生化各项指标比较,差异均无统计学意义(P>0.05),见表1~2。
表1 3组血细胞指标比较
表2 3组血液生化指标比较
2.3 脏器体质量比
植入期与恢复期,3组各项脏器体质量比比较,差异均无统计学意义(P>0.05),见表3。
表3 植入期脏器体质量比
2.4 蛋白芯片检测
植入期,与假手术对照组比较,钽材料组有2个差异蛋白,分别为IL-17A、IL-21;钛材料组有6个差异蛋白,分别为IL-17A、IL-21、IL-8、MIP-1b、IL-1a、MMP-9,见表4~5。恢复期,与假手术对照组比较,钽材料组有3个差异蛋白,分别为Leptin,IL-1b,MIP-1b;钽材料组无差异蛋白,见表6。

表4 植入期钽材料组与假手术对照组的差异蛋白

表5 植入期钛材料组与假手术对照组的差异蛋白
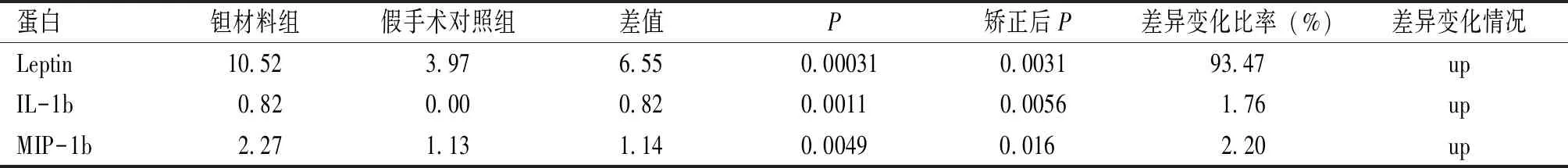
表6 恢复期钛材料组与假手术对照组的差异蛋白
2.5 病理检查
第90、121天,对解剖固定后的各组织进行病理组织学观察,均未见明显亚慢性毒性作用。
3 讨论
随着人们生活水平的不断上升,交通事故、体育运动等损伤的日益增多,钽材料和钛材料相关植入性医疗器械的运用也越来越广泛[5-7],且其优点也已得到有效论证,例如多孔钽具有高孔隙率、高摩擦系数和低弹性模量的特点,其优良的生物相容性、生物活性及骨整合能力在治疗ONFH及关节置换术后翻修骨缺损中临床疗效优良[8];累积叠轧焊加工的钛合金抗腐蚀性较好;表面改性钛合金的生物相容性、耐磨性、抗腐蚀性、抗菌性等也有提高[3]。但两种材料尚存以下不足:(1)高昂的价格与日益增长的需求量相悖,导致国内运用较少;(2)钛材料及其合金的耐磨性、抗腐蚀性、抗菌性等还有待提升;(3)多孔钽和多孔钛主要用于松质骨缺损骨填充材料,未运用于四肢承重骨骨缺损修复,高力学强度与高孔隙率间的矛盾以及植入后的稳定性也有待研究[8]。钽、钛材料作为植入性医疗器械材料,临床重点关注其治疗的有效性、准确性,但其安全性同样值得关注。有研究采用浸提液注射大鼠尾静脉的方法进行医疗器械亚慢性毒性实验[4],其优势是可避免手术创伤对实验动物产生的影响,且大鼠比家兔的生命力更顽强,体征更稳定,个体差异相对较小,饲养方法也更加简便,最终各项数据的可靠性更强,但该染毒方法与样品用途不相适应,未使材料接触到体液并产生相互作用,不能更好地反映出该植入性医疗器械通过手术方式对机体产生的影响。本研究参照GB/T 16886.11《医疗器械生物学评价 第11部分:全身毒性试验》,将两种材料分别植入新西兰兔肌肉中,通过观察血细胞、血清生化、病理检查等指标,未观察到两种材料可能引起的亚慢性毒性反应和延迟毒性反应,为评价这两种材料的亚慢性毒性实验提供了一定的参考价值。
蛋白芯片技术是一种高通量的蛋白质免疫检测分析技术[9],在癌症、自身免疫性疾病、肥胖等多种疾病的研究中均有所应用,相比于ELISA等传统检测方法,其灵敏度更高,可进行多指标联合检测,具有快速、简便、所需样本少、成本低等优点。本实验各项血液、生化、病理检测虽然均未发现明显差异,但利用蛋白芯片技术同时对IL-1a、IL-1b、IL-8、IL-17A、IL-21、Leptin、MIP-1b、MMP-9、NCAM-1、TNFa等指标含量进行初筛,发现与假手术对照组相比,恢复期钛材料的Leptin、IL-1b、MIP-1b均升高,可能由肺及胃肠炎症引起[10-11],如需验证钛材料植入性医疗器械是否会造成肺及胃肠等器官炎症,还需进一步研究。

