NEMA NU2-2018标准与现行国家标准GB/T 18988.1-2013的主要差异
付国涛,王培臣,焦春营,刘迪
1 北京市医疗器械检验研究院 (北京 101111);2 医疗器械检验与安全性评价北京市重点试验室 (北京 101111);3 放疗设备监测与评价重点试验室 (北京 101111)
GB/T 18988.1-2013《放射性核素成像设备 性能和试验规则 第1部分:正电子发射断层成像装置》是我国现行的正电子发射断层成像装置(position emission tomography,PET)性能测试执行的重要推荐性标准。该标准等同采用国际电工委员会(International Electrote-chnical Commision,IEC)发布的IEC 61675—1:1998《Radionuclide imaging device-Characteristics and test conditions-Part 1:Position emission tomography》。由于PET主要制造商的生产场地均在美国[1],其性能测试均以美国电气制造商协会(National Electrical Manufacturers Association,NEMA)发布的标准为主,因此GB/T 18988.1-2013将NEMA NU2-2007《Performance Measurements of Positron Emission Tomographs》的内容作为附录引入。由于IEC 61675—1:1998与NEMA NU2-2007在测试方法上存在一定差别,所以在标准使用过程中应完整地引用两种方法中的任意一种。目前,NUMA NU2-2007标准已经经历了两次较大的版本更新,分别为NEMA NU2-2012和NEMA NU2-2018,我国现行的行业标准与NEMA最新标准(即NEMA NU2-2018)相比已经落后两个版本。本文主要对比了最新版NEMA标准NEMA NU2-2018与现行国家标准GB/T 18988.1-2013附录部分(即NEMA NU2-2007)的差异,并探讨这些差异对PET性能测试所产生的影响,使相关企业和检测机构能更深入地理解新版标准的主要变化,为该标准的转化提供参考。
1 现行国标GB/T 18988.1-2013简介
GB/T 18988.1-2013规定了PET性能测试的测试方法[2-4],主要测试内容包括空间分辨率、散射分数、计数损失和偶然符合测量、灵敏度、精确性(计数损失与偶然符合计数校正)、图像质量及衰减校正与散射校正的精确性等,测试目的是提供一组可以比较的PET性能测量值,测试结果可由制造商引用作为PET的性能特征。随着PET性能测试方法的逐渐成熟,潜在用户可能会采用这些测试方法来比较不同制造商生产的设备性能,该标准制定的标准测试方法有助于用户进行验收测试。但GB/T 18988.1-2013并未定义PET性能指标的限值要求或者典型值要求,而是将测试细节(如数据采集频率等指标)留给制造商来确定,同时由于进行各种测试的困难程度和每个测试结果的精度各不相同,采用哪一个结果作为设备性能的典型值也由制造商来确定。此外,该标准制定的测试方法主要针对用于全身肿瘤成像的PET,并不能反映其他类型PET(如脑部成像专用PET)的最佳性能;该标准假定使用此标准的PET系统均可创建正弦图和断层切片图像,并能够确定和操作二维圆形或者方形的感兴趣区域以及能够获取在特定时间间隔内探测到的符合事件计数等参数,系统的横向视野大小应当适用于人体检查。除了图像质量测试之外,其他所有测试的可用直径至少应大于260 mm,并且使用的模体长度均为70 cm,为了测得所有断层切片的性能,轴向视野应不大于65 cm。对于图像质量测试,可用的扫描直径应至少为350 mm。虽然看起来图像质量测试可以适用于脑部成像PET系统,但需要注意该标准的测试方法是为全身PET系统设计的,并不适用于专用脑部成像系统。
2 NEMA NU2-2018与GB/T 18988.1-2013的主要差异
与GB/T 18988.1-2013相比,NEMA NU2-2018的最大变化是增加了两个新的章节[2]:第8章飞行时间(time-of-flight,TOF)分辨率和第9章PET/CT配准精度。其他的差别是一些相对次要的变化,目的是使测试更加方便可行。
2.1 空间分辨率测试
GB/T 18988.1-2013要求测试所用放射源为18F,且要求放射源分布由少量浓缩放射性液体组成,盛装液体的毛细玻璃管的内径为1 mm或更小,外径不超过2 mm,放射性物质在毛细玻璃管中的轴向长度不超过1 mm;而NEMA NU2-2018允许的测试所用放射源为18F和22Na,增加了一个可选的放射源22Na,同时明确要求放射源的分布为一个点状的放射源(线源被指定为备选),每一个点源都由在各个方向上不超过1 mm的浓缩放射性液体组成,可以用毛细玻璃管或者其他器具盛装这些放射性物质。
2.2 散射分数、计数损失和偶然符合测试
GB/T 18988.1-2013要求测试模体放置在制造商提供的标准检查床上,并使线源最接近检查床,模体中心位于设备横向和轴向视野的中心,误差不超过5 mm,且在计数损失和偶然符合测试(涉及计数损失和偶然符合校准的准确性测试及TOF分辨率测试,它们均使用同一测试数据)的数据分析步骤中,并未提及具体的数据分析轴向区域;而NEMA NU2-2018为了使测试结果更加准确,要求测试模体放置在指定位置,位于横向视野的中心,床的底部位于横向视野中心下方(15±1)cm处(等效于将患者放置在横向视野的中心,实际操作时可以将塑料泡沫块或其他类似物品放置在扫描系统视野外用于支撑测试模体),同时要求数据分析区域不包括轴向视野中心80%区域之外的切片图像。
2.3 图像质量测试
在对于放射源的分布描述中,GB/T 18988.1-2013要求在2个最大的球体(内径28、37 mm)中填充水,用于冷区成像,4个最小的球体(内径10、13、17、22 mm)中填充18F,用于热区成像,球体的中心应距离体部模体的端板68 mm,使它们在轴向上位于同一断层内;而NEMA NU2-2018中,内径28、37 mm的冷成像区被替换为热成像区,所有的6个填充球均填充18F用于热区成像,球体的中心应距离体部模体的端板70 mm,使它们在轴向上位于同一断层内。
在对放射性核素的描述中,GB/T 18988.1-2013要求冷区应充满不含放射性物质的水,热区中应填充放射性活度比本底高N倍的放射性物质(N等于4和8);而NEMA NU2-2018删除了热区和背景放射性活度比为8︰1的要求,所有的填充球内均填充4倍于背景活度的放射性物质。
在对于衰减校正和散射校正精确性的计算中,GB/T 18988.1-2013要求直径为(30±2)mm的圆形感兴趣区域应位于肺插件的中心,对每层切片图像i,记录感兴趣区域内的平均像素值Clung,i,12个直径为(30±2)mm的圆形本底感兴趣区域应位于每层本底感兴趣区域所在处;而NEMA NU2-2018中,直径为(30±2)mm的圆形感兴趣区域同样位于肺插件的中心,需在去除肺插件边缘30 mm以内的切片图像后再对肺插件内的切片和感兴趣区域进行处理。
2.4 第8章TOF分辨率
NEMA NU2-2018新增加的第8章TOF分辨率[5]是为了提高TOF测试的精度。TOF分辨率被表征为探测器响应的半高全宽(full width at half-maximum amplitude,FWHM)。该测试方法表征了探测数据固有的TOF分辨率,并不涉及重建过程或者TOF重建图像,所采用的模体与散射分数测试的模体相同,所采用的放射源为18F(18F活度应足够高,使得采集的噪声等效计数率曲线中包含峰值);放射源的位置与数据采集过程等与散射分数测试基本相同。被测响应线与模体的空间位置关系见图1。
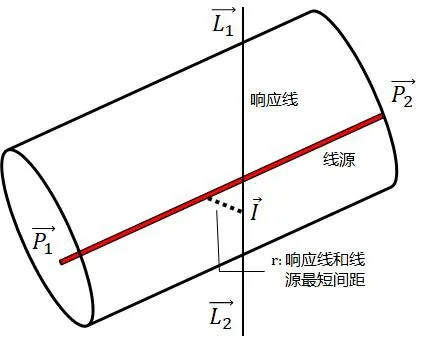
图1 响应线与线源的最短间距示意
TOF分辨率测试的数据处理与分析中,线源方向的单位向量为:
(1)

响应线(line-of-response,LOR)方向的单位向量为:
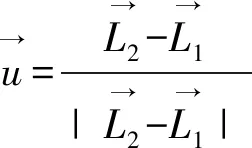
(2)
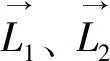
LOR和线源的间距为:
(3)
式中,r为响应线到线源的最短间距。LOR上距离线源间距最近的点为:
(4)

测试TOF与期望TOF的时间偏差为:
(5)
式中,t1、t2为一对符合事件中两个光子各自的到达时间(单位为ps)。
减去随机符合计数与散射符合计数后的一维时间直方图用公式计算:
(6)
式中,Cj(t,r)为第j次采集形成的二维计数直方图,CL,t,j、CR,t,j为以Cj(t,r)为中心,在40 mm带宽内左侧和右侧各自的计数。
根据获得的一维时间直方图Cj(r),计算直方图FWHM作为TOF分辨率。
2.5 第9章PET/CT配置精度
新增加的第9章PET/CT配置精度[6-7]是为了测定PET数据和CT数据直接的配准误差。该测试需获取位于PET和CT感兴趣区域内的6个位置的基准标记物的重建数据,并且在检查床上均匀放置115 kg的配重来模拟患者,要求提供数据中基准标记物的分布宽度,基准标记物的中心位置可通过计算获得,配准精度误差通过计算基准标记物中心的距离确定。基准标记物应分别满足PET成像和CT成像的要求,重建图像的中心应一致,大小应满足特定的要求,包含的放射性物质可以为18F和22Na,并且CT值应大于500 HU。模拟患者的配重为(115±2.5)kg,其中一半的质量均匀分布在直径为65 cm的区域内,该范围与检查床的近端距离为20 cm,剩余的质量均匀分布在直径为65 cm的区域内,两个区域中间的距离为30 cm。采集过程中检查床的高度固定,位于横向感兴趣区域中心下方(15±1)cm处。6个基准标记物分为两组,放置在两个横向平面上,其中一个平面位于床近端5 cm处,另外一个平面位于床近端100 cm处。在横向平面中,3个基准标记物的坐标分别为(0,1)cm、(0,20)cm和(20,0)cm。所有的断层图像均应使用制造商推荐的用于全身成像的标准重建算法进行重建,并应计算6个基准标记物的最大误差。
3 讨论
NEMA NU2-2018最大的变化是增加了两个章节,即第8章TOF分辨率和第9章PET/CT配准精度。
TOF分辨率表征探测系统探测光子对到达探测器时间差的不确定性[5]。TOF技术理论于20世纪60年代被提出,但直到2000年左右,该理论才被逐渐应用于临床,目前是PET最热门和最核心的技术[8],很多制造商都在积极深入地研发TOF技术。TOF-PET与传统PET最大的区别在于,其能根据两个伽玛光子飞行到两端晶体条的时间差,来确定湮灭反应发生在LOR上的大致位置。由于传统PET无法预知湮灭反应发生的位置,因而只能将每条LOR对应的事例等权重分配到该LOR经过的所有路径,而TOF-PET能够按照不同的权重对LOR上的计数进行分配,可以带来更好的图像质量、更少的用药剂量、更快的采集速度。TOF分辨率是体现设备性能的重要参数,因此NEMA NU2-2018引入了TOF分辨率的测试。
PET和CT系统集成在一起的一体化成像系统经过十多年的快速发展,目前已经是核医学成像设备的主流产品,其目的是将两种成像模态图像结合起来,呈现出解剖结构图像和功能图像的多方面信息,形成优势互补。PET数据和CT数据之间的配准精度对图像重建过程中的衰减校正处理和感兴趣的解剖结构的定位是非常关键的,许多系统校正了PET和CT系统机架的机械偏差,将残余配准误差减小到最低,这对于衰减校正和定位是非常重要的。配准的误差在一定程度上影响对图像的解读,因此NEMA NU2-2018加入了PET/CT配准精度的测试。
NEMA NU2-2018的其他变化,如空间分辨率、散射分数等,主要是为了使测试更加容易进行,具有更好的重复性,对位置放置等的描述更加清楚。在图像质量测试中,内径28、37 mm的冷成像区被同样大小的热成像区代替,考虑的是正常的生物组织中不会有如此大的冷成像区,而比较大的冷成像区可能并不是软组织(一般为骨骼等结构),所以设置两个冷成像区并不能准确地模仿人体组织;而删除了热区和背景放射性活度比为8︰1的要求,主要考虑到PET技术的进步,肿瘤等高代谢疾病区域均可以被早期发现,临床上较少出现活度比为8︰1的情形,而活度比为4︰1的情形则是更为常见的情况,因此活度比为4︰1的定量结果更能反映临床实际使用情况;肺插件的残差分析去除肺插件边缘30 mm以内的切片图像,是由于每项测试均应尽可能测试设备所能达到的最好性能,而轴向边缘的数据容易受到两端其他物质的成像数据影响,从而导致定量结果变差,去除肺部边缘比较大的范围内的数据,可保证得到系统能达到的最好肺部区域的成像能力;对于将模体位置的摆放,明确为应将其放置在床体上,既使床体不能升高到使模体中心与系统中心对应的位置,也禁止将模体悬在床体上方,这样的摆放要求可以保证测试模体的摆放方式与患者实际检查的位置保持一致,避免为了获取好的模体定量测试结果,而将模体悬空放置的情况出现。
4 小结
综上所述,NEMA NU2-2018相比于GB/T18988.1-2013,引入了TOF分辨率和PET/CT配准精度的测试,改进了一些测试方法,其要求更加明确、更具有针对性和可操作性,并且顺应了PET设备的发展趋势,有利于促进新技术的发展和运用,能够更好地反映设备的性能,具有先进性和科学性。本研究浅析了标准变化的情况,以期为制造商及检测和监管部门提供参考,并为新版国家标准的制修订提供参考和必要的依据。

