肝移植术后自发性肝破裂出血1例报告
马 健, 何力宏, 王凌云, 翟亚楠, 李 汛, 张 磊
1 兰州大学第一医院 a.普外科,b.影像科, 兰州 730000; 2 兰州大学第一临床医学院, 兰州 730000
1 病例资料
患者男性,55岁,因乙型肝炎肝硬化失代偿期于2020年8月14日在兰州大学第一医院普外科行同种异体背驮式原位肝移植术。供体来自23岁女性,重度颅脑损伤达到脑死亡状态,捐献前无既往病史,按照中国一类(C-1)器官捐献获取流程实施。采用肝肾联合获取法,获取过程顺利。供肝体外修整术中,仔细结扎和缝扎了下腔静脉上的小静脉分支,注气法检查无渗漏。缝扎了供肝各韧带中可疑的血管断端,查肝动脉未见变异,仔细检查供肝各部位,未发现肝实质撕裂伤或包膜下血肿。肝移植手术历时390 min,冷/热缺血时间为240 min/8 min。术中输入红细胞5 U、血浆750 mL、晶体1800 mL、胶体液1000 mL。术中使用乙型肝炎人免疫球蛋白1000 U、巴利昔单抗20 mg、甲泼尼龙琥珀酸钠500 mg,手术过程顺利,胆管吻合时可见胆汁泌出,关腹前检查术野无活动性出血,供肝血供良好,色泽红润均一,未见撕裂伤及包膜下血肿,腹部切口无张力,顺利关腹。术后采用“他克莫司+吗替麦考酚酯+甲泼尼龙”三联免疫抑制方案,自术后第3天开始给予低分子量肝素钙4100 IU,每日1次皮下注射行抗凝治疗,术后患者恢复良好,肝功能逐渐正常。术后主要临床指标见图1~4。
术后第10天,患者于午睡中突觉中上腹胀痛难忍,查体示:腹软、无压痛、反跳痛及肌紧张,生命体征平稳,给予帕瑞昔布钠、654-2对症治疗,效果欠佳,疼痛持续,急行床旁B超示(图5a):怀疑腹腔积血。遂行B超引导下诊断性腹腔穿刺,穿出不凝血3 mL。急行全腹CT示(图5b~d):肝尾状叶增大并密度不均匀,周围高密度影延伸小网膜囊及脾胃间隙、胃体及横结肠间,病灶呈包裹状,考虑出血;盆腔积血。遂在床旁行局麻下超声引导下腹腔穿刺置管引流术,引流管引出暗红色血性液体,给予卡络磺钠氯化钠注射液、氨甲环酸止血,观察1 h,引出血性液体量约100 mL,患者心率增快至104~110次/min,血压93~102/60~67 mmHg,考虑患者失血性休克代偿期,遂急诊行剖腹探查术,术中见肝周及盆腔凝血块,肝尾叶表面探及一处不规则裂口,长约3 cm×0.5 cm×1 cm,裂口处肝实质可见活动性出血,小网膜囊有凝血块,量约1000 mL。清除积血,以4-0普理灵缝线(Prolene,美国强生)间断缝合裂口,电刀喷凝止血后以止血材料(纤丝速即纱1962,美国强生)覆盖肝脏裂伤处(图6)。术后送入ICU,3 d后病情平稳转普通病房,于术后1个月顺利出院。
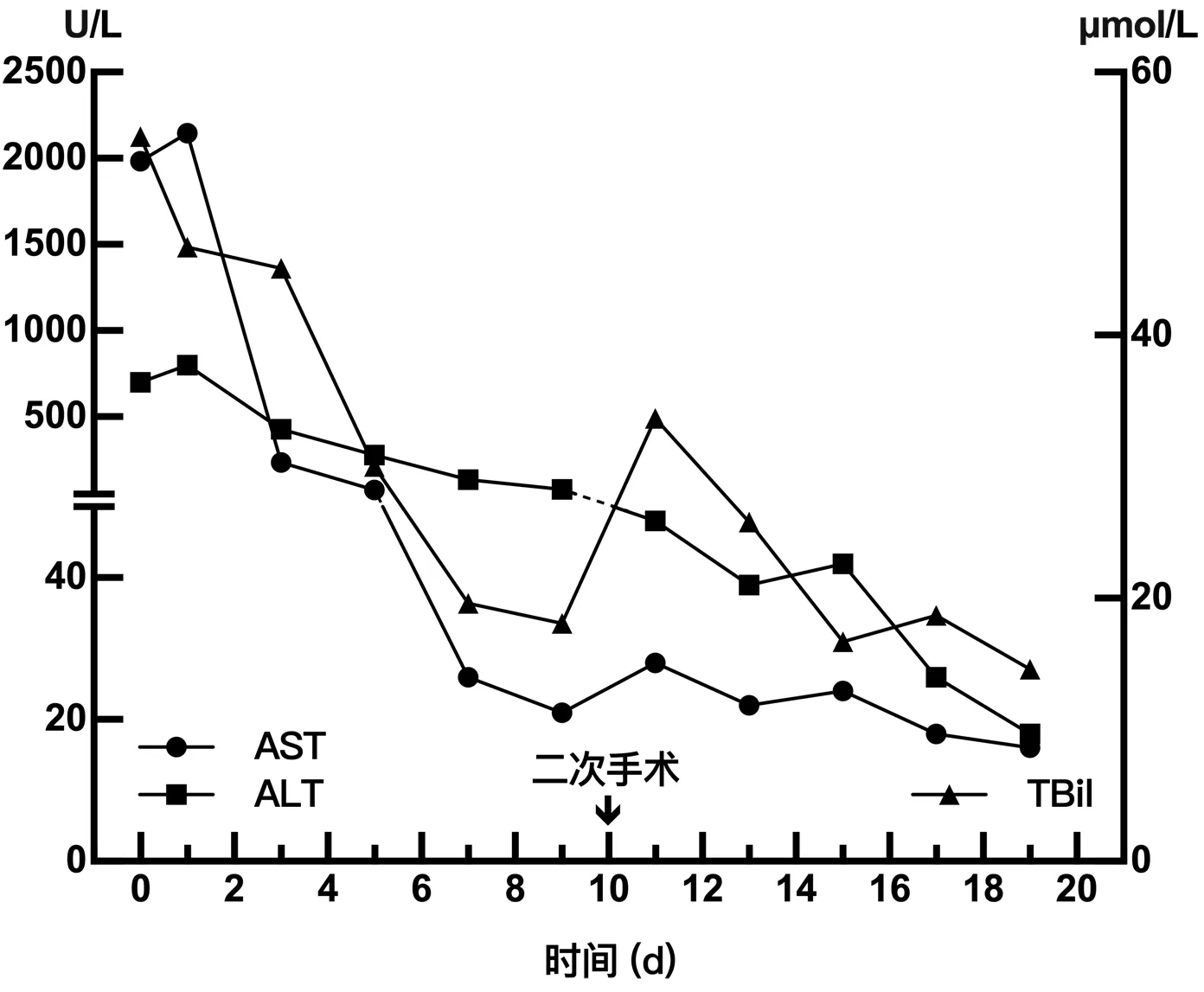
图1 围手术期肝功能主要指标变化Figure 1 Profile of the perioperative liver function
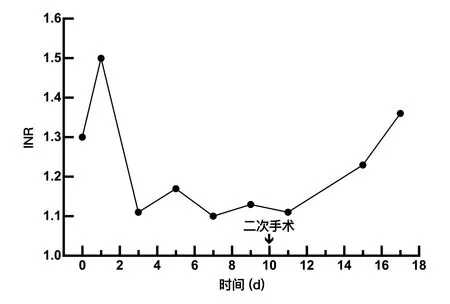
图2 围手术期INR变化 Figuer 2 Profile of the perioperative lNR
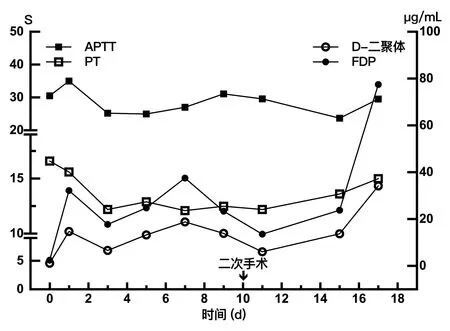
图3 围手术期凝血指标变化Figure 3 Profile of the perioperative coagulation function
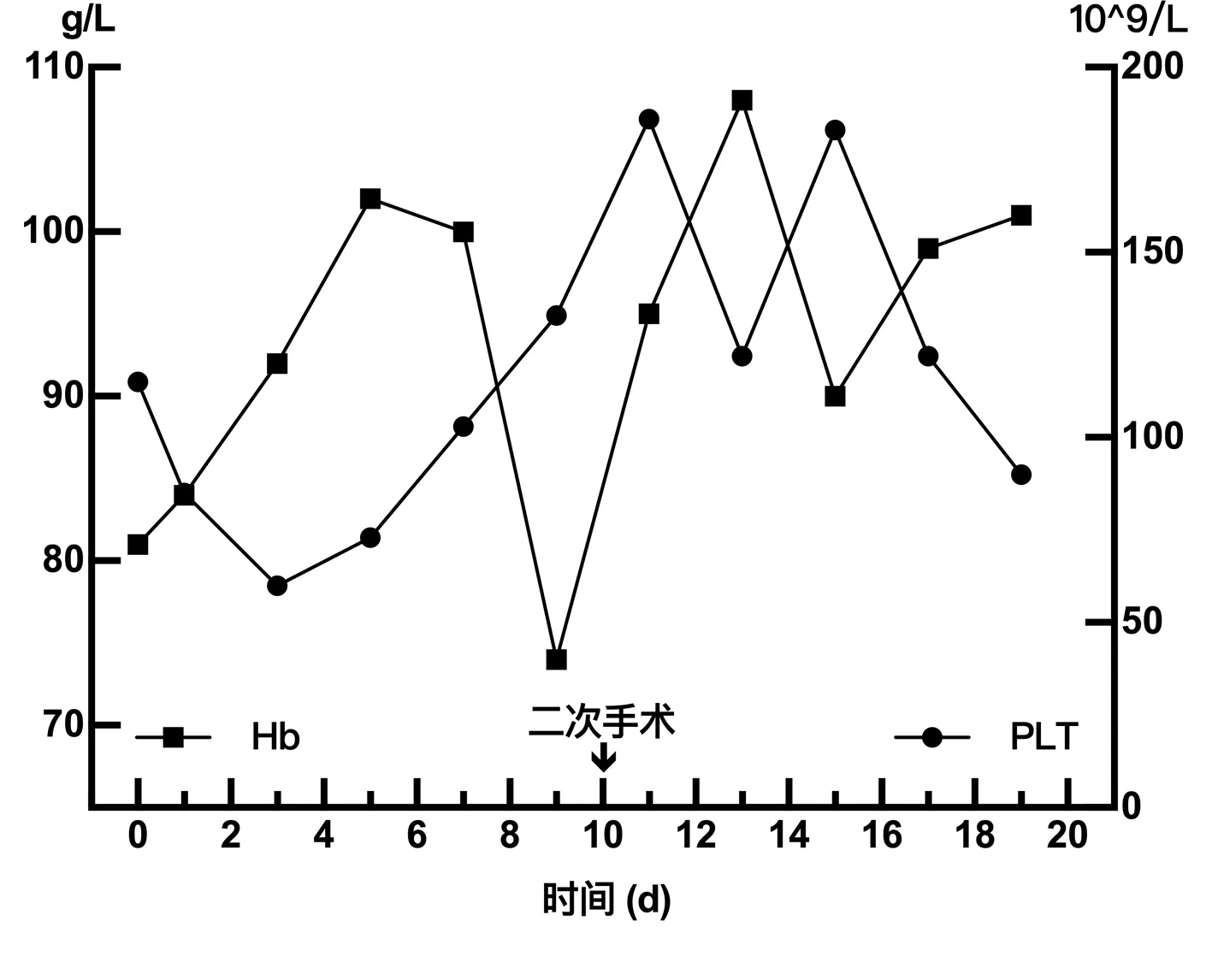
图4 围手术期Hb、PLT指标变化Figure 4 Profile of the perioperative Hb and PLT
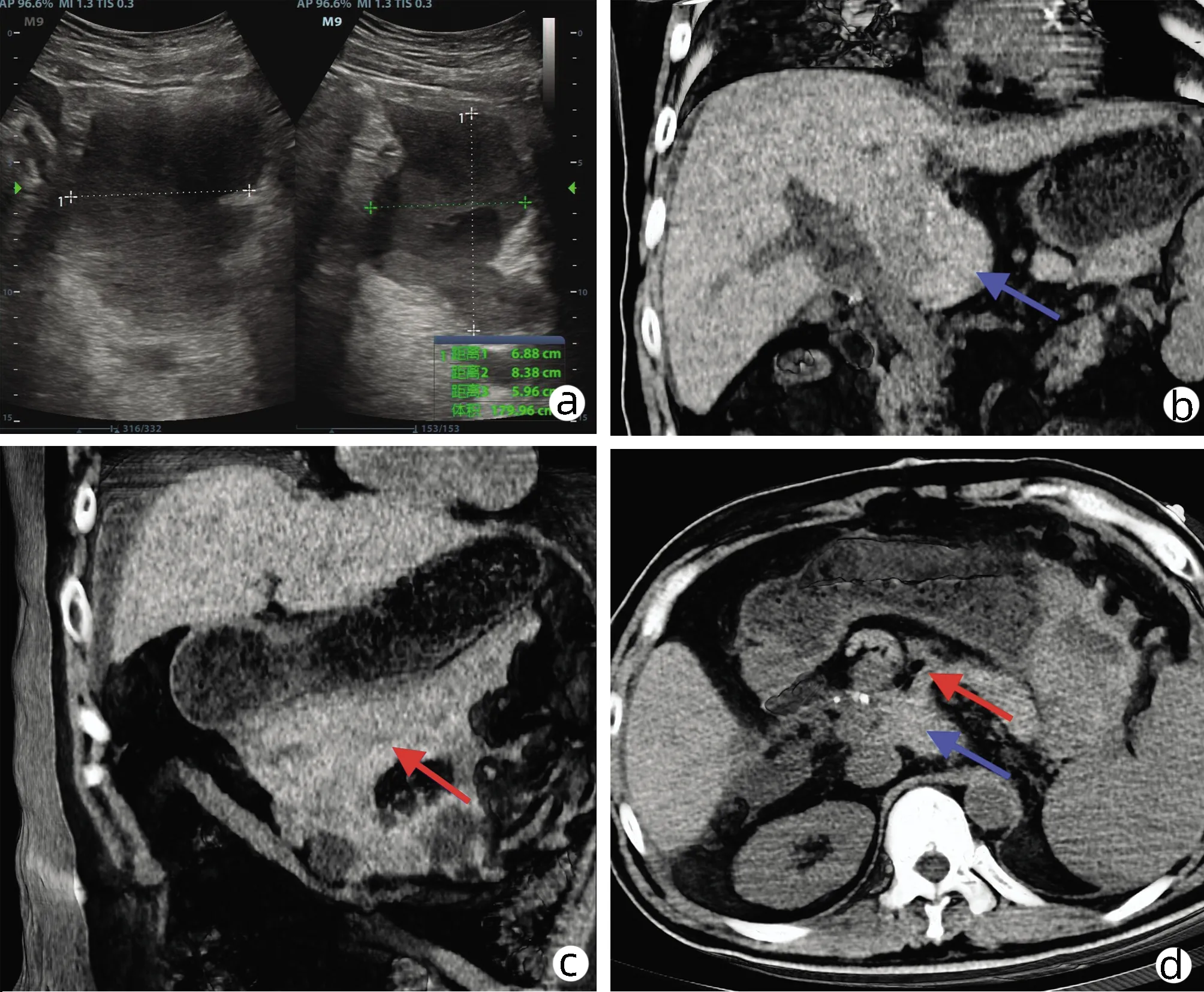
注:a,超声示腹腔积血;b,CT示肝尾状叶增大、出血;c,CT示小网膜囊积血;d,CT示积血自肝尾状叶延伸至小网膜囊。蓝色箭头示肝尾状叶 区,红色箭头示积血。
2 讨论
肝移植术后肝破裂是一种少见却严重的并发症,其可导致移植物失功,甚至威胁患者生命[1]。这种少见的并发症在全肝移植及活体肝移植中均有所报道[2-4],但其出血的机制及其防治措施,国内外文献较少涉及。
通常认为,肝移植术后早期肝包膜下血肿、破裂出血的主要原因是继发于各种移植肝的创伤以及患者凝血功能差[5]。移植肝的创伤多因为术后侵入性操作,比如肝穿刺活检、经皮经肝穿胆管置管引流[2],甚至继发于内镜下逆行性胰胆管造影术[6];也有报道[4]发生于患者术后意外摔倒。原位肝移植供肝获取时,常因为暴力操作而发生手术失误,导致肝脏撕裂伤。这是供肝获取时常见的损伤形式,占总损伤的83.6%[7]。多发生于肝周韧带附近,如肝-肾韧带(即肝脏与后腹膜的交界)、肝脏-膈肌间的左右冠状韧带和三角韧带[8],右肝因紧贴后腹膜,位置深,游离困难,损伤较多见[9]。供肝撕裂伤通常在供肝修整时被发现和修复。本例患者供肝获取及体外修整过程中未发生撕裂伤,术后没有外伤及侵入性操作史,为术后10 d自发性移植肝破裂,多考虑与手术过程中微小创伤有关[10]。由于技术限制及人为因素,术中微损伤不可避免,尤以活体肝移植为著,主要为移植肝修整时发生的损伤,并且由于侧支循环的丧失,移植肝对微创伤更为敏感[11],手术中对肝脏的翻动以及拉钩的使用,可能会对肝造成极微小的创伤。这在肝部分切除中也是存在的,但移植肝因为缺血再灌注的原因,对微损伤耐受差[12]。由此提示,在取肝修肝到移肝全程,都应该小心操作,避免失误导致微创伤甚至裂伤。

注:可见尾状叶破裂出血,行缝扎止血。蓝色箭头示肝尾状叶区,黄色 箭头示肝动脉。
肝脏是调节凝血平衡的核心器官[13],肝移植围手术期凝血功能的变化,可能造成出血、肝动脉血栓等风险。患者在新肝期及移植术后有凝血功能再平衡的过程,这期间稀释性凝血功能障碍和消耗性凝血功能障碍及抗凝药物的使用,均可使脆弱的凝血再平衡过程变为低凝状态导致出血。本病例患者凝血功能及PLT计数,移植术后基本恢复正常。对于肝移植围术期的凝血功能管理,文献推荐血栓弹力图作为围手术期常规检测项目,其能更真实地反映体内凝血再平衡状态,评估出血风险更为敏感[14],这一点值得在工作中应用和推广。
移植术后肝破裂出血的诊治关键在于早发现,本例患者术中证实肝破裂发生在肝尾状叶。肝尾状叶解剖位置深在,破裂出血后常积于小网膜囊内, 这使尾状叶闭合性损伤的早期诊治难度较大。本例患者于午睡中突然出现不特异的腹痛症状,生命体征平稳,查体腹软,无腹膜炎体征,常规解痉止痛无效,虽然在腹痛未发生的早上,患者常规做了肝移植术后B超,各个血管、吻合口、肝脏形态大小都正常。但对这种症征不符的腹痛也应重视,遂再次行床旁B超,发现问题。因此,笔者认为患者出现的症征不符的情况应该被重视,床旁B超是方便、快捷的检查,能发现腹腔积液及积血,宜为首选。诊断性腹腔穿刺对于腹腔出血诊断准确率高、创伤小,但是对于尾状叶破裂等位置特殊的出血可能出现假阴性。B超先行,若发现细点状高回声等血性腹腔积液典型征象,B超引导下行诊断性腹腔穿刺则更有诊断价值,也可以避免误伤。如果B超不能明确腹腔出血的原因,在患者生命体征平稳的情况下,行急诊CT平扫,可以明确出血原因和部位,避免盲目探查,缩短探查止血的时间。若患者生命体征不平稳,则应该积极抗休克的同时,尽快开腹探查[15]。
本例患者诊断明确后,急诊行外科手术治疗,外科手术是治疗肝破裂出血的主要方法[1],除了能确切止血,同时清除腹腔积血,可以避免腹腔血肿机化感染带给移植患者的二次打击[15]。基于外伤肝破裂的治疗经验,在患者生命体征平稳的状态下,介入栓塞治疗也是一种好的方法[16],但在综合本例患者血流动力学及腹腔引流情况,本团队讨论认为,介入栓塞可能不会出现造影剂外溢征象,无法明确出血部位,盲栓动脉可能会损失移植肝功能。另外,腹腔积血不能清除,影响患者术后胃肠功能恢复并可能造成腹腔感染。综上,选择手术探查。然而,肝移植术后肝破裂部分病例在早期表现为包膜下血肿,治疗方式可选择非手术治疗,譬如:肝被膜下血肿形成后,动态CT监测考虑活动性出血,血肿逐渐增大,则可采用经肝动脉造影,超选出罪犯血管行明胶海绵栓塞止血,进而猪尾管穿刺引流血肿,避免血肿压迫肝静脉系统。多普勒超声用来监测肝静脉流速,血肿压迫肝静脉甚至下腔静脉,亦可考虑行静脉支架植入,解决流出道梗阻,避免移植物失功[2]。对于血肿破裂的患者,要对其血流动力学、腹膜炎症状、失血状态以及脏器损伤进行全面的评估,外科手术可能是最佳选择,术中可参照美国外科创伤协会肝损伤分级标准,选择单纯缝扎止血、纱布压迫、不规则肝部分切除,带蒂大网膜包裹填塞等术式,有效止血,抢救患者生命和移植物功能[17]。
伦理学声明:本例报告已获得患者知情同意。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:马健负责拟定写作思路,资料分析,撰写论文;何力宏、王凌云、翟亚楠负责资料采集,修改论文;张磊、李汛负责指导撰写文章,修改论文并最后定稿。

