妊娠期急性脂肪肝临床管理指南(2022)
中华医学会妇产科学分会产科学组
妊娠期急性脂肪肝(acute fatty liver of pregnancy,AFLP)是一种罕见但病情危急的产科特有疾病[1]。其一般发生于妊娠30~38周,以妊娠35周左右的初产妇居多[2-3],发病率介于1/20 000~1/7 000[4-5],母儿病死率曾一度达到75%~85%[6]。虽然目前对于AFLP的早期确诊率已明显提高,但不同医院对于AFLP的临床管理方法往往不一致,其疗效差异也较大。因此,规范和标准化AFLP的临床管理是有效改善母儿结局的重要举措。鉴于此,中华医学会妇产科学分会产科学组按照循证临床实践指南制订的方法和步骤,基于最新的研究证据,结合我国临床实际,制订了本指南。
1 指南的制定程序
(1)指南发起机构与专家组成员:本指南由中华医学会妇产科学分会产科学组发起,由推荐意见分级的评估、制订和评价(grading of recommendations assessment, development and evaluation, GRADE)中国中心提供技术支持与指导。
(2)指南工作组:本指南成立了多学科工作组,主要涵盖产科、消化内科、感染科、肝胆外科、麻醉科、重症医学科及循证医学等学科的专家。证据的检索和评价由兰州大学基础医学院循证医学中心完成。
(3)指南注册与计划书撰写:本指南已在国际实践指南注册平台(International Practice Guidelines Registry Platform,http://www.guidelinesregistry.org)进行了注册(注册号:IPGRP2019CN061)。本指南的设计与制订遵循2014年发布的《世界卫生组织指南制定手册》[7],及2016年发布的“制订/修订《临床诊疗指南》的基本方法及程序”[8],并参考了指南评价工具AGREE Ⅱ(Appraisal of Guidelines for Research and Evaluation Ⅱ)和报告规范RIGHT(Reporting Items for Practice Guidelines in Healthcare)。
(4)指南使用者与应用的目标人群:指南的使用者为临床医师。指南推荐意见的应用目标人群为可疑或确诊的AFLP孕妇。
(5)临床问题的遴选和确定:通过系统查阅AFLP领域已发表的文献,工作组初步拟定了45个临床问题,以在线问卷(https://www.wjx.cn/)的形式对临床问题的重要性进行打分(1~5分,1分为不重要,5分为很重要)。第一轮调研回收了国内各级医院809位产科、感染科、麻醉科、重症医学科、肝胆外科、消化内科医师及多位AFLP痊愈孕妇的答卷。基于对第一轮临床问题的反馈结果,工作组进一步整理出22个临床问题,并对13位产科、麻醉科、重症医学科、消化内科及感染科专家开展了第二轮调研,最终遴选出本指南拟解决的9个临床问题。
(6)证据的检索:工作组针对最终纳入的临床问题与结局指标,按照人群、干预、对照和结局(population,intervention,comparison and outcome,PICO)原则对其进行解构,并根据解构的问题检索:①MEDLINE、Cochrane Library、Epistemonikos、CBM、万方和中国知网(CNKI)数据库,主要纳入系统评价、荟萃分析(Meta分析)和网状Meta分析,检索时间为建库至2020年6月;②UpToDate、DynaMed、MEDLINE、CBM、万方和CNKI数据库,主要纳入随机对照试验(randomized controlled trial,RCT)、队列研究、病例对照研究、病例系列、流行病学调查等原始研究,检索时间截止至2020年6月;③英国国家卫生与临床优化研究所(National Institute for Health and Care Excellence,NICE)、苏格兰校际指南网络(Scottish Intercollegiate Guidelines Network,SIGN)等官方网站,以及MEDLINE和CNKI数据库,主要检索AFLP领域的相关指南;④补充检索Google学术等其他网站。按照系统评价、RCT研究、队列研究和病例对照研究的顺序选择证据。
(7)证据的评价与分级:证据小组应用系统评价偏倚风险评价工具(a measurement tool to assess systematic reviews,AMSTAR)对纳入的系统评价、Meta分析和网状Meta分析进行偏倚风险评价。使用Cochrane偏倚风险评价工具(risk of bias tool,ROB;针对RCT研究)、诊断准确性研究质量评价工具(quality assessment of diagnostic accuracy studies,QUADAS2;针对诊断准确性试验研究)、纽卡斯尔渥太华量表(Newcastle Ottawa scale,NOS;针对观察性研究)等对相应类型的原始研究进行方法学质量评价。评价过程由两人独立完成,若存在分歧,则共同讨论或咨询第三方解决。使用GRADE方法对证据和推荐意见进行分级。基于非直接证据或专家意见、经验形成的推荐定义为良好实践声明(good practice statement,GPS)。见表1。
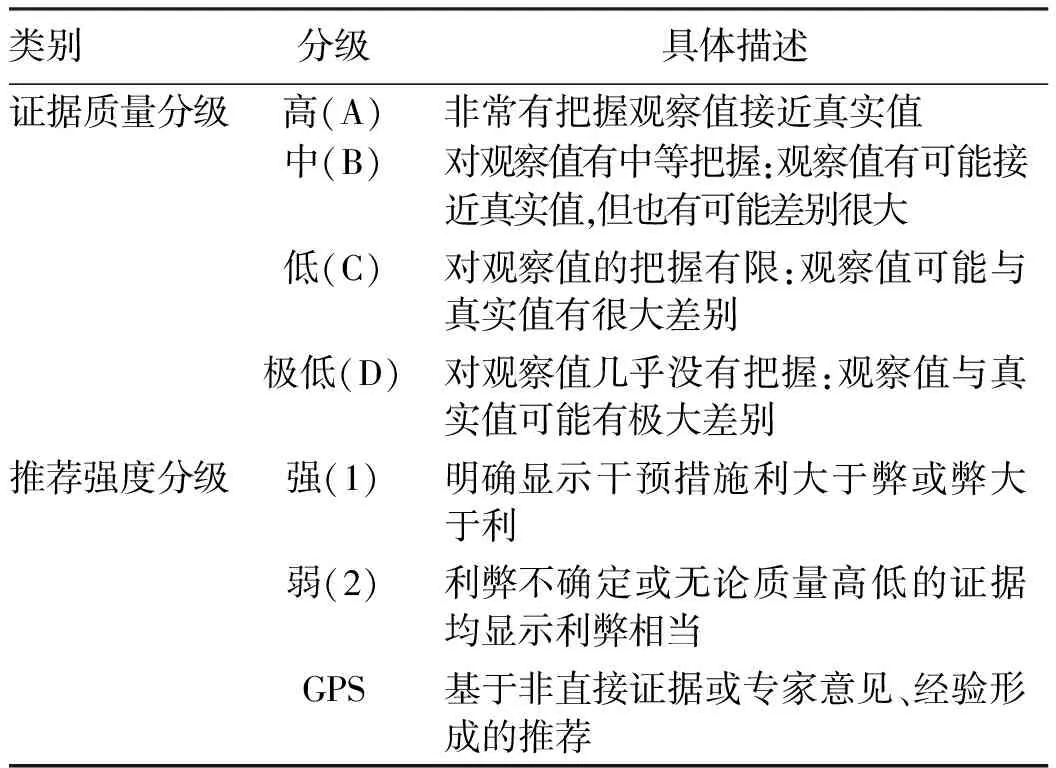
表1 证据质量与推荐强度的GRADE分级表Table 1 GRADE classification table of evidence qualityand recommended strength
(8)推荐意见的形成:专家组基于证据小组提供的国内外证据汇总表,同时考虑了中国妇女的偏好与价值观、干预措施的成本和利弊平衡后,提出24条推荐意见,于2020年5月22日进行了线上讨论和共识,并分别于2021年2月4日和19日进行两轮德尔菲法推荐意见调查,前后共收集到78条反馈建议,定稿时间为2021年3月27日。
(9)指南的更新:本指南计划在3~5年内对推荐意见进行更新。更新方法将按照国际指南更新流程进行。
(10)未来的研究方向:因本指南更多侧重产科管理,未来对本指南的更新过程中,将会从产儿科一体化的角度进行更新,增加对AFLP孕妇新生儿管理的推荐意见。
2 AFLP临床热点问题及管理策略
问题1:如何确定AFLP孕妇门诊筛查的时机及指标?
推荐意见:
1-1 建议将妊娠35~37周作为高危孕妇门诊筛查的时机(GRADE分级:1C)。
1-2 推荐将血常规、肝功能和凝血功能检查作为门诊筛查的一线指标(GRADE分级:1C)。
1-3 对门诊首次筛查可疑的孕妇宜尽快再次进行上述指标的复查,尽早识别AFLP(GRADE分级:GPS)。
证据概述:
来自全球多个团队的研究结果(n均>50)[4,9-11]显示,AFLP的平均发病孕周为35~37周(范围:21~42周)。根据既往10年来自不同国家和地区的回顾性研究报道结果分析[12-14],AFLP孕妇常见的临床症状为恶心呕吐(52.4%~60.0%)、腹部不适(21.4%~70.6%)、黄疸(35.5%),常见的实验室异常指标有血清总胆红素(total bilirubin,TBil)升高(100.0%)、转氨酶升高(95.8%~100.0%)、白细胞计数增多(83.3%~94.0%)、凝血功能异常(83.3%~100.0%)、肾功能异常(53.0%~77.7%)、血糖降低(33.3%~71.0%)。25.0%~80.0%的孕妇肝脏超声检查提示腹水或明亮肝。见表2。
推荐说明:
虽然本指南中推荐妊娠35~37周作为门诊筛查时机,但是由于AFLP的发病时间存在较大的个体差异,部分孕妇的发病时间可能早于本指南的推荐筛查时间,因此,对于妊娠期任何孕周出现明显的乏力、恶心、呕吐等不适症状者应立即进行门诊筛查。
AFLP孕妇的临床特征、实验室及超声检查异常率>85%的临床指标有:白细胞计数升高、肝功能异常、凝血功能异常。因此,建议将血常规、肝功能及凝血功能检查作为门诊一线筛查指标。上消化道表现、肾功能、肝脏超声检查、低血糖等可作为评估病情的指标。
对于门诊首次筛查可疑的孕妇,其复查的间隔时间目前暂无明确的研究和报道,本指南工作组组织了多次专家论证会,形成了“尽快再次进行上述指标的复查”的GPS。
问题2:如何对AFLP进行诊断?
推荐意见:
2-1 推荐临床医师使用Swansea标准进行诊断(GRADE分级:1C)。见表3。
2-2 对不能满足Swansea诊断标准的疑似AFLP孕妇,推荐尽快复查肝功能及凝血功能(GRADE分级:1C)。
2-3 AFLP的诊断以临床诊断为主,肝组织活检不作为必须的诊断依据(GRADE分级:2D)。
证据概述:
Swansea诊断标准于2002年正式推出,该标准包括4个方面,14个条目,符合6个及以上的条目诊断为AFLP[15]。英国的一篇队列研究(n=1 132 964)[4]显示,在确诊的AFLP孕妇中,临床评估与使用Swansea诊断标准的符合率为97%,κ=0.78,基本一致。2019年,我国的诊断准确性研究[16](n=404)
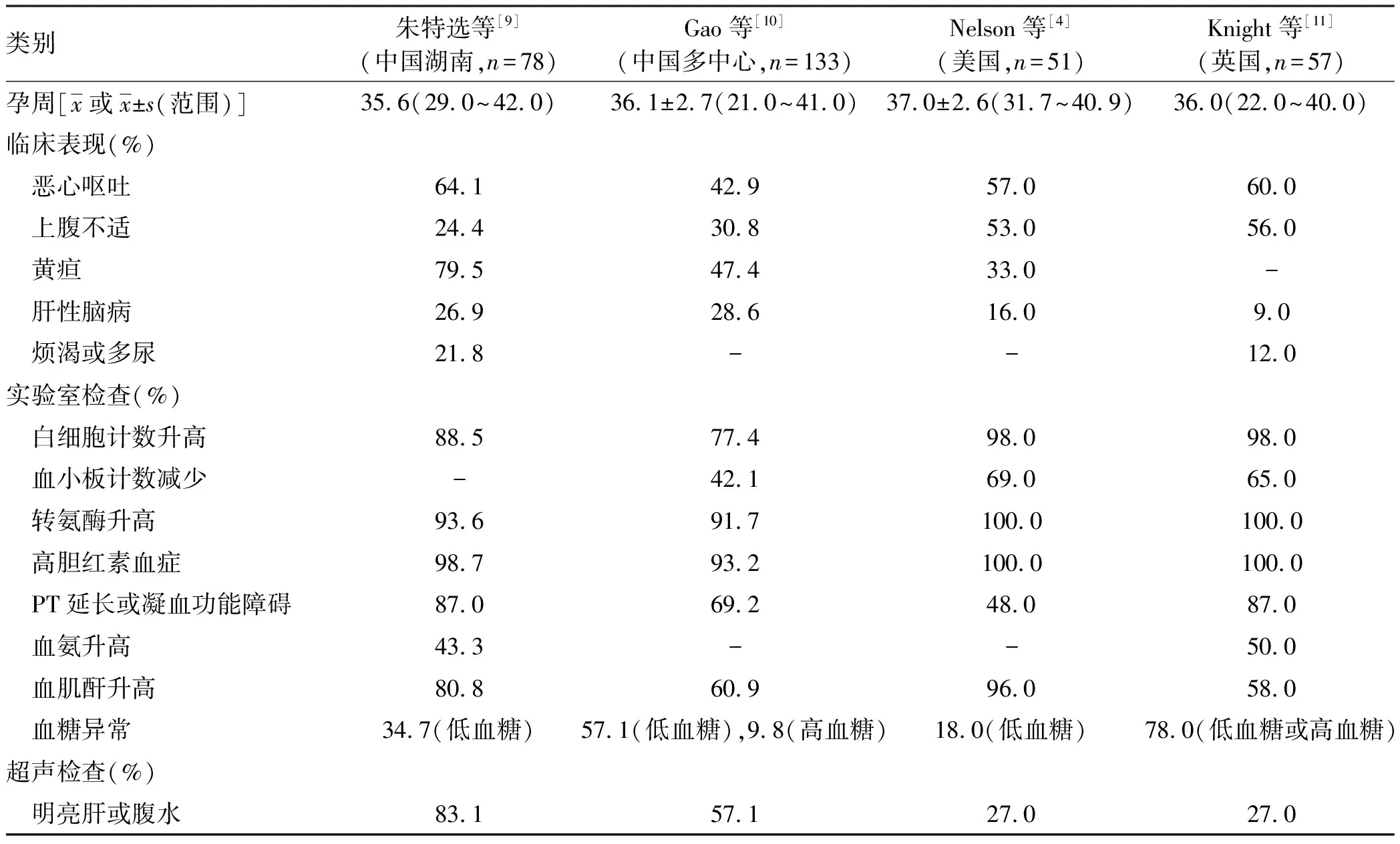
表2 文献中AFLP孕妇的临床特征、实验室及超声检查的异常率Table 2 Clinical characteristics, laboratory and ultrasound abnormalities of AFLP pregnant women in the literature

表3 AFLP的Swansea诊断标准[13]Table 3 Swansea diagnostic criteria for AFLP[13]
显示,Swansea诊断标准与国内诊断标准在74例AFLP孕妇中的一致率为91.89%;在330例非AFLP孕妇中的一致率为96.06%;两个标准的κ=0.848,受试者工作特征(ROC)曲线下面积为0.940(95%CI:0.902~0.978)。
2015年,美国胃肠病学会关于妊娠期肝脏疾病的指南[17]中指出,Swansea标准更适用于晚期AFLP的诊断。我国的一篇回顾性研究(n=18)[18]指出,早期疑似AFLP孕妇无临床特异性,诊断时应仔细评估肝功能和凝血功能。2016年一篇回顾性研究(n=56)[19]显示,AFLP孕妇中凝血功能障碍者占54%;多因素logistic回归分析示凝血酶原时间(prothrombin time,PT)延长是AFLP的危险因素之一(OR=1.558,95%CI:1.248~1.946)。2020年一篇回顾性研究(n=133)[20]显示,直接胆红素(OR=1.012,95%CI:1.002~1.022)和血清肌酐(OR=1.022,95%CI:1.007~1.036)升高是AFLP产妇死亡的独立危险因素。
一篇回顾性研究(n=24)[12]显示,无肝组织活检的Swansea标准诊断肝微泡性脂肪变性的敏感度为100%(95%CI:77%~100%),特异度为57%(95%CI:20%~88%),阳性预测值为85%,阴性预测值为100%。2017年我国的一篇回顾性研究(n=52)[21]显示,无肝组织活检的Swansea标准是诊断AFLP的良好筛选工具,其诊断准确率为94%。
推荐说明:
Swansea诊断标准与国内诊断标准诊断AFLP的一致性较好,但Swansea诊断标准的条目化清晰,被世界各国接受,因此,此标准可在临床中推广应用。但临床使用该诊断标准中,要注意Swansea诊断标准中生化指标给出的数值均为异常界值判断的标准,国内使用时需根据检测单位确定的异常界值而定。
因为疑似AFLP孕妇早期无临床特异性,所以对于疑似AFLP孕妇,推荐间隔24 h复查凝血功能和肝功能。
肝组织活检是诊断AFLP的“金标准”,但由于穿刺的有创性,在临床实践中很少使用。且现有研究表明,无肝组织活检的Swansea标准诊断AFLP的敏感度可达100%。因此,临床管理中不推荐肝组织活检作为AFLP诊断的必要条件。
问题3:如何评估AFLP孕妇的术前风险?
推荐意见:
3-1 建议将血清TBil、凝血酶原活动度(PTA)或国际标准化比值(international normalized ratio,INR)、纤维蛋白原、血小板计数、血清乳酸、血清肌酐水平及病程长短作为术前风险评估的指标(GRADE分级:2C)。
3-2 建议将产前PTA<40%(或INR>1.5)、血清TBil>171 μmol/L、血小板计数≤50×109/L、血清肌酐≥133 μmol/L、血清乳酸≥5 mmol/L和病程超过1周,作为评估术前是否纳入极高危风险管理人群的指标(GRADE分级:2C)。
证据概述:
2015年一篇回顾性病例对照研究(n=23)[22]显示,血清TBil>171 μmol/L的AFLP孕妇肾功能不全、肺部感染及低蛋白血症的发生率高于胆红素≤171 μmol/L的AFLP孕妇,差异有统计学意义。2016年一篇回顾性病例对照研究(n=93)[23]显示,TBil(OR=2.515,95%CI:1.127~6.608)、INR(OR=2.359,95%CI:1.117~4.982)、血清肌酐(OR=1.618,95%CI:1.021~2.567)增加及血小板计数减少(OR=1.367,95%CI:1.066~1.754)是AFLP孕妇死亡的独立危险因素。2016年另一篇回顾性病例对照研究(n=36)[24]显示,PTA<40%的AFLP孕妇发生低蛋白血症、凝血功能障碍、急性肾功能衰竭、DIC、多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)等并发症高于40%
2019年一项跨国队列研究(n=816)[29]显示,肝衰竭患者入院时乳酸水平与器官衰竭数量和28 d死亡率直接相关(ROC曲线下面积为0.72;P<0.001);入院时乳酸≥5 mmol/L和12 h乳酸清除率分别被确定为1年死亡率的重要预测因子。
1994年智利的一篇回顾性队列研究(n=11)[30]显示,如果AFLP孕妇从出现症状到终止妊娠间隔时间少于1周,则其存活率可达100%;而发病2周以上死亡率达30%。2013年国外的一篇回顾性病例系列报告(n=51)[4]显示,延迟终止妊娠会导致AFLP孕妇病情急剧恶化。2017年国内的一篇病例对照研究[31]显示,就诊到终止妊娠超过24 h(OR=42.986,95%CI:4.954~372.983)、发病到终止妊娠时间超过14 d(OR=42.382,95%CI:6.033~297.734)是AFLP孕妇预后不良的危险因素。
推荐说明:
AFLP作为一种产科危急重症,对全身多个系统存在严重的损害,多指标的联合观察是有效评估AFLP孕妇预后的重要手段。TBil升高、凝血功能严重异常、血清肌酐升高、血小板计数降低及发病时长与AFLP孕妇的预后密切相关。血乳酸的升高是严重肝衰竭孕妇死亡率的重要预测因子。推荐血清TBil、PTA或INR、纤维蛋白原、血小板计数、血清乳酸、血清肌酐水平及病程长短作为术前风险评估的指标,并对指标严重异常的孕妇作为极高危患者进行管理。
问题4:如何确定AFLP孕妇终止妊娠的方式和时机?
推荐意见:
4-1 对短期内不能阴道分娩者或子宫颈条件不佳者推荐优先选择剖宫产术终止妊娠(GRADE分级:1B)。
4-2 如果阴道分娩不可避免,建议在积极改善凝血功能、预防产后出血的条件下尽快结束阴道分娩过程(GRADE分级:2D)。
4-3 推荐AFLP孕妇尽早终止妊娠(GRADE分级:1C)。
证据概述:
2016年的一篇系统评价(n=80)[6]显示,相较于阴道分娩,AFLP孕妇选择剖宫产术的方式终止妊娠,可以降低产妇的死亡率(RR=0.56,95%CI:0.41~0.76),降低围产儿的死亡风险(RR=0.52,95%CI:0.38~0.71)改善妊娠结局。
2014年的一篇病例报告(n=7)[32]显示,子宫颈条件成熟、胎儿不大、已临产、估计短期内能阴道分娩的AFLP孕妇,可选择阴道分娩。考虑到AFLP孕妇大多存在严重凝血功能障碍,因此,阴道分娩只适用于短时间内阴道分娩不可避免的情况。2019年的一篇综述[33]指出,AFLP孕妇阴道分娩时,需持续胎心监护以动态评估胎儿在子宫内的情况;同时,分娩前应积极补充新鲜冰冻血浆、冷沉淀、纤维蛋白原等以纠正异常的凝血功能,在动态监测凝血功能的情况下,限制性行会阴切开术,胎儿娩出后立即采取预防产后出血的各项措施。若产妇出现产后出血,其处理原则同凝血功能异常孕妇的处理,在积极输注凝血物质纠正凝血功能的情况下,阶梯式进行止血治疗[34]:首先积极给予强效全子宫收缩剂和下压子宫底部等处理加强宫缩止血;若仍有持续性阴道流血,则快速行子宫腔填塞,必要时行子宫动脉栓塞术;若经上述处理依然无效,则行开腹止血。多学科配合对症处理、营养支持、预防感染等综合治疗是孕妇尽早度过危险期、尽快恢复肝、肾等重要器官功能的有效措施。
2017年的一篇病例对照研究(n=62)[31]显示,AFLP孕妇就诊到终止妊娠的时间应选择在接诊后的24 h内,且越快越好,AFLP从发病到终止妊娠时间在14 d内的孕妇预后较好。一篇非随机对照研究(n=58)[35]显示,尽早诊断并在确诊为AFLP的48 h内终止妊娠,有助于降低产妇感染率以及新生儿轻度窒息率。
推荐说明:
AFLP作为一种妊娠特有的疾病,尽快终止妊娠是改善母儿结局的唯一手段。因此,一旦确诊AFLP,应采取最快的分娩方式终止妊娠。剖宫产术分娩可获得更好的母儿结局,是AFLP孕妇的主要分娩方式。但是对于子宫颈条件成熟、胎儿不大、已临产、估计短期内能阴道分娩的AFLP孕妇,也可在积极纠正凝血的情况下选择阴道分娩。
问题5:如何选择AFLP孕妇的手术麻醉方式?
推荐意见:
5-1 推荐将肝功能、凝血功能、分娩紧急性及全身情况作为麻醉选择的主要考虑因素(GRADE分级:GPS)。
5-2 推荐术前建立快速反应多学科团队(MDT),包括产科、感染科、麻醉科、ICU、新生儿科、输血科,共同评估和制订AFLP孕妇的手术麻醉方案(GRADE分级:GPS)。
5-3 建议凝血功能的评估作为麻醉方式选择的主要依据:INR≤1.2的孕妇可行椎管内麻醉,1.2 证据概述: 一篇回顾性研究(n=57)[11]显示,42例剖宫产术分娩的AFLP孕妇中,23例行全身麻醉;19例行椎管内麻醉,其中包括5例凝血功能障碍的孕妇,观察显示,椎管内麻醉的孕妇均未发生麻醉并发症。2016年一篇回顾性研究(n=33)[36]显示,在行全身麻醉的孕妇术前均存在凝血功能障碍、行蛛网膜下腔阻滞麻醉的孕妇术前凝血功能基本正常的情况下,除了行全身麻醉的孕妇DIC发生率显著高于行蛛网膜下腔阻滞麻醉者外,其他围产期并发症的发生率无显著差异。因此,INR≤1.2的孕妇可选择椎管内麻醉。 2003年,美国区域麻醉学会神经阻滞和抗凝药物专题会议[37]中提出,当凝血因子的活性维持在正常值的40%以上时即可维持正常的凝血功能,当Ⅶa因子的活性为正常值的40%时,其INR<1.5,机体可以维持正常或接近正常的凝血功能,在麻醉方式的选择上可考虑单次蛛网膜下腔阻滞麻醉。因此,1.2 2017年一篇回顾性研究[38]显示,纳入的42例孕妇中,19例行剖宫产术,其中采取全身麻醉的13例孕妇中合并肝衰竭者7例,手术时PTA均小于40%,INR的均值波动于1.61±0.38;采取硬膜外阻滞者6例,其INR的均值波动于1.07±0.15;两组孕妇均无麻醉并发症出现。因此,INR≥1.5或循环功能不稳定的孕妇可考虑全身麻醉。 推荐说明: 目前,AFLP孕妇麻醉方式的选择尚无RCT研究的文献报道。因此,本指南工作组组织了多次专家论证会,结合目前临床经验,形成了“将肝功能、凝血功能、分娩紧急性及全身情况作为麻醉选择的主要考虑因素”的GPS。 随着诊疗模式的改变,快速反应MDT是临床危重患者救治的不可或缺的一环。AFLP作为一种严重致命性的产科急症,其往往累及全身多个系统器官,因此,尽快建立快速反应 MDT可以更好地对AFLP孕妇进行全程管理,改善母儿结局。 由于AFLP往往会累及多个器官,导致严重的内环境紊乱,从而危及母儿安全。因此,麻醉方式的选择往往不能仅参考凝血指标,而需要充分考虑母儿本身情况及处置的紧急性。结合对各种麻醉方式起效所需的时间、操作熟练程度等情况进行权衡。因此,推荐将AFLP孕妇的凝血功能、终止妊娠的紧急性及循环状态作为麻醉方式选择的主要依据。 问题6:AFLP孕妇围产期的并发症有哪些? 推荐意见: 6-1 建议应警惕AFLP孕妇围产期并发症的发生,常见并发症包括急性肾功能不全、DIC及MODS(GRADE分级:2D)。 6-2 建议将产前PTA<40%或INR≥1.5,TBil>171 μmol/L的孕妇作为上述并发症发生的极高危人群进行管理(GRADE分级:2D)。 证据概述: 2016年,我国的一篇回顾性病例分析(n=56)[19]显示,AFLP孕妇的并发症发生率依次为急性肾功能损伤(39%),DIC(32%),高血压(20%)。2019年我国另一篇回顾性病例系列研究(n=44)[25]显示,AFLP最常见的并发症依次为急性肾功能不全(79.5%)、DIC(47.7%)及MODS(38.6%),少数孕妇也可出现高血压(27.3%)、胰腺炎(13.6%)等。2020年我国的病例对照研究(n=55)[28]显示,AFLP孕妇的并发症包括凝血功能障碍(83.6%)急性肝衰竭(47.3%),急性肾功能不全(85.5%)。美国的一篇综述[39]中指出,约14%的AFLP孕妇可出现急性肺水肿,此外,AFLP的并发症还包括DIC、代谢性酸中毒、胰腺炎等,这些并发症的出现都与母儿预后密切相关[4]。 2015年一篇回顾性病例对照研究(n=23)[22]显示,与血清TBil≤171 μmol/L的AFLP孕妇比较,血清TBil>171 μmol/L的AFLP孕妇肾脏功能不全、肺部感染及低蛋白血症的发生率更高。2016年一篇回顾性病例对照研究(n=36)显示,PTA<40%的AFLP孕妇发生低蛋白血症、凝血功能障碍、急性肾功能衰竭、DIC、MODS等并发症的概率高于40% 推荐说明: AFLP作为一种多器官受累的疾病,往往容易并发一系列严重的并发症,对最常见、最严重的并发症进行管理和预防是有效提高AFLP孕妇预后的重要环节。AFLP最常见的严重并发症有急性肾功能不全、DIC及MODS。同时,PTA、INR或TBil的严重异常可能增加AFLP并发症的发生率。因此,建议动态监测PTA、INR或TBil的变化,需警惕严重异常者其容易并发急性肾功能不全、DIC及MODS等严重并发症。 问题7:如何选择AFLP孕妇人工肝治疗的适应人群? 推荐意见: 7-1 推荐快速反应MDT共同评估孕妇的病情程度及人工肝治疗时机(GRADE分级:GPS)。 7-2 轻症AFLP孕妇,不推荐人工肝治疗,但推荐产后动态评估病情变化(GRADE分级:2D)。 7-3 重症AFLP孕妇,推荐人工肝治疗(GRADE分级:1C)。 证据概述: 2002年国内一项病例系列研究(n=6)[40]和2008年美国一项回顾性非同期病例对照研究(n=6)[41]发现,AFLP孕妇的病情是动态演变的,对轻症AFLP孕妇应动态监测,以免轻型转为重症,同时指出,剖宫产术等终止妊娠操作后往往是AFLP孕妇临床症状和各项生化指标迅速恶化的高发期。2018年国内另一篇回顾性自身对照研究(n=68)[42]提示,确诊AFLP后立即以剖宫产术终止妊娠,在抗感染、补液、纠正多器官功能障碍的基础上应用血液净化治疗[43],70例新生儿的存活率达85.71%,死亡率仅为14.29%。 2018年我国的一篇回顾性非同期病例对照研究(n=41)[44]显示,重症AFLP孕妇中,内科综合治疗联合血浆置换可提高孕妇的血清白蛋白、凝血功能及血糖水平,同时也可以降低白细胞计数。其中联合治疗组孕妇的死亡率为14.29%,而单用内科综合治疗组死亡率为60.00%;血浆置换对孕妇生存影响的OR值为5.047。其他学者的研究进一步证实,包括血浆置换、血液灌流在内的人工肝治疗手段对重症AFLP孕妇的疗效确切[45-48]。但是,由于AFLP发病率较低,受样本量和孕妇个体差异性诊疗方案的限制,目前尚缺乏高质量的RCT研究。 重症AFLP孕妇人工肝治疗的应用指征:(1)中枢神经系统障碍加重,如出现感知异常或者昏迷;(2)持续的凝血功能障碍,需要持续输注大量的血浆、红细胞或者冷沉淀;(3)严重的肾功能障碍导致水电解质紊乱;(4)心肺功能进行性下降;(5)持续的体液紊乱,包括大量腹水、水肿、少尿或无尿和(或)体液超负荷。达到以上一项情况时,即应立即开始人工肝治疗[48-49]。 推荐说明: AFLP是一种妊娠期特有的肝衰竭,因此其治疗过程不仅需要产科医师的关注,同时也需要感染科、消化内科、重症医学科等科室共同参与,临床上对其救治往往需要多个学科参与,共同制定诊疗方案。因此,一旦诊断为AFLP,需尽快建立快速反应MDT共同评估病情严重程度,并把握人工肝治疗的指征。 AFLP孕妇的病情是动态变化的,对于轻症AFLP孕妇应动态监测,以免轻型转为重症。分娩后应特别关注产妇的各项指标,发现病情加重趋势应尽早启用人工肝治疗。 对于重症AFLP,其多合并严重的肝衰竭,肝脏的替代治疗是缓解肝衰竭疾病进展的常用且必要的手段之一。人工肝治疗对重症AFLP孕妇具有明确的治疗效果。因此,对于重症AFLP孕妇,及时合理地使用包括血浆置换、血液灌流在内的人工肝治疗手段,是有效改善临床结局的重要措施。 问题8:如何评估AFLP孕妇的预后? 推荐意见: 8-1 建议将术后PTA、血清TBil、血小板计数、血清肌酐作为AFLP孕妇预后的评估指标(GRADE分级:2D)。 8-2 推荐将术后上述指标持续异常或终止妊娠1周后仍无恢复趋势的AFLP孕妇纳入预后不良的重点人群进行MDT共同评估,条件适合者可进行肝移植治疗(GRADE分级:1D)。 证据概述: 2016年国内的一项针对 AFLP孕妇预后的回顾性研究(n=93)[23]显示,TBil、INR、血清肌酐增加、血小板计数减少及出现严重肝性脑病是AFLP孕妇死亡的高危因素。2017年一项国内的回顾性研究(n=36)[24]显示,重度PTA降低(PTA<40%)孕妇发生低蛋白血症、凝血障碍、急性肾衰竭、DIC、MODS等并发症的比例高于PTA轻度降低者(40% 一项队列研究(n=51)[4]显示,AFLP孕妇终止妊娠后,临床症状一般在3~4 d内恢复,肝肾功能异常大多在7 d左右恢复正常。2016年一项临床研究(n=43)[26]显示,所有AFLP孕妇产前血清转氨酶和TBil均存在不同程度的升高,白蛋白降低者占88%,血浆纤维蛋白原水平<1.75 g/L者占93%,PT延长者占91%;终止妊娠后5~20 d各血清学指标恢复正常,其中仅TBil(r=0.639,P=0.001)、PT(r=0.459,P=0.002)、纤维蛋白原(r=0.427,P=0.004)和血小板计数(r=0.435,P=0.004)是产后恢复的预测指标。 推荐说明: 虽然AFLP是一种产后自限性疾病,大部分AFLP孕妇的临床症状及血常规、肝肾功能和凝血功能等实验室指标产后可逐渐恢复正常。但是,部分AFLP孕妇终止妊娠后病情进一步加重,导致不良临床结局的出现。因此,对AFLP孕妇疾病进展及转归的提前预测是实现AFLP孕妇个体化针对性管理的必备环节。TBil、PTA或INR、血清肌酐及血小板计数异常是与AFLP预后密切相关的高危因素。建议将术后肝肾功能、凝血功能恢复时间延迟、恶化或持久不恢复的AFLP孕妇作为预后不良者加强管理。 此外,对于预后不良的孕妇应积极转诊至更高级别的医院进行处理和救治,并尽快建立MDT,并由MDT制订周密的治疗计划,必要时可考虑肝移植治疗。 问题9:如何对AFLP孕妇治疗期间进行监测? 推荐意见: 9-1 建议治疗期间常规监测血常规、肝功能、肾功能、凝血功能(GRADE分级:2D)。 9-2 轻症者建议分娩后3~4 d复查上述指标(GRADE分级:2D);产后病情仍在进展或出现严重并发症的产妇建议按重症进行监测(GRADE分级:2D)。 9-3 重症者建议至多间隔12~24 h监测上述指标,若出现病情变化则随时调整监测频次(GRADE分级:2D)。 证据概述: 一篇回顾性病例分析(n=51)[4]显示,AFLP孕妇产前实验室检查结果异常主要包括:转氨酶升高(100%)、血清肌酐升高(96%)、血小板计数降低(69%)、白细胞计数升高(98%)、TBil升高(100%)、胆固醇降低(100%)、INR升高(60%)、PT延长(48%)、纤维蛋白原降低(49%)、血糖降低(18%)。2016年一篇回顾性病例分析(n=43)[26]显示,AFLP孕妇产前短期内实验室检查结果异常包括:丙氨酸转氨酶升高(88%)、天门冬氨酸转氨酶升高(98%)、TBil升高(100%)、白蛋白降低(88%)、血糖降低(56%)、纤维蛋白原降低(93%)、血小板计数降低(26%)、PT延长(91%)、白细胞计数升高(79%)、血清肌酐升高(72%)、尿酸升高(93%)。2018年一篇多中心回顾性病例研究(n=133)[10]显示,AFLP孕妇产前实验室检查结果异常主要包括:TBil升高(93.2%)、天门冬氨酸转氨酶升高(91.7%)、总蛋白降低(89.5%)、白蛋白降低(80.5%)、丙氨酸转氨酶升高(78.9%)、活化部分凝血酶原时间延长(78.2%)、白细胞计数升高(77.4%)、PT延长(69.2%)、血糖降低(57.1%)、血清肌酐升高(60.9%)、血尿素氮升高(48.9%)、血小板计数降低(42.1%)。此外,AFLP孕妇可能并发肝性脑病(28.6%)和胰腺炎(6.8%)。 一篇回顾性病例分析(n=51)[4]显示,大多数AFLP孕妇于分娩后3~4 d内临床症状康复,但实验室检查结果转为正常往往滞后。天门冬氨酸转氨酶水平通常在分娩时或分娩前后达到峰值,分娩后2 d或3 d迅速下降至100 U/L;血胆固醇水平通常于分娩后3~4 d内持续下降到最低点,然后上升,与此同时,血清TBil水平不变或升高。血清肌酐值分娩后迅速下降,7~10 d后降至88 μmol/L,部分孕妇的血清肌酐值较正常孕妇仍有升高。血小板计数于分娩后1~2 d达到最低点,分娩后4~6 d恢复正常,INR于分娩后1周左右下降至正常。2019年一篇回顾性病例对照研究(n=54)[50]显示,终止妊娠后肝功能及凝血指标多在分娩后1周内恢复正常;天门冬氨酸转氨酶于分娩后1~2 d迅速下降并持续降低;两组孕妇的胆固醇均于分娩后3~4 d下降至最低后开始回升;TBil分娩后基本保持不变;入院时血小板计数≥150×109/L的孕妇于分娩后2 d恢复至约 100×109/L,而入院时血小板计数<150×109/L的孕妇于分娩后6 d才缓慢上升至约100×109/L;入院时纤维蛋白原>1.5 g/L的孕妇于分娩后的2 d内轻度下降后逐渐恢复并稳定,而纤维蛋白原<1.5 g/L的孕妇于分娩后2 d即开始缓慢上升;PT和活化部分凝血活酶时间于分娩后5 d基本恢复至正常参考值范围;及时终止妊娠后约1周,AFLP孕妇的各项指标基本恢复正常。 推荐说明: 血常规、肝肾功能及凝血功能是AFLP孕妇产前、产后病情变化的重要预测指标,因此,动态监测上述指标的变化是评估AFLP孕妇预后及疗效管理的主要依据。根据AFLP孕妇病情的轻重,可将其分为轻症者和重症者。多数轻症AFLP孕妇于分娩后3~4 d内可获得临床康复,大部分实验室指标于分娩后7~10 d内恢复正常。因此,对于轻症者建议分娩后3~4 d复查上述监测指标,并动态监测指标的变化;对于病情进行性发展或合并严重并发症者应作为重症患者进行治疗。但是,目前无明确的证据提示对重症患者应该采取何种监测频率。因此,对重症患者的监测目前只能根据孕妇情况进行个体化调整。由于AFLP孕妇的病情往往变化迅速,对重症患者务必在12~24 h内复查上述指标。 (1)建议将妊娠35~37周作为高危孕妇门诊筛查的时机(GRADE分级:1C)。推荐将血常规、肝功能和凝血功能检查作为门诊筛查的一线指标(GRADE分级:1C)。对门诊首次筛查可疑的孕妇宜尽快再次进行上述指标的复查,尽早识别AFLP(GRADE分级:GPS)。 (2)推荐临床医师使用Swansea标准进行诊断(GRADE分级:1C)。对不能满足Swansea诊断标准的疑似AFLP孕妇,推荐尽快复查肝功能及凝血功能(GRADE分级:1C)。AFLP的诊断以临床诊断为主,肝组织活检不作为必须的诊断依据(GRADE分级:2D)。 (3) 建议将血清TBil、PTA或INR、纤维蛋白原、血小板计数、血清乳酸、血清肌酐水平及病程长短作为术前风险评估的指标(GRADE分级:2C)。建议将产前PTA<40%(或INR>1.5)、血清TBil>171 μmol/L、血小板计数≤50×109/L、血清肌酐≥133 μmol/L、血清乳酸≥5 mmol/L和病程超过1周,作为评估术前是否纳入极高危风险管理人群的指标(GRADE分级:2C)。 (4)对短期内不能阴道分娩者或子宫颈条件不佳者推荐优先选择剖宫产术终止妊娠(GRADE分级:1B)。如果阴道分娩不可避免,建议在积极改善凝血功能、预防产后出血的条件下尽快结束阴道分娩过程(GRADE分级:2D)。推荐AFLP孕妇尽早终止妊娠(GRADE分级:1C)。 (5)推荐将肝功能、凝血功能、分娩紧急性及全身情况作为麻醉选择的主要考虑因素(GRADE分级:GPS)。推荐术前建立快速反应多学科团队(MDT),包括产科、感染科、麻醉科、ICU、新生儿科、输血科,共同评估和制订AFLP孕妇的手术麻醉方案(GRADE分级:GPS)。建议凝血功能的评估作为麻醉方式选择的主要依据:INR≤1.2的孕妇可行椎管内麻醉,1.2 (6) 建议应警惕AFLP孕妇围产期并发症的发生,常见并发症包括急性肾功能不全、DIC及MODS(GRADE分级:2D)。建议将产前PTA<40%或INR≥1.5,TBil>171 μmol/L的孕妇作为上述并发症发生的极高危人群进行管理(GRADE分级:2D)。 (7) 推荐快速反应MDT共同评估孕妇的病情程度及人工肝治疗时机(GRADE分级:GPS)。轻症AFLP孕妇,不推荐人工肝治疗,但推荐产后动态评估病情变化(GRADE分级:2D)。重症AFLP孕妇,推荐人工肝治疗(GRADE分级:1C)。 (8)建议将术后PTA、血清TBil、血小板计数、血清肌酐作为孕妇预后的评估指标(GRADE分级:2D)。推荐将术后上述指标持续异常或终止妊娠1周后仍无恢复趋势的孕妇纳入预后不良的重点人群进行 MDT共同评估,条件适合者可进行肝移植治疗(GRADE分级:1D) (9)建议治疗期间常规监测血常规、肝功能、肾功能、凝血功能(GRADE分级:2D)。轻症者建议分娩后3~4 d复查上述指标(GRADE分级:2D);产后病情仍在进展或出现严重并发症的产妇建议按重症进行监测(GRADE分级:2D)。重症者建议至多间隔12~24 h监测上述指标,若出现病情变化则随时调整监测频次(GRADE分级:2D)。 AFLP孕妇的临床管理流程见图1。 首席专家:张卫社(中南大学湘雅医院),杨慧霞(北京大学第一医院) 首席方法学家:陈耀龙(兰州大学基础医学院循证医学中心) 执笔专家:李平(中南大学湘雅医院),周奇(兰州大学基础医学院循证医学中心),张卫社(中南大学湘雅医院),杨慧霞(北京大学第一医院),陈耀龙(兰州大学基础医学院循证医学中心) 参与本指南讨论的专家:陈敦金(广州医科大学第三附属医院),刘兴会(四川大学华西第二医院),漆洪波(重庆医科大学第一附属医院),王谢桐(山东省妇幼保健院),赵扬玉(北京大学第三医院),王子莲(中山大学附属第一医院),林建华(上海交通大学医学院附属仁济医院),李笑天(复旦大学附属妇产科医院),邹丽(华中科技大学同济医学院附属协和医院),冯玲(华中科技大学同济医学院附属同济医院),陈叙(天津市中心妇产科医院),范建霞(上海交通大学医学院附属国际和平妇幼保健院),赵先兰(郑州大学第一附属医院),王志坚(南方医科大学南方医院),孙丽洲(南京医科大学第一附属医院),马润玫(昆明医科大学第一附属医院),李雪兰(西安交通大学第一附属医院),刘彩霞(中国医科大学附属盛京医院),朱启英(新疆医科大学第一附属医院),孙国强(华中科技大学同济医学院附属湖北省妇幼保健院),彭仕芳(中南大学湘雅医院),黄耿文(中南大学湘雅医院),王锷(中南大学湘雅医院),刘小伟(中南大学湘雅医院),傅蕾(中南大学湘雅医院),全俊(中南大学湘雅医院),赵双平(中南大学湘雅医院),赵延华(中南大学湘雅医院),樊杨(宁夏回族自治区人民医院),辛虹(河北医科大学第二医院),颜建英(福建省妇幼保健院),蒲杰(四川大学华西第二医院),曹引丽(西北妇女儿童医院),张国华(石家庄市妇产科医院),董旭东(云南省第一人民医院) 注:AFLP表示妊娠期急性脂肪肝;MDT表示多学科团队;INR表示国际标准化值;PTA表示凝血酶原活动度;TBil表示总胆红素;AKI表示急性 肾功能损伤;DIC表示弥漫性血管内凝血;MODS表示多器官功能障碍综合征。 利益冲突:所有作者声明无利益冲突。 志谢:本指南制订过程中,中南大学湘雅医院彭巧珍、陈刚、雍文静、谢明坤、曾婵娟、黄奕、朱家豪、孙靖驰及兰州大学基础医学院循证医学中心张静怡、王子君和史乾灵帮助进行文献收集及资料整理;中南大学湘雅医院学科建设基金对本指南的制订提供资助。3 AFLP临床管理推荐建议总结


