重组真核表达载体pcDNA3.1(+)-ChIFN-α的构建及其与ND、IB二联活疫苗联用对鸡免疫功能的影响
■陈亚伟 杨文艳 韩向新 宋艳红 吕小虎 陈书明*
(1.山西农业大学动物医学学院,山西 太谷 030801;2.山西省动物疫病预防控制中心,山西 太原 030027;3.山西省检验检测中心(山西省标准计量技术研究院),山西 太原 030027)
新城疫(Newcastle disease,ND)和传染性支气管炎(Infectious bronchitis,IB)是最重要的禽类病毒性疾病之一,具有重大的全球经济影响[1-2]。尽管采用了广泛的疫苗接种方法,由于抗原变异、母源抗体干扰、野毒株感染等往往会导致免疫失败[3-5],需要通过佐剂刺激免疫系统对疫苗产生更强烈的反应来增强疫苗效果,并且传统疫苗佐剂往往会导致动物痛苦和不适,从而损害动物福利,故需要开发新的疫苗佐剂来解决这一问题。本研究通过构建重组真核表达载体pcDNA3.1(+)-ChIFN-α,用不同剂量pcDNA3.1(+)-ChIFN-α与鸡ND、IB 二联活疫苗(HB1 株+H120株)肌注免疫3 日龄海兰褐雏鸡(SPF),通过动物试验,研究其与鸡ND、IB二联活疫苗联用最佳肌肉注射剂量及其对鸡免疫功能的影响,为将pcDNA3.1(+)-ChIFN-α开发为鸡疫苗免疫佐剂奠定基础。1994 年Sekellick等[6]首次克隆出鸡IFN-α基因,开启禽用干扰素研究的序幕;韩春来等[7]研究IFN-α重组蛋白中含有53.2%α螺旋、3.1%β折叠、10.6%转角和33.1%无规则卷曲,首次证实ChIFN-α仅属于全α型蛋白;程福亮等[8]研究结果表明重组ChIFN-α蛋白在鸡胚内能够较好抑制或杀灭H9 亚型禽流感病毒、ND 病毒(ND virus,NDV)和IB 病毒(IB virus,IBV);杨惠等[9]研究结果表明IFN-α-IL-18 融合蛋白能显著抑制传染性法氏囊病毒在鸡胚中的复制;郑华斌等[10]研究结果表明猪IFN-α作为佐剂可有效辅助口蹄疫DNA 疫苗改善动物体免疫应答;Kim 等[11]研制同时表达猪IFN-α和IFN-γ的重组腺病毒能增强猪细胞和小鼠抗病毒效果;Dai 等[12]研究表明重组ChIFN-α能够阻断水泡性口炎病毒在鸡成纤维细胞中的感染;Zhou 等[13]用IFN-α和IFN-γ预处理鸭瘟病毒增强型绿色荧光蛋白感染鸭胚成纤维细胞后,病毒基因拷贝数和病毒效价显著降低(P<0.01);Gao等[14]研究表明重组鸭IFN-α具有抗H5N1禽流感病毒的作用;Gan等[15]研究结果表明与单次注射疫苗相比,LPAIH9N2 灭活疫苗联合注射重组鸡IFN-α能显著增强疫苗保护作用。人们对于ChIFN-α的抗病毒作用研究的比较多,对于其作为免疫佐剂与ND、IB 二联活疫苗联用的效果报道甚少,故本试验旨在探讨pcDNA3.1(+)-ChIFN-α是否能增强ND、IB 二联活疫苗免疫效果,发挥免疫佐剂作用。通过本试验,旨在解决pcDNA3.1(+)-ChIFN-α表达载体作为新型疫苗佐剂及其在生产中应用提供数据支撑。
1 材料和方法
1.1 试验材料
1.1.1 材料SPF 公雏鸡购自山西省太谷种鸡场;pcDNA3.1(+)由山西农业大学动物医学学院发酵实验室保存[保藏号CICC81002],pMD19-T Vector 购自TaKaRa 公司;Trans5αChemically Competent Cell 购自北京全式金生物技术有限公司;鸡新城疫、传染性支气管炎二联活疫苗(HB1 株+H120 株)购自青岛宝依特生物制药有限公司;鸡肾型传染性支气管炎病毒(gray株)由中国兽医药品监察所提供;鸡新城疫抗原(4HA50)由山西隆克尔生物制药有限公司提供。
1.1.2 试剂
TaKaRa Taq 试剂盒、RNAiso Plus 试剂盒、Prime-Script RT Master Mix Perfect Real Time试剂盒、限制性内切酶EcoRⅠ和HindⅢ、TaKaRa MiniBEST Plasmid Purification Kit Ver 3.0 均购自TaKaRa 公司;TIANgel Midi Purification Kit 购自天根生化科技(北京)有限公司;鸡肾型传染性支气管炎(NIBV)抗体酶联免疫分析试剂盒购自于上海丽臣生物科技有限公司。
1.2 构建pcDNA3.1(+)-ChIFN-α重组载体
1.2.1 引物的设计与合成
根据NCBI 鸡IFN-αcDNA 基因序列(序列号为EU367971),用Primer Premier 5.0 设计一对引物,用于扩增ChIFN-α基因,其中F1 为上游引物并外加EcoRⅠ酶切位点;F2为下游引物并外加HindⅢ酶切位点。引物由北京六和华大基因股份有限公司合成。
F1:5’-CTGGAATTCATGGCTGTGCCTGC-3’(EcoRⅠ)
F2:5’-GGCAAGCTTCTAAGTGCGCGTGTT-3’(HindⅢ)
1.2.2 鸡脾脏组织RNA提取及反转录
将3 日龄SPF 雏鸡致死后迅速取出脾脏,立刻用DEPC 乙醇棉消毒过的剪刀将脾脏剪成20~70 mg 小块,按TaKaRa 的RNAiso Plus(Total RNA 提取试剂)说明书提取RNA。使用TaKaRa公司的反转录试剂盒进行cDNA的合成。
1.2.3ChIFN-α基因的扩增、克隆与序列测定
以反转录的cDNA为模板,以F1和F2为引物。采用以下体系和程序进行ChIFN-α基因的扩增:10×TaqBuffer 2 μL,dNTP 2 μL,F1和F2各1 μL,模板cDNA Taq 2 μL,DNA polymeras 0.5 μL,灭菌去离子水11.5 μL,置于PCR仪中进行扩增。94 ℃预变性5 min,94 ℃30 s,58.5 ℃30 s,72 ℃45 s进行32个循环,最后72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳观察分析,按照胶回收试剂盒说明书回收582 bp 处DNA条带,纯化后连pMD19-T Vector,转化至大肠杆菌DH5α感受态细胞,挑单菌落接种到4 mL含Amp的LB液体培养基中,200 r/min、37 ℃过夜培养。将重组质粒进行PCR和双酶切鉴定,阳性质粒命名为pMD19-TChIFN-α,送北京六和华大基因股份有限公司测序。
1.2.4 真核表达质粒pcDNA3.1(+)-ChIFN-α的构建与鉴定
pMD19-T-ChIFN-α和pcDNA3.1(+)用EcoRⅠ,HindⅢ双酶切,经琼脂糖凝胶回收后连接,再将连接产物转化至大肠杆菌DH5α感受态细胞,抗性筛选;挑取单菌落进行PCR 鉴定及EcoRI,HindⅢ双酶切鉴定,阳性重组质粒命名为pcDNA3.1(+)-ChIFN-α并送北京六和华大基因股份有限公司序列测定。
2 鸡免疫指标的测定
2.1 动物分组、免疫及采样
将1日龄SPF雏公鸡240只,于实验室饲养3 d后挑取180只健康雏鸡随机分为6组,每组30只。A组为生理盐水对照组,B组为疫苗对照组,C组为疫苗+100 μg pcDNA3.1(+)对照组,D 组为疫苗+50 μg pcDNA3.1(+)-ChIFN-α试验组,E组为疫苗+100 μg pcDNA3.1(+)-ChIFN-α试验组,F 组为疫苗+200 μg pcDNA3.1(+)-ChIFN-α试验组,试验用鸡均自由采食,自由饮水,笼养,鸡舍通风良好,温度、湿度等条件均按饲养规程控制。每天观察记录鸡的生长发育情况及其他异常情况。4 日龄时,D、E、F 组分别注射pcDNA3.1(+)-ChIFN-α50、100、200 μg/只,C 组注射pcDNA3.1(+)100 μg/只,A、B组注射生理盐水300 μL/只,7日龄除A组外,其他各组均滴鼻、点眼免疫鸡ND、IB二联活疫苗。
于14、21、28、35、42、49日龄时,每组随机选取5只鸡进行试验。首先称体重;然后进行心脏采血,一部分血液放入真空抗凝采血管中(含枸橼酸),用于进行外周血液中活性T/B 淋巴细胞百分率测定;另一部分放入真空采血管(不含抗凝剂),取析出的血清进行血凝抑制(HI)试验、鸡NIBV抗体的检测试验。在鸡49日龄时进行强毒NIBV攻毒试验。
2.2 鸡阳性T、B淋巴细胞百分率的测定
用酸性α-醋酸萘酯酶染色法和甲基绿-派洛宁染色法[16-17]测定鸡外周血中阳性T、B淋巴细胞百分率。
2.3 鸡ND抗体的测定——血凝抑制试验
按照ND诊断技术国标进行试验[18]。
2.4 鸡NIBV抗体的检测
按照鸡NIBV抗体(K-IBV)酶联免疫分析试剂盒的说明书进行鸡NIBV抗体的测定。
2.5 IBV感染鸡后病理学剖检观察及攻毒保护率测定
试验用鸡在49日龄时进行攻毒,半数致死量强毒株(IBV-Grag强毒株)300 μL注射到鸡气管内,54日龄后全部剖杀。攻毒后观察试验用鸡发病情况,统计死亡鸡数量,计算免疫保护率并对感染IBV的鸡进行剖检。
免疫保护率(%)=试验结束时存活鸡只数/试验鸡只数×100
2.6 数据统计与处理
用SPSS 22.0软件对试验数据进行单因素方差分析,Duncan’s 多重比较及独立样品t检验,GraphPad Prism 7.0作图。P<0.05表示差异显著,P<0.01表示差异极显著,P>0.05表示差异不显著。
3 结果与分析
3.1 ChIFN-α基因扩增及序列测定
ChIFN-α基因RT-PCR 扩增产物经1%琼脂糖凝胶电泳图谱如图1所示,由图1可见扩增出的ChIFNα基因片段大小符合实际预期。将扩增出的ChIFN-α连接到pMD19-T 上,经EcoRⅠ和HindⅢ双酶切鉴定为阳性菌落并测序,将测序结果与NCBI(登录号EU367971)进行比对,同源性为100%。由此可见,ChIFN-α扩增成功。
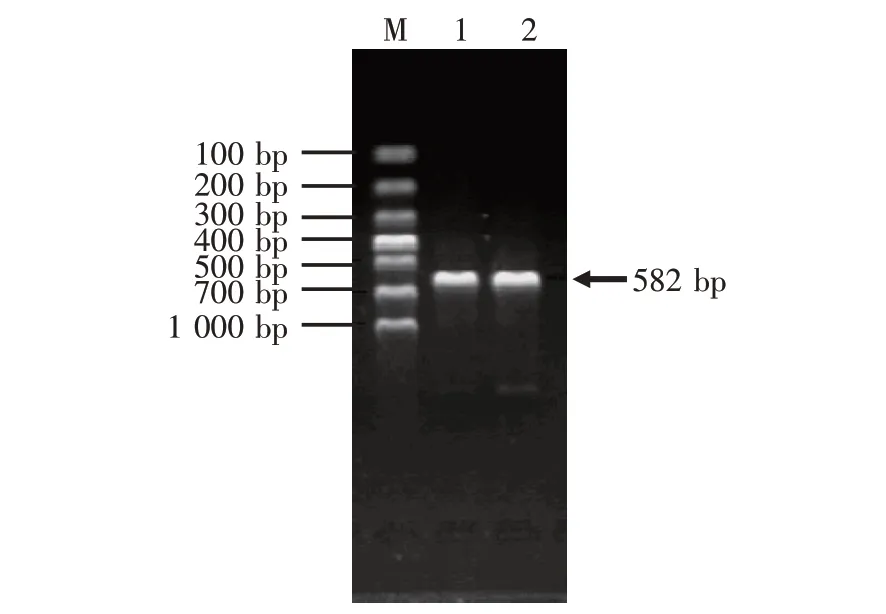
图1 ChIFN-α的RT-PCR产物电泳图谱
3.2 重组真核表达载体pcDNA3.1(+)-ChIFN-α的构建与鉴定
制备的pcDNA3.1(+)-ChIFN-α经EcoRⅠ和HindⅢ双酶切后的电泳结果如图2所示,表明获得的目的片段与预期一致,证明ChIFN-α已连接到pcDNA3.1(+)上,为进一步验证ChIFN-α已成功连接到pcDNA3.1(+),再将pcDNA3.1(+)-ChIFN-α送到测序公司进行测序。
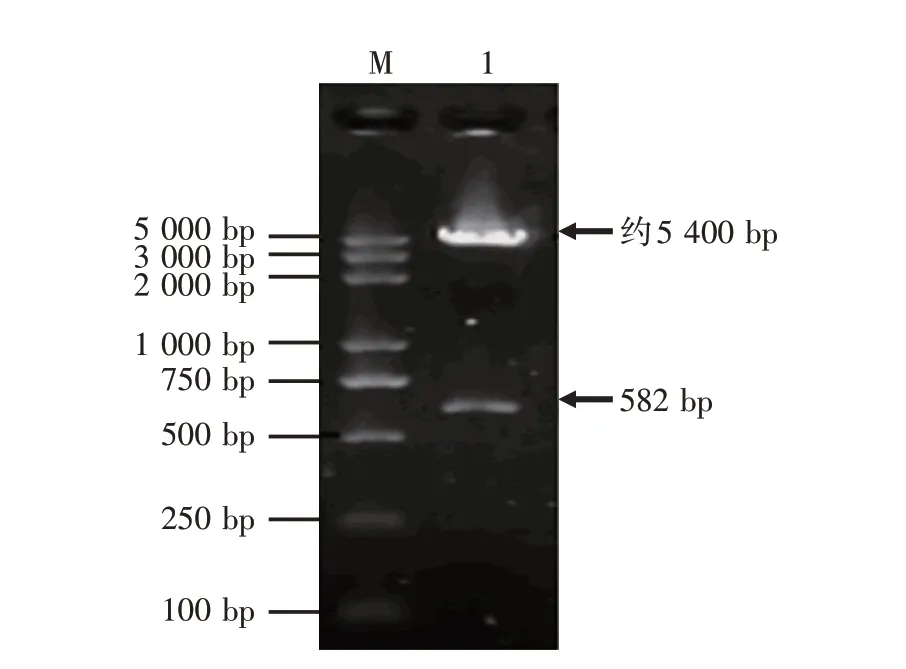
图2 pcDNA3.1(+)-ChIFN-α经EcoR Ⅰ和Hind Ⅲ双酶切电泳图谱
3.3 重组真核表达载体pcDNA3.1(+)-ChIFN-α对鸡免疫指标的影响
3.3.1 pcDNA3.1(+)-ChIFN-α对鸡外周血中阳性T、B淋巴细胞百分率的影响
由图3 可见,14、21、28、35 日龄D、E、F 组外周血中阳性T 淋巴细胞百分率均显著高于A、B、C 组(P<0.05),E组外周血中阳性T淋巴细胞百分率均高于D、F 组,在21 日龄显著(P<0.05);42 日龄E、F 组外周血中阳性T 淋巴细胞百分率均显著高于A、C、D 组(P<0.05),B组与其他组差异不显著,表明pcDNA3.1(+)-ChIFN-α与鸡ND、IB 二联活疫苗联用可显著增加鸡外周血中阳性T淋巴细胞百分率。
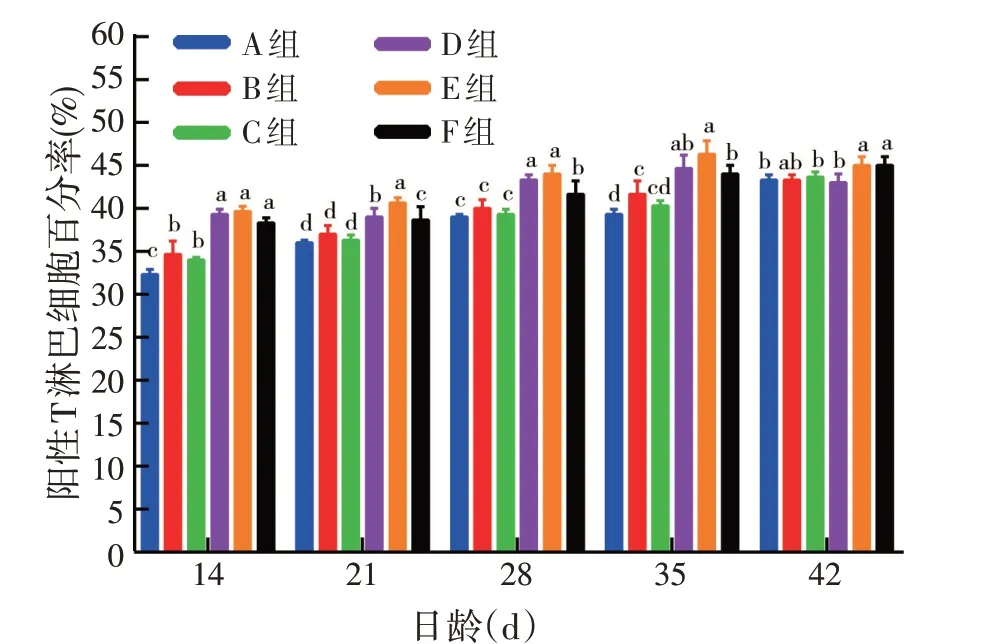
图3 pcDNA3.1(+)-ChIFN-α对鸡外周血中阳性T淋巴细胞百分率的影响
由图4 可见,在14、21、28、35 日龄D、E、F 组外周血中阳性B淋巴细胞数量高于A、B、C组,E组外周血中阳性B 淋巴细胞数量高于D、F 组,但差异不显著。表明pcDNA3.1(+)-ChIFN-α对鸡外周血中阳性B 淋巴细胞具有一定促进作用。
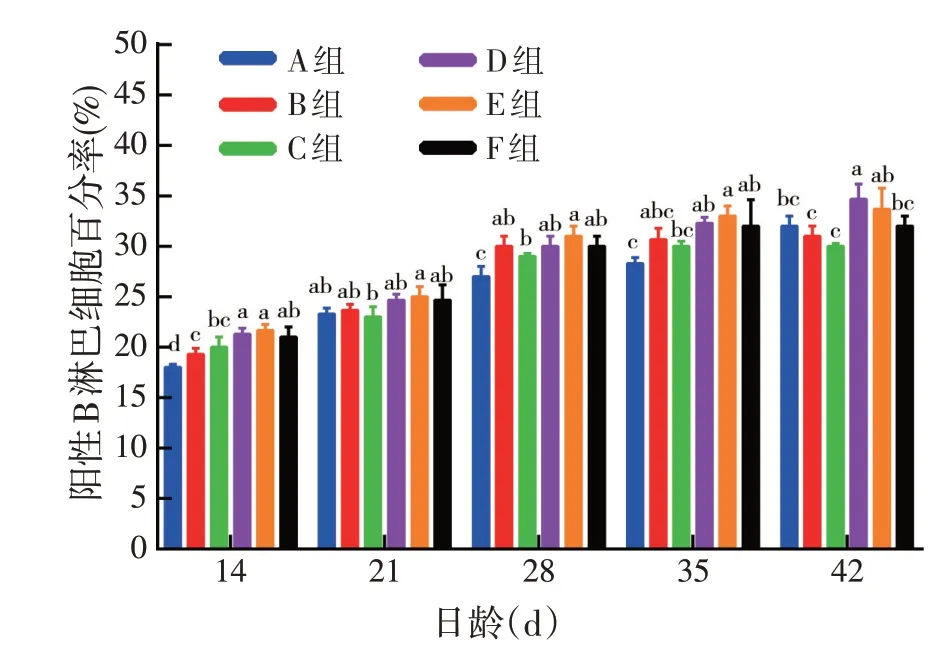
图4 pcDNA3.1(+)-ChIFN-α对鸡外周血液中阳性B淋巴细胞百分率的影响
上述结果表明,pcDNA3.1(+)-ChIFN-α与鸡ND、IB 二联活疫苗联用能提高鸡外周血中阳性T、B 淋巴细胞百分率。
3.3.2 pcDNA3.1(+)-ChIFN-α对ND-HI 抗体效价的影响
由图5可见,C、D、E组ND-HI抗体效价呈现先降低、再升高、再降低的趋势,B、F 组为先升后降,其中在28日龄ND-HI抗体效价最高,28日龄后下降;A组为先升后降,但其在35日龄时ND-HI抗体效价最高;在35日龄A组的抗体显著低于其他组(P<0.05);由此可见,pcDNA3.1(+)-ChIFN-α能增强NDV 疫苗所诱导的ND-HI 抗体效价,pcDNA3.1(+)-ChIFN-α对NDV疫苗具有佐剂的作用。
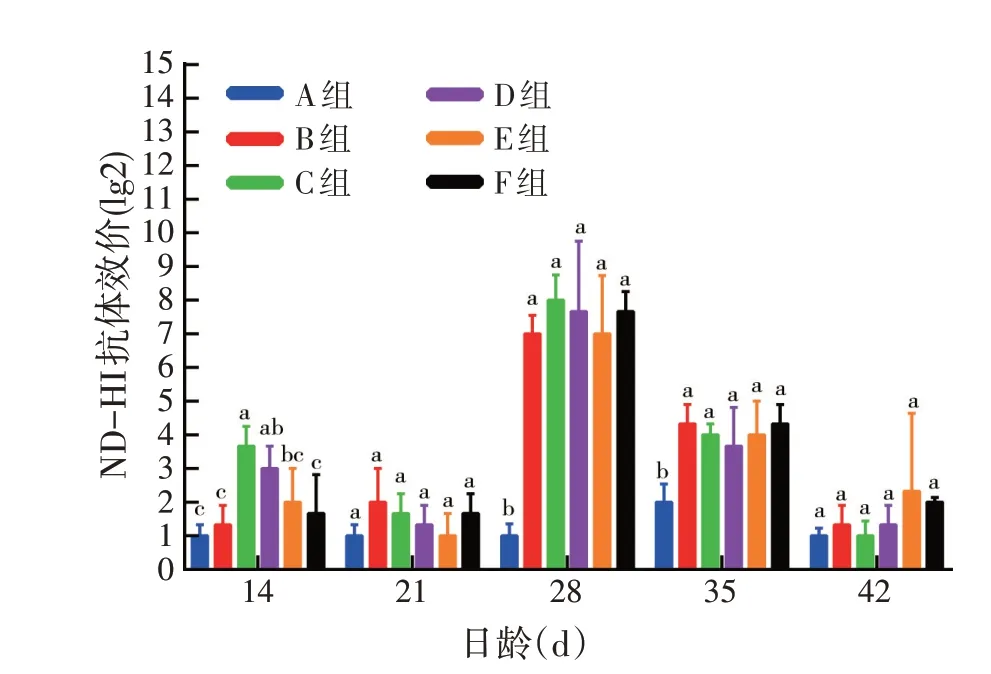
图5 pcDNA3.1(+)-ChIFN-α对ND-HI抗体效价的影响
3.3.3 pcDNA3.1(+)-ChIFN-α对IBV抗体浓度的影响由图6 可见,D、E、F 组IBV 抗体浓度显著(P<0.05)高于A、B、C组,其中E组IBV抗体浓度显著高于D、F 组(P<0.05)。上述结果表明,pcDNA3.1(+)-ChIFN-α能显著提高鸡体内IBV抗体水平,且100 μg剂量组效果最佳。
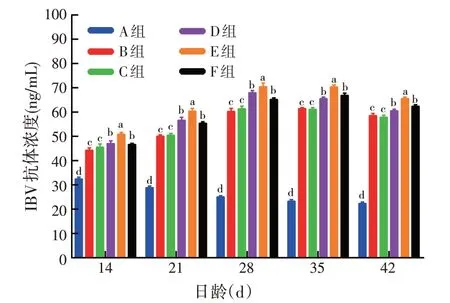
图6 pcDNA3.1(+)-ChIFN-α对鸡IBV抗体浓度的影响
3.3.4 pcDNA3.1(+)-ChIFN-α对鸡免疫保护率的影响攻毒后,A 组第2 d 开始发病,病鸡精神状态不佳,采食量和饮水量明显减少,怕冷缩成一团,低头、羽毛凌乱、排白色稀粪;第4 d 开始有鸡死亡,试验结束时各组10只鸡中,A组发病数为10只,死亡数为4只,存活数为6只;B、C组发病数为1只,死亡数为1只,存活数为9 只;D 组发病数为1 只,存活数为10 只;E、F 组的10 只鸡均无发病、死亡情况,B、C 组鸡免疫保护率均为90%;D 组有10%鸡发病,免疫保护率为100%;E 组和F 组没有发病鸡,免疫保护率为100%。由此可见,pcDNA3.1(+)-ChIFN-α可以提高鸡的免疫保护率10%,且100 μg剂量组的效果更佳。
4 讨论
细胞因子是天然免疫反应和获得性免疫反应的天然介质,在控制免疫反应中起着至关重要的作用[15]。ChIFN-α可通过由干扰素-α受体和干扰素-β受体亚基组成的共享异源二聚体受体发出信号,ChIFN-α与高亲和力的干扰素-β受体结合,然后招募低亲和力的干扰素-α受体,形成具有信号功能的三元复合物;一旦形成三元复合物,下游信号通过JAK-STAT 通路启动,激活由磷酸化的STAT1和STAT2以及干扰素调节因子9 组成的异源三聚体转录因子复合物ISGF3,激活的ISGF3移位到细胞核,并与ISGs上游启动子区的IFN 刺激的反应元件结合,这些元件编码通过各种机制发挥作用的蛋白质,以限制病毒感染[19]。
14、21、28、35日龄D、E、F组外周血中阳性T淋巴细胞百分率均显著高于A、B、C组,E组外周血中阳性T淋巴细胞百分率均高于D、F组,在21日龄显著;42日龄E、F组外周血中阳性T淋巴细胞百分率均显著高于A、C、D组,B组与其他组差异不显著。在14、21、28、35日龄,D、E、F组外周血中阳性B淋巴细胞数量高于A、B、C组,E组外周血中阳性B淋巴细胞数量高于D、F组,但差异不显著。研究表明外源性ChIFN-α可诱导内源性ChIFN-α和ChIFN-βmRNA表达显著上调[20],且体内注射IFN-α可增强抗体和T 细胞对可溶性蛋白的反应[21];I型IFN可促进树突状细胞(Dendritic cell,DC)上调MHC和共刺激分子表达,并获得增强T细胞刺激能力[22];并诱导DC产生B细胞刺激因子,包括TNF家族的B细胞激活因子和增殖诱导配体,相关研究表明IFN-α还可通过激活STAT3直接刺激B细胞分化和活化[23],这与本试验中重组表达载体pcDNA3.1(+)-ChIFN-α能提高鸡外周血中阳性T、B淋巴细胞百分率一致。
本试验采用肌注pcDNA3.1(+)-ChIFN-α免疫雏鸡,试验结果表明肌注pcDNA3.1(+)-ChIFN-α雏鸡组NDV 和IBV 疫苗所诱导的抗体水平均有明显增高趋势,表明pcDNA3.1(+)-ChIFN-α能够提高NDV 和IBV疫苗所诱导抗体水平,对鸡特异性体液免疫功能有促进作用;验证pcDNA3.1(+)-ChIFN-α具有免疫佐剂的功能,与现有佐剂相比,在接种疫苗时使用重组鸡细胞因子作为佐剂既能促进更好地保护又不会引起鸡任何不良反应或痛苦[24]。
Jang等[25]研究表明Ⅰ型和Ⅲ型IFN可以促进小鼠的获得性免疫反应,提高疫苗诱导的对病毒感染的抵抗力,但是相关研究表明与疫苗抗原同时注射的ChIFN-γ并不能增强NDV 疫苗的免疫原性[26]。攻毒试验结果表明,与生理盐水对照组相比较,免疫组和佐剂组个别鸡出现轻微临床症状,表明pcDNA3.1(+)-ChIFN-α联合鸡ND、IB二联活疫苗接种鸡可提高疫苗免疫保护率,综上所述,肌注重组真核表达载体pcDNA3.1(+)-ChIFN-α能显著提高鸡的免疫力,发挥免疫佐剂作用,最佳注射剂量为100 μg/只,pcDNA3.1(+)-ChIFN-α与ND、IB二联活疫苗联合使用能增强疫苗免疫效果,通过联合接种rChIFN-α来增强商业上可获得的ND、IB二联活疫苗诱导的免疫应答的调节,可以保护免疫鸡免受高剂量同源病毒的攻击。这些结果表明,自然产生的免疫调节细胞因子可以与商业上可获得的灭活疫苗相结合,在鸡身上产生有效的免疫策略。在未来的研究中,评估这种免疫策略对目前流行的异源病毒株的攻击的保护效果具有深远意义。
5 结论
本试验成功构建重组真核表达载体pcDNA3.1(+)-ChIFN-α。动物试验结果表明,pcDNA3.1(+)-ChIFN-α能发挥免疫佐剂作用,增强鸡疫苗的免疫效果,提高鸡的免疫保护率,pcDNA3.1(+)-ChIFN-α最佳剂量为100 μg /只鸡。

