遗传性原发性心律失常综合征的心房表型
杨丰菁 李翠兰 刘文玲
(北京大学人民医院心内科,北京 100044)
近20年来,对遗传性原发性心律失常综合征(inherited primary arrhythmia syndrome,IPAS)患者中室性心律失常的研究有了长足进展,包括临床特征、遗传学、细胞学和分子生物学等方面。相反,对遗传性离子通道病房性传导异常的原因却知之甚少,而原因不同可能导致不同类型的房性快速心律失常。以房性心律失常为表现的遗传性离子通道病患者的诊断和治疗管理仍然具有很大的挑战性,迫切需要改进[1]。现综述目前不同形式的IPAS患者心房电异常的相关知识,包括长QT综合征(long QT syndrome,LQTS)、短QT综合征(short QT syndrome,SQTS)、早期复极综合征(early repolarization syndrome,ERS)、儿茶酚胺敏感性多形性室性心动过速(catecholaminergic polymorphic ventricular tachycardia,CPVT)和Brugada综合征(Brugada syndrome,BrS)。
1 IPAS患者房性心律失常的基质
IPAS是一组由心脏离子通道编码基因突变引起的异质性疾病。这些遗传疾病的患者无明显心脏结构异常,由于易发生危及生命的室性心律失常,心脏性猝死的风险较高。心房和心室的心肌细胞可能表达由相同突变基因编码的蛋白质,因此房性心律失常在IPAS患者中很常见。对普通人群心房颤动(房颤)的遗传学基础研究已获得了一些科学证据,发现了许多单基因突变或罕见变异。尽管这些突变或罕见变异有助于理解房颤的病理生理学机制,但在解释房颤的遗传性方面价值有限。对房颤的全基因组关联研究已确定了97个与房颤风险增加显著相关的位点[2],这些位点在IPAS中可能是致病基因的潜在信号,遗传变异增加房性心律失常风险,但具体作用机制尚不清楚。
2 房性心律失常在IPAS患者中的发生率
普通人群中年轻人(年龄<50岁)的阵发性房颤患病率为0.1%,IPAS患者的房颤患病率明显升高,从LQTS患者的2%到SQTS患者的30%(见表1)。阵发性房颤是迄今为止在这些患者中观察到的最常见的房性心律失常,有时也是遗传性心脏离子通道病的第一和唯一表现[3-5]。

表1 房性心律失常在IPAS患者中的发生率
3 各种离子通道病对心房电生理的影响
不同离子通道病对心房电生理的影响不同,包括对心房肌动作电位、有效不应期、心房内传导和窦房结功能的影响(见图1)。因此,造成不同离子通道病的房性心律失常其特征不同(见表2)。

图1 各种离子通道病对心房电生理的影响
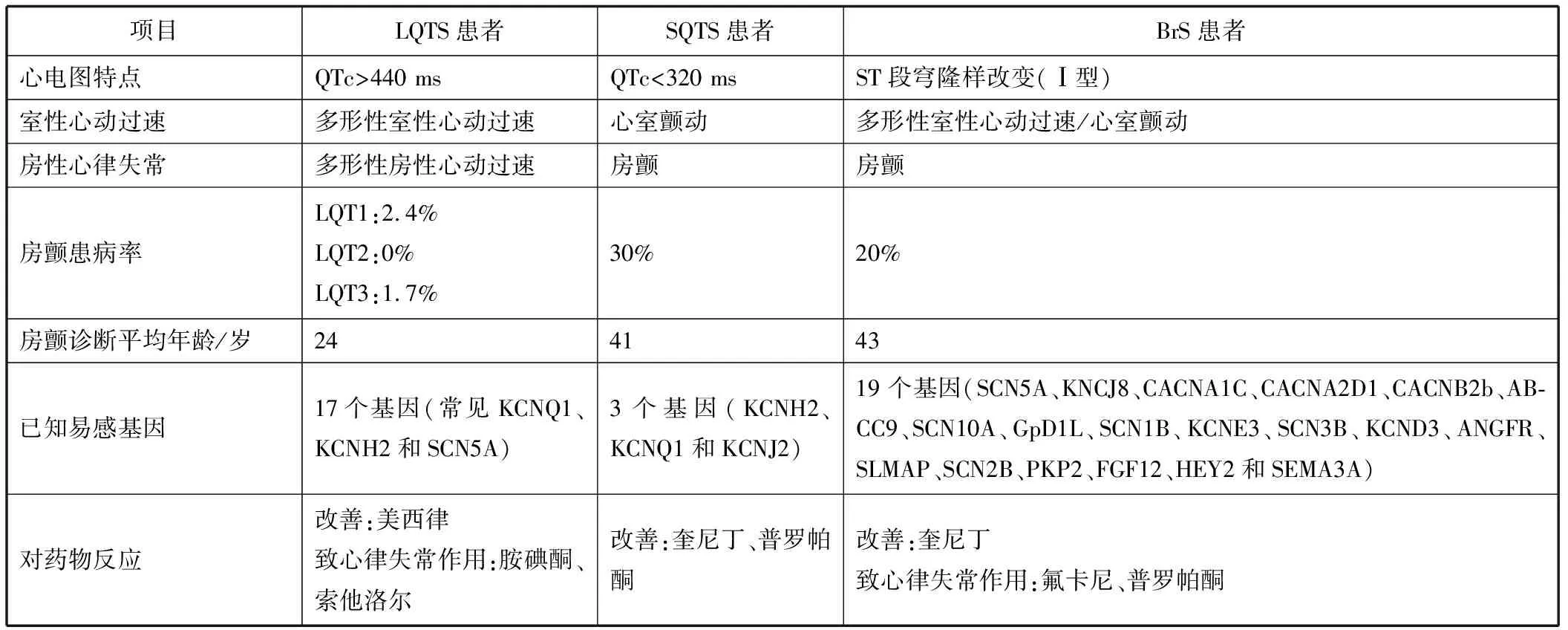
表2 LQTS、SQTS和BrS患者的房性心律失常特征
4 各种IPAS患者的房性心律失常特点
4.1 LQTS患者
LQTS患者房性心律失常少见。目前至少已发现了17个LQTS易感基因[6]。3个基因(KCNQ1导致的LQT1、KCNH2导致的LQT2和SCN5A导致的LQT3)上的突变占到临床确诊LQTS的75%。经遗传学证实的LQTS合并房颤患者中,有63%的患者存在KCNQ1的功能缺失突变。LQTS患者在50岁之前发生房颤的风险是普通人群发生房颤风险的17倍(RR=17.5,CI2.2~139.6)[4]。
LQTS患者发生房性心律失常的机制:Kirchhof等[7]报道,在不同起搏周长下,LQTS患者复极化为50%~90%的心房动作电位时程与对照组相比均延长,有效不应期亦延长,提示LQTS患者由于心房动作电位时程和有效不应期的延长可使心房电生理发生改变。这些改变很可能是由KCNQ1编码的IKs功能障碍决定的,导致多形性房性心动过速的易感性增强,但在体表心电图上与房颤相似,如图2。Kirchhof等[7]发现,多形性房性心动过速在体表心电图上表现为粗的房颤,有时P波轴出现周期性变化,单相动作电位(monophasic action potential,MAP)形态碎裂在房颤时常见,多形性房性心动过速时几乎不存在,如图2所示。
同样,Satoh和Zipes[8]报道了用氯化铯(一种钾通道阻滞剂)在犬在体心脏引起早期后去极化,从而研究多形性心房快速心律失常的作用。基于这些观察,推测LQTS患者在室性和房性快速心律失常的发展过程中均存在类似的致心律失常机制。
4.2 SQTS患者的房性心律失常
已发现编码心脏钾通道的3个基因上的突变可通过功能获得性机制引起SQTS[3个基因为KCNH2 (SQT1)、KCNQ1(SQT2)和KCNJ2 (SQT3)];相反,心脏电压门控钙通道(包括CACNA1C、CACNB2B和CACNA2D9)的突变是通过功能缺失机制导致SQTS,并与BrS表型重叠。房颤常见于SQTS患者,在所有病例中约有一半的SQTS患者房颤是首次临床表现。SQTS患者房性和室性心律失常的潜在病理生理机制是由于钾通道功能的增加而缩短了不应期[9-10]。Villafae等[11]荟萃分析发现儿童孤立性房颤与SQTS相关。
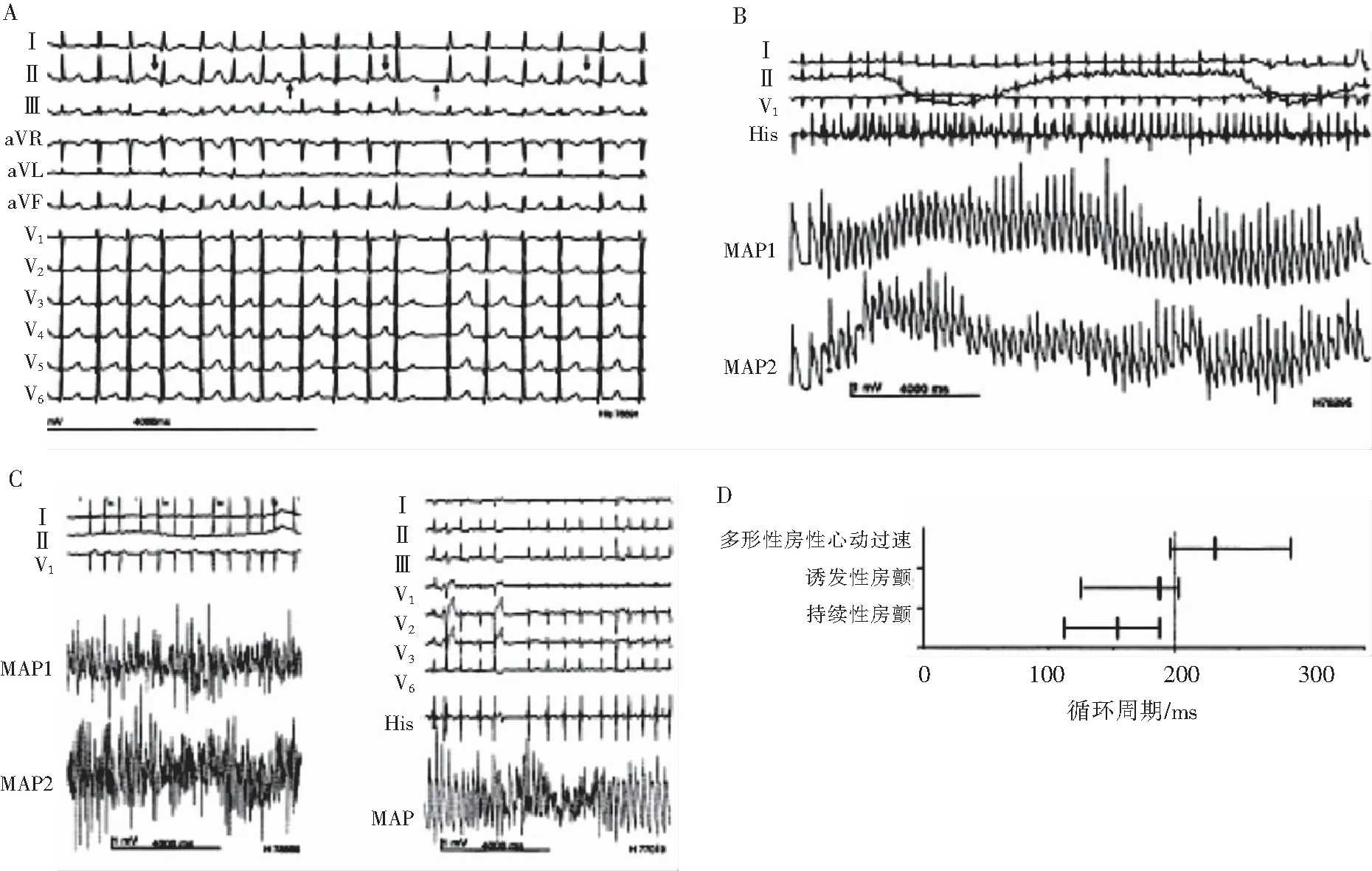
注:图A为12导联心电图记录。在导联Ⅱ中,正P波用向下的箭头表示,负P波用向上的箭头表示。在这8 s的记录中可观察到P波的周期性扭转。图B为由额外刺激引起的多形性房性心动过速。图C左图为1例36岁无器质性心脏病的男性患者,单发持续性房颤后行体外转复的右心房MAP记录;图C右图为1例17岁女性患者局部触发非持续性房颤发作,右心房MAP记录。MAP记录到碎裂波,心房周期长度<200 ms。
4.3 BrS患者的房性心律失常
4.3.1 BrS患者心律失常的可能基质
BrS患者的心电图表型是由于右心室流出道水平的外向复极电流增加,这是由钠或钙通道电流减少或向外钾电流增加引起的。BrS的致心律失常的基质可能不局限于心室水平。类似的心房改变可能是折返性心房快速心律失常的基质,但尚未得到广泛的研究。心房也存在瞬时外向电流,房颤事件是由联律间期很短的心房期外收缩引起,说明类似室性心律失常的基质可能也是BrS患者房颤的基质。这些患者的房颤发作常以自主张力增高为先兆,而且大多数房颤发生在夜间迷走神经兴奋时,此时心房传导速度降低,有效不应期缩短,有利于房颤的发生。
4.3.2 BrS与房颤
伴有阵发性房颤的BrS患者表型较严重,疾病进展较快,晕厥发作、自发性或诱发持续性室性心律失常以及自发性Brugada 1型心电图发生率等均较高。阵发性房颤是BrS患者中最常见的室上性心律失常,约占20%[12]。发生房颤的BrS患者基因检测阳性率更高,SCN5A突变与心房传导时间延长和电生理检查诱导房颤相关,而与疾病严重程度无关。
4.3.3 BrS伴房颤患者安装植入型心律转复除颤器的注意事项
安装了植入型心律转复除颤器的患者房颤的发生率较高,其中有20%的患者会因房颤伴快速心室反应而经历不恰当电击[13],适当的筛查和选择最合适的器械类型(单腔、双腔或皮下),再加上仔细的程控,对于正确检测快速房颤发作和减少不适当电击的发生率非常必要,不适当电击会显著影响这些年轻患者的生活质量。
4.3.4 BrS患者房颤的药物治疗
BrS患者阵发性房颤的药物治疗会受限,因为不能使用具有钠通道阻断特性的传统抗心律失常药,这可能会导致心律失常,且发展为危及生命的心律失常。禁用氟卡尼、阿义马林、普鲁卡因酰胺和普罗帕酮,因为它们与室性心律失常的风险增加有关。避免使用胺碘酮、普萘洛尔、维拉帕米和维纳卡兰,而索他洛尔、奎尼丁或其他β受体阻滞剂可能有用。然而,由于其副作用,年轻患者的耐受性不佳。
4.3.5 BrS患者房颤的消融治疗
虽然肺静脉隔离是目前治疗阵发性房颤最广泛的消融策略,但对于BrS患者的最佳有创性治疗选择仍存在争议。BrS患者房颤的病理生理机制尚不清楚,肺静脉触发的作用也不清楚,此外,与年龄相仿的孤立性房颤患者相比,BrS患者房颤消融的长期效果相对较差。
4.3.6 BrS与房室结内折返性心动过速
除房颤外,BrS还可与其他形式的房性心律失常共存,包括房室结内折返性心动过速。27%的房室结内折返性心动过速患者存在隐匿性BrS心电图[14]。在这些病例中,已知或怀疑导致钠通道电流功能丧失的遗传变异可能在房室结内折返性心动过速和BrS之间提供了一种机制联系,并倾向于两种表型均表达。
4.4 ERS与房性心律失常
目前尚无关于ERS患者房性心律失常的具体信息。Junttila等[15]报道,阵发性房颤发生在15%的中年和心电图有下侧壁早期复极改变的人群,心脏钾通道基因编码的功能增强(Kir6.1)与房颤易感性和早期复极增加有关,表明离子通道功能在心室和心房复极中都有作用。导致ERS患者心室电生理异常的病理生理机制仍有争议,目前尚无具体的研究来评估这些患者的心房电生理异常。
4.5 CPVT与房性心律失常
房性心动过速在CPVT患者中很少见,运动诱发的室上性心律失常仅在CPVT患者中偶有报道[2],但无进一步的具体数据。超过一半的CPVT病例是由雷诺丁受体常染色体显性错义突变引起。雷诺丁受体是心肌兴奋-收缩耦联所必需的肌质网上主要的Ca2+释放通道。在CPVT小鼠模型中,已显示雷诺丁受体介导的心房肌细胞舒张期肌质网Ca2+泄漏与房颤有关[16]。此外,大多数实验研究一致认为,蛋白激酶A和钙/钙调素依赖性蛋白激酶Ⅱ磷酸化雷诺丁受体可增强肌质网Ca2+泄漏,这与CPVT的异位活性和对心律失常的易感性有关。
5 心房电活动的评估
P波时程和离散度可从体表心电图中获得。这些指标的延长反映了心房去极化的不均匀性,由心房压力升高、局部缺血或代谢应激等所致。反过来,又促进了心房重构,为房颤的发生提供了基质。P波指数已被用于检测心脏病和非心脏病患者的心房状态,P波指数的延长与高血压、肥胖和糖尿病相关,这些均为房颤的危险因素。同样,P波延长和离散度与阵发性房颤患者的房颤复发有关[17]。
基线心电图可能反映由于心房电解剖基质不良重塑而导致的亚临床结构性心房异常。体表心电图的P波代表心房去极化,其时程可能是可靠的心房传导时间。以往的研究表明,异常的P波轴和长P波时程与房颤的风险增加密切相关。此外,提出了P波指数,包括时程、面积和振幅,以量化心电图上的心房电特性,但它们在预测房颤发生方面的价值有限[18]。
BrS患者的基线心电图反映了心房电异常,这是由于心房离子通道病的存在,而独立于先前房颤的发作。与健康对照组相比,BrS患者的P波时程更长,这种异常可能与Kusano等[12]报道的心房动作电位延长和心房内传导时间延长有关。研究人员未发现心电图1型BrS患者与2型、3型BrS患者心房内传导时间、P波时程以及心房有效不应期等电生理参数存在显著差异。
最近发现,在无房颤病史的BrS患者中有一种隐匿的异常心房表型的存在。无房颤病史的BrS患者存在明显的心房电异常,与阵发性房颤患者相比,这种异常更为明显。此外,即使无明显的室性表型、症状或SCN5A基因突变,也能检测到异常P波参数,提示存在恒定的异常心房表型,存在房室表型错配。心房的正常动作电位与心室的离子通道电流不同,其决定静息膜电位(动作电位的第1期和第3期)。
实验和临床证据表明,钠电流在心房和心外膜心室肌细胞之间存在异质性。事实上,与心室肌细胞相比,心房肌细胞的钠电流密度要大得多,激活和失活的时间在心房肌细胞中更快。这些心房和心室钠通道之间的结构和药理学差异可能在遗传性钠通道病患者中被放大,并可能解释BrS患者中存在的持续异常的心房表型。高密度心房心内膜标测可能是评估BrS和房性心律失常患者心房电异常的有用工具。
6 未来展望
在心房水平上了解遗传性原发性电紊乱的建模方法和心脏离子通道病患者心房动作电位三维分布的详细信息非常重要。高分辨率心电和标测系统可提供对IPAS患者心房病变的全面了解。心脏模型可能会丰富对这些患者房性心律失常发生的病理生理机制的理解。在过去的十年中,特别关注于心房选择性药物的开发,以预防房颤和避免致室性心律失常作用。虽然有心房选择性钠通道阻滞剂,如雷诺嗪,可能对一般人群的房颤治疗有用,但这些药物可能诱发某些离子通道病。
综上所述,遗传性离子通道病的致心律失常基质并不局限于心室水平,类似的异常也会影响心房电生理特性,为心房快速心律失常的发生提供基础。深入了解离子通道病患者房性心律失常的发病机制,对诊断和治疗具有重要的临床意义,有助于更好地理解其病理生理机制,并对患者进行更恰当的个体化治疗。

