医疗器械毒理学风险评估中QSAR的应用
【作者】汤欣,赵文静,于清
美敦力(上海)有限公司,上海市,201114
0 引言
定量构效关系(quantitative structure-activity relationship,QSAR),即化合物的化学结构与其活性之间的关系的探索,起始于药物设计领域。人们通过研究生物活性和理化参数或化学结构参数之间的定量关系来预测新化合物的生理活性,如与生物大分子的相互作用,在生物体内的吸收、分布、代谢、排泄等生理相关性质的方法。医疗器械材料的生物相容性取决于材料的理化性质,它们引起的不良反应通常与材料的成分、污染物或降解产物息息相关。直接对器械材料的可沥滤物进行风险评估更为高效合理,所以新版ISO 10993-18《医疗器械风险管理过程中的化学表征》在2020年应运而生。通过化学表征及其毒理学风险评估来评价医疗器械生物相容性的模式越来越成为大家的共识。但医疗器械的组成材料往往是化学成分的混合物,如聚合物材料,成分非常复杂。在临床使用过程中,与人体接触的医疗器械可能沥滤出的化学物质种类随着器械材料的复杂程度呈几何级增加,另外随着科学技术的发展,更灵敏的分析设备及方法的出现也使得更多的化学物质被检测到,这些沥滤物中通常会有未经研究过的化合物,没有毒理学数据和临床数据,甚至连结构类似物都无法找到。以至于毒理学家们只能通过更多的生物学实验来考察该器械的使用风险。这样不仅会增加生产企业的成本,也对实验动物造成伤害。又因为动物与人体生物学上的差异,也使对该物质的风险评估存在较大的误差。
尽管目前QSAR在医疗器械风险评估中的应用尚未普及,但2007年欧盟颁布实施的REACH法规,以及同年美国国家委员会发布的《21世纪毒性检测:远景和战略(TT21C)》,均将定量构效关系(QSAR)、虚拟筛选等计算毒理学方法视为化学品风险评估以及毒性研究不可或缺的手段[1-2],用于对可能从医疗器械或材料中释放出的潜在有毒化学物质进行安全评估。所以充分理解QSAR是很有必要的。下面我们主要讨论QSAR的原理和在医疗器械领域的应用、现状以及未来的展望。
1 QSAR原理介绍
定量构效关系(QSAR),是指用各种定量的方法来确定化合物的结构与性质之间的关系。即通过分析现有的活性物质(如一系列有相同生物活性作用的结构类似的化合物),以化合物的理化或结构参数为自变量,相关生物活性为应变量,用数理统计的方法建立起两者之间的相关定量关系[3]。QSAR通过建立的算法模型来分析化合物分子结构变化与其某些生物活性的变化关系,来预测新化合物的生物活性[4]。
早在19世纪初,随着药物化学领域的进步,人们已经认识到物质的性质与其结构之间存在着一定的关系,Crum-Brown和Frazer认为化合物的生物活性和结构之间存在某种函数关系ψ=f(C)。到了20世纪初,Meyer与Traube等发现了麻醉剂的效应与一些理化性质具有线性关系。至20世纪60年代,Hansch和Free-Wilson等从研究取代基与活性的关系出发,建立了线性自由能模型,才真正定义了定量关系-活性关系,从而使构象关系的研究从定性构效关系转向定量构效关系[5],这也是今天广为应用的QSAR的基础。
随着QSAR的应用与发展,目前主要有将研究方法与建模方法相结合的二维定量构效关系方法(2D-QSAR),基于分子性状分析法发展的三维定量构效关系方法(3D-QSAR)以及为弥补3D-QSAR的不足而创立的高维定量构效关系方法。
2 QSAR应用现状
经过十几年的发展,QSAR已经从使用简易回归方法在少量化合物上的应用进化为涵盖广、多元化的基于多种统计和机器学习技术来分析数千种不同分子结构数据组的方法。QSAR最常见的应用集中在药物研发中,即筛选大量靶向候选药物化合物。美国化学文摘社(CAS)的技术人员正试图通过QSAR方法筛选具有治疗COVID-19效果的药物[6]。同时,QSAR也在农学、环境科学和食品安全等领域中发挥着重要作用:在农学和环境科学方面,QSAR可以用来优化农药分子设计,评估农药中杂质的毒性,分析农药在土壤中的消解机理和工业废水中有毒物质对水环境的危害等[7-9];而在食品安全方面,QSAR被广泛用于分析食品中未知农药的残留,研究食品中对人体具有调节功能的生理活性物质的谱效关系和评估食品接触材料中非有意添加物的风险等[10-11]。在医疗器械生物安全性评价方面,QSAR的应用目前处于初期阶段,作为预测医疗器械可浸提物和可沥滤物毒性的一种手段。
相比QSAR,同为毒理学风险评价工具的毒理学关注阈值(TTC)方法和交叉参照法(Read-across)在医疗器械领域的应用相对成熟。TTC方法是指在缺少化学特异性毒性数据的情况下,使用基于人体暴露水平(TE)的TTC来评估多种联合暴露的低剂量化合物。Readacross则通过分类分组的方法参照已知化学物质的毒性评估结构相似但毒性未知的目标物。但TTC方法不涉及特定终点的定量构效关系,而Read-across在缺少已知相似化合物的毒性数据时也是不适用的。所以对于含有未知化学结构的化合物,TTC和Read-across的分析能力都是有限的。当这些情况发生时,QSAR就能很好地弥补前两者的不足。即使缺乏可浸提物和可沥滤物研究资料或未知物的毒理学数据,QSAR也都可以为相关研究提供参考[12]。
目前免费的和商业化的QSAR模型一般可以预测理化性质、生态毒理、环境行为、健康毒理和代谢等信息。比如QSAR可以预测可燃性、表面张力、水溶性、脂溶性和氧化还原性等理化性质(不同软件模型可预测不同理化性质),以及急性毒性、生殖毒性、基因毒性、致癌性、免疫毒性和毒代动力学等健康毒理性质。这些非特异性理化性质及健康毒理信息可用于支持医疗器械可浸提物和可沥滤物的毒理学评估。预测生物降解性和沉积物毒性等生态毒理信息可用来分析医疗器械废弃用品潜在的环境行为。
在医疗器械毒理学风险评价中QSAR可应用于化学表征之后,针对可浸提物和可沥滤物的理化性质以及特定的毒理学终点的评价,如:致癌性、致突变性、遗传毒性、皮肤刺激、致敏性、致畸性、呼吸系统致敏性、发育毒性、遗传生殖毒性、吸收/分布/代谢/排泄(absorption,distribution,metabolism,excretion,ADME)等。对目标化合物的皮肤致敏性进行预测时,OECD QSAR Toolbox可根据局部淋巴结实验(LLNA)和其他动物实验数据对化学同类物进行分组,同时自动生成与代谢相关的关键事件(KE)流程以获得有害结局路径(AOP),最终预测目标物的皮肤致敏性。其中针对皮肤蛋白结合和一般蛋白结合的分析器(profiler)和针对自动氧化和新陈代谢的仿真(simulator)也起到重要作用。ALVES等整合了大量皮肤致敏反应数据集并基于贝叶斯模型(Bayes model),建立了包含体外、动物和人体数据QSAR模型的新平台,该平台相比现行的计算模型能更加灵敏地预测目标物的致敏作用[13-14]。而对于机理较复杂的遗传毒性的致突变性,当前QSAR模型大多能对其进行“阳性”或“阴性”的定性预测[15]。这些应用都体现了QSAR在医疗器械领域的潜在应用空间。
3 法规要求现状
目前,QSAR主要应用于环境、食品、工业化学品等领域,用来识别潜在的健康危害,并对危害进行筛查和优先级排序。在加拿大,根据加拿大环境法的新物质规定(1999年),监管机构使用QSAR预估加拿大国内物质清单(Domestic Substances List,DSL)并对其进行排序[16]。美国FDA对应用QSAR来进行药品杂质的毒理学评估提供相应的咨询服务[17]。在欧盟内部,欧洲委员会的新化学品政策(化学品注册、评估和授权与限制、REACH)提出了一种在单一监管框架内管理化学信息的新系统。该政策主要为促进替代(非动物)方法的开发和验证,包括QSAR模型和体外试验[18]。在REACH计划中,欧盟致力于制定一套国际公认的QSAR验证原则,以增强对QSAR预测的信心,并为监管机构提供科学依据,对QSAR预测的可接受性做出决策。目前,欧盟的经济合作与发展组织(OECD)在持续更新Read-across和QSAR相关的指导原则。2007年OECD颁布了关于验证(定量)结构-活性关系[(Q)SAR]模型的指导文件,其中明确了使用QSAR的5个基本原则(接受标准):①明确的评价终点(a defined endpoint);②清晰的算法(an unambiguous algorithm);③明确的使用范围(a defined domain of applicability);④适合度、稳健性和可预测性的适当测量(appropriate measures of goodness-of-fit,robustness and predictivity);⑤机理的解释(a mechanistic interpretation)(如果可能)[19]。
在2008年,欧洲化学品管理局(ECHA)颁布了关于信息要求和化学品安全评估的指导原则,在第六章QSARs和化学品分组中指出了可以应用QSAR来代替试验的相应情况:①结果来自(Q)SAR模型,其科学有效性已经确定;②该物质属于(Q)SAR模型的适用性领域;③结果足以进行分类和标签和/或风险评估;④提供所应用方法充分性和可靠性的文件[20]。回顾欧盟颁布的一系列指导原则和评估框架,其基本要点是,REACH要求展示所有使用的数据,包括QSAR模型生成的预测,并且明确记录模型及其使用方式。对于不同的目的应选取相应合适的QSAR模型。因为所有对化学毒性的评价无论是在体内、体外还是在模拟应用中都不可避免地含有不确定性。认识到这一不确定性,并利用互补模型和其他信息来源来解决这一问题,是评估的关键步骤。相较于REACH法规,中国的新化学物质管理办法在非测试方法的应用上还处于起步阶段。目前,仅针对一些无法开展测试的物质允许使用非测试方法。但随着计算机技术的不断发展和深入,以及人们对于替代动物试验的需求日益增加,如QSAR这类计算方法的应用和研究必然会更加深入。
目前器审中心在医疗器械中应用的纳米材料安全性和有效性评价框架指导原则(征求意见稿)中,也提到了使用QSAR,Read-across等计算机模拟研究来替代体内测试来评估皮肤刺激、眼刺激、皮肤致敏、急性毒性、重复剂量染毒、生殖发育、遗传和致癌等毒理学风险。但要注意的是成功的QSAR应用在递交时需要呈现出:对于分类和风险评估充分性;提供应用方法的相关文件;此方法适用于合适的领域;模型的科学有效性[21]。
4 可用资源介绍
目前,已有大量软件工具可用于预测化合物的理化性质、生态环境毒性、毒理终点和其他生物学特性。通常,软件给定的数据包能够预测化学物质的多个属性和终点,一些软件还允许用户开发新模型或输入新信息。常用的QSAR模型预测软件主要有两种类型:以专家规则为基础和以统计学为基础的系统。以下对目前医疗器械毒理学评估领域常用的QSAR软件作简单介绍。
5 应用实例介绍
在某款与病人临床接触时长超过30天的医疗器械的生物相容性评价中,化学表征共检测出超出AET限度的63种潜在关注化合物(chemical of potential concerns,COPC),其中22 种化合物缺乏可用的毒理学数据。毒理学家使用Toxtree、Danish QSAR Database和OECD QSAR Toolbox三种QSAR软件,对这22种化学物质的基因毒性进行预测。例如:乙基己酸乙基己酯(CAS:7425-14-1),Toxtree预测显示Ames阴性,MNT(micronucleus test)阴性,无DNA警示结构;Danish QSAR Database预测该物质的基因毒性为阴性;OECD QSAR Toolbox显示该化合物无基因毒性警示结构。根据这些结果,毒理学家得出结论,该化合物不具有基因毒性。因此毒理学家就可以用非基因毒性化合物Cramer III类TTC(90 μg/d)与该化合物在器械临床使用过程中的病人暴露剂量相比较,由于暴露剂量低于TTC,可判断该化合物不具有系统毒性的风险。
某长期植入心血管器械进行毒理学风险评估,按照ISO 10993的要求对其可沥滤物进行COPC的筛选后,发现若干COPC缺少致敏和刺激的毒理学数据。例如赤丁四醇(CAS:149-32-6)缺少刺激性数据,但Toxtree、Danish QSAR Database和OECD QSAR Toolbox均预测该化合物不会产生组织刺激风险(见表1)。通过QSAR辅助的毒理学分析结果显示该研究中缺乏数据的COPC均不具有组织刺激性或致敏性,对应的生物学风险可接受。事实上,此QSAR分析结果与前续生物学测试(豚鼠最大剂量刺激实验和皮内注射材料浸提液实验)结论一致,进一步验证了QSAR在预测医疗器械可沥滤物刺激性和致敏性方面的作用。
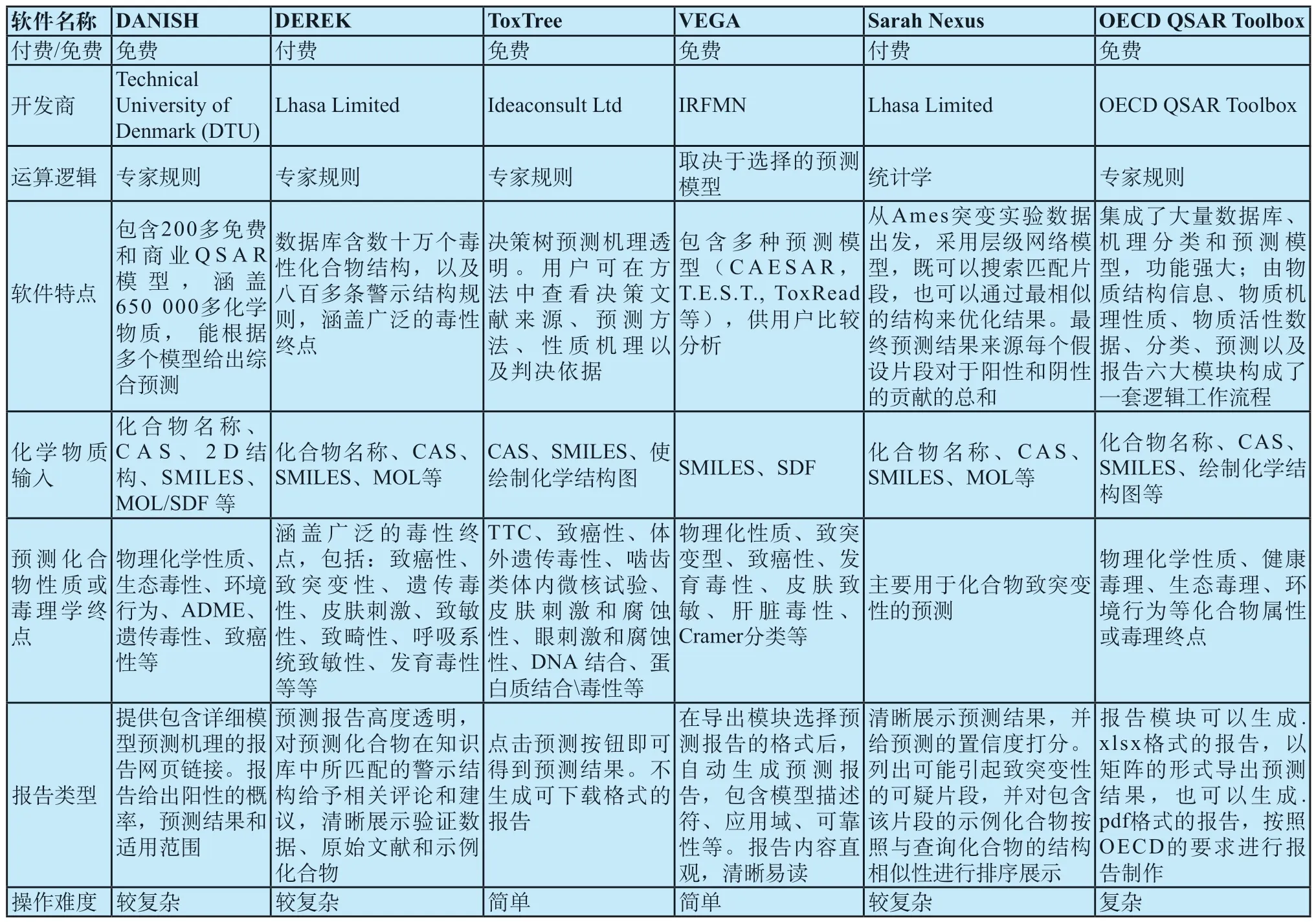
表1 医疗器械毒理学评估领域常用的QSAR软件Tab.1 QSAR software used in medical devices biocompatibility assessment
暴露途径不同常常引起化合物的吸收率不同。缺乏化合物的ADME数据可能使通过“起始点”(point-of-departure,POD)计算可耐受摄入量(tolerable intake,TI)变得困难。某长期植入产品按照ISO 10993的要求对其可沥滤物进行潜在关注化合物的筛选后,发现若干COPC缺少充分的ADME数据。其后毒理学家应用QSAR方法(OECD QSAR Toolbox)针对诸如2,4,7,9-四甲基-5-癸炔-4,7-二醇(TMDD,CAS:126-86-3)等化合物预测其药代动力学,得到了低剂量摄入有100%吸收率的预测结果,从而进一步支持了急性体内剂量TI的计算。
QSAR在医疗器械生物安全性评价方面的应用是很广的,不仅仅局限于以上列举的三个方面。
6 总结与展望
虽然定量构效关系的研究历史并不长,但因其独特的方法而具备的准确性及高针对性,使其在化学化工、医药、农药及环境等领域有着不可替代的优势和作用。而在医疗器械风险评估领域,QSAR的引入和应用也受到了越来越多的重视,软件及数据库的开发也有越来越多的研究者参与。我们系统地阐述了QSAR方法的产生背景、主要原理、国内外法规现状以及对医疗器械领域的重要作用,分析了可以用于对医疗器械风险评估的软件数据库资源。
但是一方面,医疗器械所用的高分子材料种类繁多,且每件医疗器械可能是多种材料的混合体,可能产生的可沥滤物千奇百怪,以至于数据库远远不能满足现如今对医疗器械安全性评估的需求;另一方面,许多高分子材料的结构母体虽在其他领域已经得以研究,但是,聚合成高分子化合物后在不同环境及工艺过程中的产生的有潜在毒性的物质,仍缺乏系统性的研究和应用。因此,将定量构效关系应用于该领域,可以从理论上评估医疗器械可浸提物或可沥滤物对人体的毒理学分险,缩短医疗器械生物相容性研究的时间和成本,大大提高生产企业的研发效率,对控制评估医疗器械的安全性有着十分重要的积极意义和推动作用。未来随着QSAR的推广及新算法和工具的演进,医疗器械毒理学风险预测将进入更智能的时代。

