长链非编码RNA HOTAIR对胰腺癌细胞增殖、迁移能力的影响
成洪杰,张 晓,崔培林
1.首都医科大学大兴教学医院消化内科,北京 102600;2.北京市大兴区榆垡镇中心卫生院;3.首都医科大学附属北京天坛医院国际医疗部综合内科
胰腺癌是恶性程度最高的肿瘤之一,发病率和死亡率高。根据最新中国癌症城市报告[1],2013年中国城市居民中,胰腺癌发病率为6.95/10万,死亡率为6.18/10万,且发病率和死亡率呈逐年升高的趋势。胰腺癌的早期诊断困难,就诊时,只有不足20%的患者适合接受手术治疗;晚期治疗困难,进展期胰腺癌患者的中位生存时间不足6个月[2]。鉴于胰腺癌恶性程度高、早期诊断难、晚期治疗难、易发生局部浸润和全身转移,深入探索胰腺癌发生发展的分子机制,发现潜在临床治疗靶点尤为重要[3]。
长链非编码RNA(long non-coding RNA,lncRNA)是一类转录本长度超过200 nt的不具有蛋白质编码功能的RNA分子总称。研究[4-6]显示,lncRNA在多种肿瘤中存在异常表达,与肝癌、结直肠癌、肺癌、前列腺癌、乳腺癌等密切相关,lncRNA可通过调控基因表达,影响肿瘤的发生、发展、转移、预后等。近年来,有关lncRNA在胰腺癌发生、发展中的作用得到了越来越多的关注。研究[2-3]表明,多种lncRNA在胰腺癌组织中存在异常表达,lncRNA可能在胰腺癌的发生发展中起重要作用。HOTAIR、MALAT1、H19、gas5、HOTTIP、PVT-1等多种lncRNA与胰腺癌的发生、发展、转移和预后有明显相关性。
HOX的反义基因间RNA(HOX transcript antisense RNA,HOTAIR)是第一个被发现与胰腺癌有关的lncRNA分子,长度为2 158 bp,位于染色12q13.13的HoxC位点。近年来研究表明,HOTAIR在乳腺癌、肝癌、食管癌、结肠癌等存在异常表达[7-11],HOTAIR高表达增加了肿瘤细胞的增殖、侵袭、转移能力。研究[2-3]表明,HOTAIR可能是一种原癌基因,在胰腺癌发生发展中起着重要的作用。研究[12]发现,HOTAIR在胰腺癌组织中表达水平显著上调,与胰腺癌周围淋巴结转移及远处浸润密切相关,并且异常表达HOTAIR还是影响胰腺癌患者临床预后的重要因素之一,高表达水平的HOTAIR预示着较短的生存期。
目前,关于HOTAIR在胰腺癌中作用的报道仍然较少,研究尚处于初步阶段,HOTAIR在胰腺癌中的生物学功能尚不明确,具体发挥作用途径和分子机制更是知之甚少。因此,本研究体外培养胰腺癌细胞,旨在研究HOTAIR对胰腺癌细胞增殖、迁移等影响,为胰腺癌的临床靶点治疗提供可能的方向和实验依据,为胰腺癌的诊断和治疗开辟新的途径。
1 材料与方法
1.1 材料与试剂人胰腺癌细胞系AsPC-1和Panc-1购自美国ATCC细胞中心;DMEM高糖培养基、质量浓度为100 g/L的胎牛血清、青链双抗购自美国Gibco公司;Trizol试剂、质粒表达载体pcDNA3.1、转染试剂Lipofectamine 2000均购自美国Invitrogen公司;小干扰RNA(siRNAs)和阴性对照siRNA(si-NC)由北京健坤禾润科技有限公司代购;CCK8试剂盒购自日本同仁化学研究所;Transwell小室购自美国Millipore公司;GoScriptTMReverse Transcription System A5001购自美国Promega公司;GoTaq®qPCR Master Mix A6001购自美国Promega公司;RQ1 Rnase-Free Dnase M610A购自美国Promega公司。
1.2 方法
1.2.1 细胞培养:人胰腺癌细胞(Panc-1、AsPC-1)用DMEM高糖培养基培养,补充含质量浓度为100 g/L的胎牛血清、100 U/ml青霉素及100 mg/ml链霉素,置于37 ℃、体积分数为5% CO2的饱和湿度恒温培养箱中培养。每1~2 d更换1次培养基,当细胞融合度为80%~90%时进行传代培养。
1.2.2 获取目的基因和构建质粒:查阅基因文库,发现并找到人胰腺癌细胞目的基因HOTAIR转录mRNA核苷酸序列,利用qRT-PCR技术逆转录形成的cDNA再扩增形成一个全长的HOTAIR片段,用于扩增的HOTAIR的寡核苷酸序列为:上游:5′-CATGGATCCACATTCTGCCCTGATTTCCGGAACC-3′,下游:5′-ACTCT-CGAGCCACCACACACACACAACCTACAC-3′,分别包含外源性Hind Ⅲ和Xho Ⅰ位点。验证PCR的产物并亚克隆至哺乳动物表达载体pcDNA3.1中。
1.2.3 质粒转染细胞:取对数生长期胰腺癌细胞接种于细胞培养板,待细胞贴壁且融合度为40%~60%时,通过Lipofectamine 2000进行载体及对照组的转染,具体方法参见产品说明书。注意转染前更换为无血清培养液;转染后6 h更换含质量浓度为100 g/L的胎牛血清培养液。第一步转染pcDNA3.1-HOTAIR至人胰腺癌细胞(Panc-1、AsPC-1)中,以空白pcDNA载体(pcDNA3.1-NC)作阴性对照(阴性对照组),空试剂做空白处理(试剂空白组)。第二步转染HOTAIR基因小干扰RNA(siRNA-HOTAIR)至人胰腺癌细胞(Panc-1、AsPC-1)中。应用3条独立的小干扰RNA(siRNA-HOTAIR-1187、siRNA-HOTAIR-83、siRNA-HOTAIR-1524)分别转染两株胰腺癌细胞,寻找并发现HOTAIR干扰敲低率最佳的siRNA。以阴性siRNA(si-NC)作对照,空试剂做空白处理。3个独立的HOTAIR siRNA靶序列分别为:siRNA-HOTAIR-1187:5′-GCACUGUCUCUCAAAUAAUTT-3′;siRNA-HOTAIR-83:5′-GCACAUUCUGCCCUGAUUUTT-3′;siRNA-HOTAIR-1524:5′-GCCUUUGCUUCGUGCUGAUTT-3′。
1.2.4 qRT-PCR检测HOTAIR表达量:收集转染后48 h的胰腺癌细胞,按Trizol试剂说明书提取HOTAIR总RNA。使用GoScriptTMReverse Transcription System和GoTaq®qPCR Master Mix进行qRT-PCR分析,检测HOTAIR表达水平,结果用磷酸甘油酸脱氢酶(GAPDH)的表达量进行标准化。HOTAIR的PCR上游引物:5′-CAGTGGGGAACTCTGACTCG-3′,下游引物:5′-GTGCCTGGTGCTCTCTTACC-3′;GAPDH上游引物:5′-GGGAGCCAAAAGGGTCAT-3′,下游引物:5′-GAGTCCTTCCACGATACCAA-3′。分析qRT-PCR的结果并计算其相对于临界循环次数的值,然后转换为相对GAPDH的倍数改变,采用2-ΔΔCt法进行标准化。
1.2.5 CCK8法检测细胞增殖活力:取对数生长期的胰腺癌细胞以起始1.0×103个/孔接种于96孔板,每孔加培养液100 μl,24 h后转染,每株胰腺癌细胞均设立实验组和阴性对照组(NC),每组设置5个复孔。向每孔加入10 μl CCK溶液,注意不要在孔中生成气泡,否则会影响吸光度值(OD)的读数。分别于转染后0 d、1 d、2 d、3 d和4 d检测细胞增殖。
1.2.6 Transwell细胞迁移实验:胰腺癌细胞转染后48 h进行Transwell细胞迁移实验。将胰腺癌细胞消化后铺在transwell小室上层,起始数量为2.0×104个/100 μl。含质量浓度为100 g/L的胎牛血清的培养基600 μl位于下层。24 h取出小室,用棉签擦去小室内壁一面细胞,外侧细胞结晶紫染色。显微镜下拍照。之后2% SDS裂解细胞(600 μl)。之后移入96孔板检测OD值。

2 结果
2.1 HOTAIR在人胰腺癌细胞系AsPC-1和Panc-1的表达情况
2.1.1 AsPC-1细胞:HOTAIR转染成功过表达,差异有统计学意义(P<0.05)。AsPC-1的敲低取得成功,siRNA-1187检测到最高敲低率,约为89.6%。其余两条分别为 43.8%(siRNA-83),74.3%(siRNA-1524),差异有统计学意义(P<0.05)(见表1、图1)。PCR扩增曲线和熔解曲线良好,扩增产物特异性良好(以AsPc-1过表达为例,见图2)。
2.1.2 Panc-1细胞:HOTAIR转染成功过表达,差异有统计学意义(P<0.05)。Panc-1的敲低取得成功,siRNA-83敲低率最高,相对阴性白质粒对照组平均值,敲低效率约为62.2%,差异有统计学意义(P<0.05)(见表2、图3)。PCR扩增曲线和熔解曲线良好,扩增产物特异性良好。
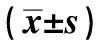
表1 AsPC-1细胞中HOTAIR相对表达量Tab 1 The relative expression of HOTAIR in AsPC-1
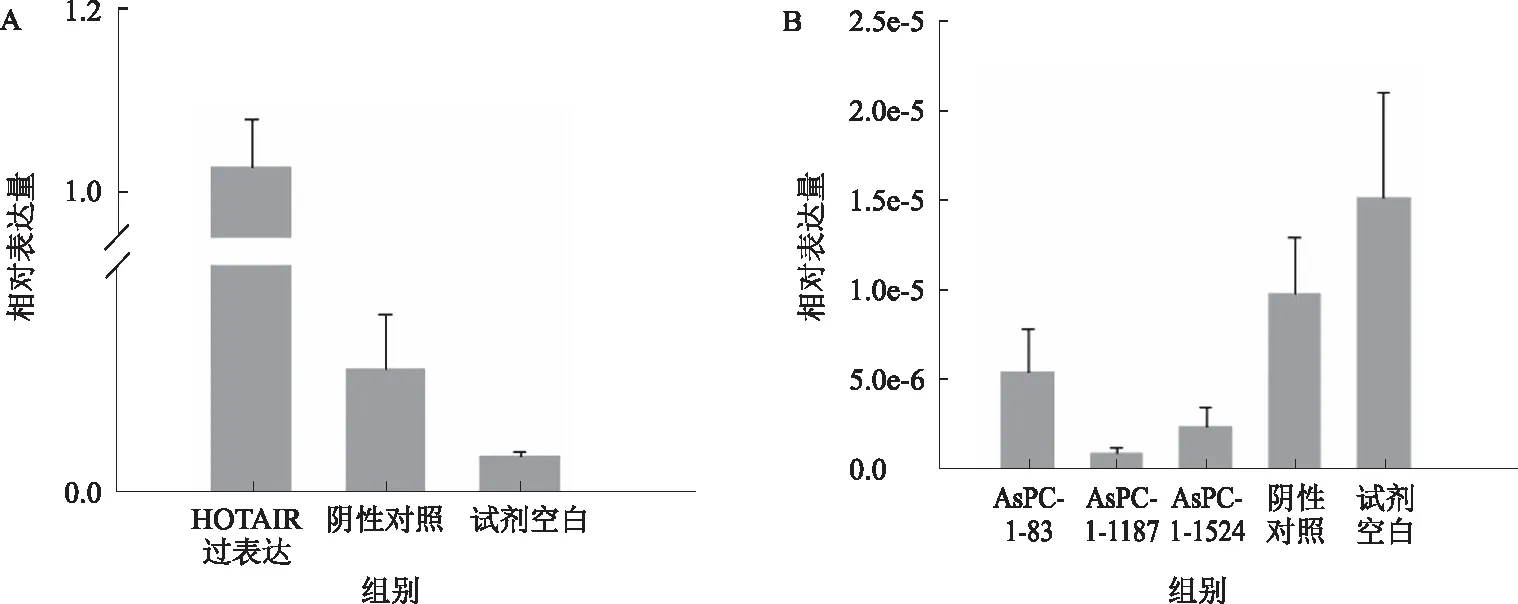
图1 AsPC-1细胞HOTAIR过表达(A)和敲低(B)Fig 1 The overexpression (A) and knockdown (B) of HOTAIR in AsPC-1
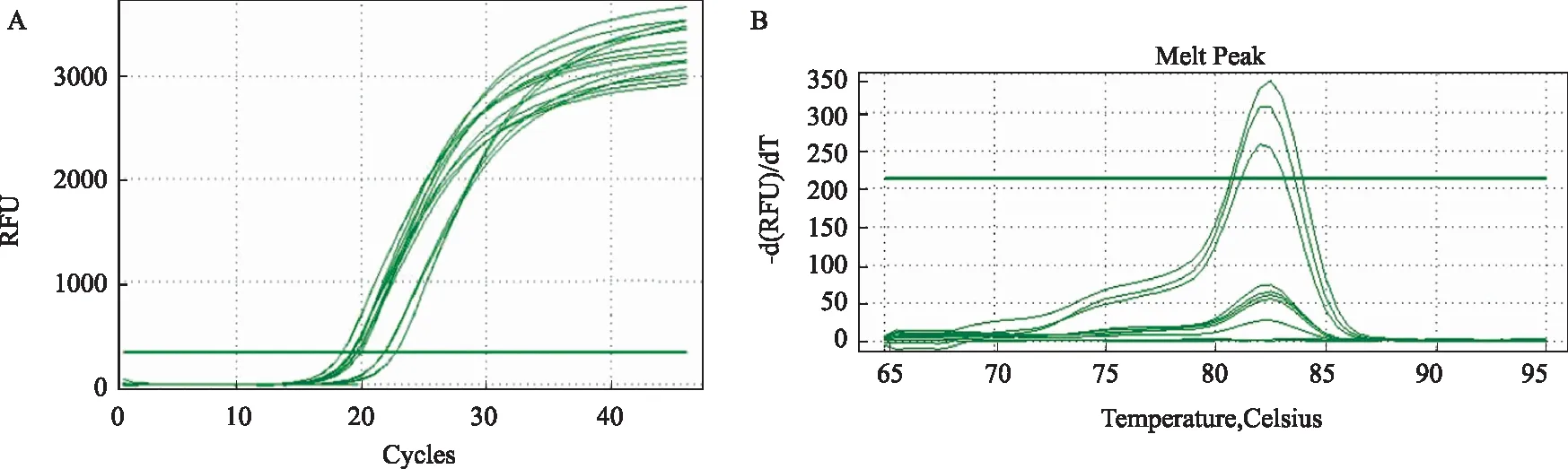
图2 AsPC-1过表达扩增曲线(A)和AsPC-1过表达熔解曲线(B)Fig 2 Amplification curve: the overexpression of HOTAIR in AsPC-1 (A) and melting curve: the overexpression of HOTAIR in AsPC-1 (B)
表2 Panc-1细胞中HOTAIR相对表达量Tab 2 The relative expression of HOTAIR in Panc-1
2.2 HOTAIR对人胰腺癌细胞AsPC-1和Panc-1增殖的影响
2.2.1 AsPC-1细胞:HOTAIR过表达组与空载体对照组相比,细胞增殖能力差异无统计学意义(P>0.05)(见图4A),这可能与HOTAIR本身在AsPC-1细胞中的高表达相关。但HOTAIR敲低实验中,3组HOTAIR敲低表达的细胞增殖能力普遍弱于阴性对照组,0~2 d此趋势较明显,差异有统计学意义(P>0.05)(见图4B)。
2.2.2 Panc-1细胞:跟踪细胞生长状况表明,相比阴性对照组,0~3 d过表达HOTAIR组呈生长优势;相比阴性对照组,HOTAIR敲低效率较高的siRNA-83和siRNA-1187组增殖能力减弱(见图5)。
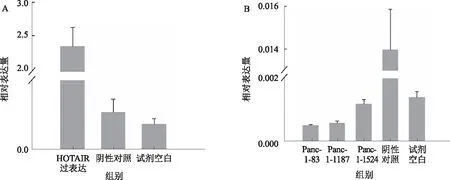
图3 Panc-1细胞HOTAIR过表达(A)和敲低(B)Fig 3 The overexpression (A) and knockdown (B) of HOTAIR in Panc-1
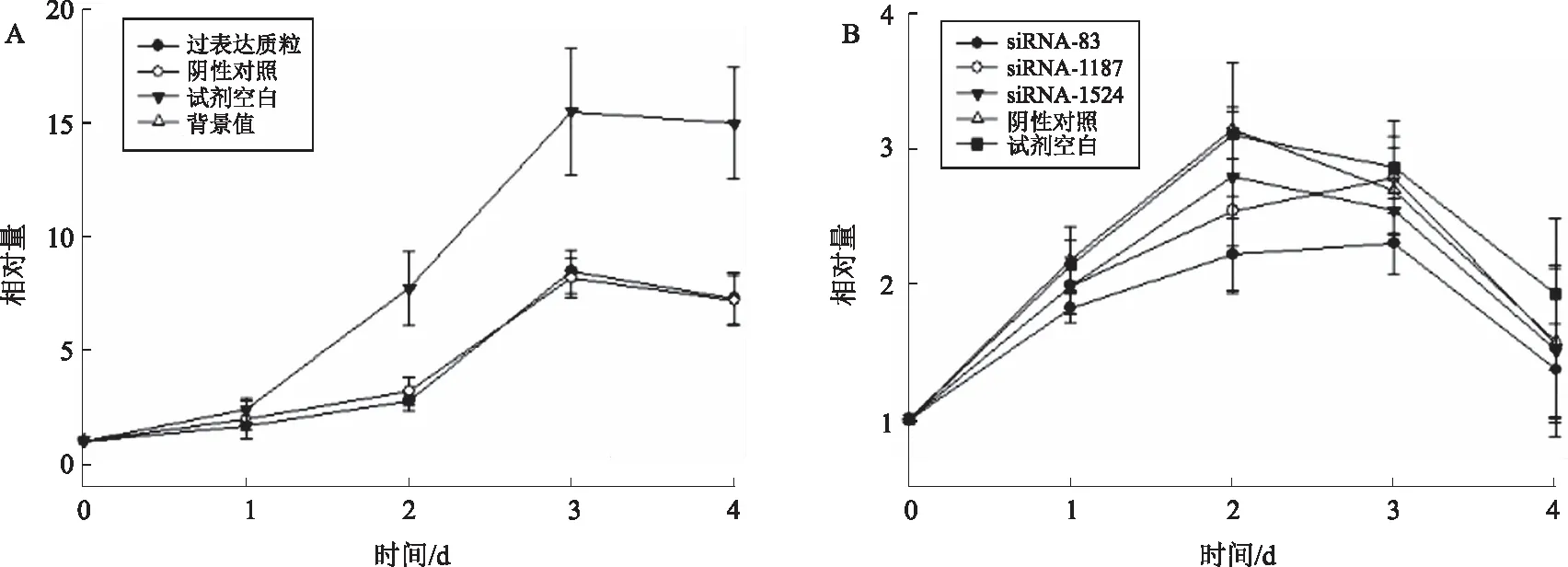
图4 AsPC-1细胞HOTAIR过表达(A)和敲低(B)对细胞增殖的影响Fig 4 The effect of overexpression (A) and knockdown (B) of HOTAIR on proliferation in AsPC-1
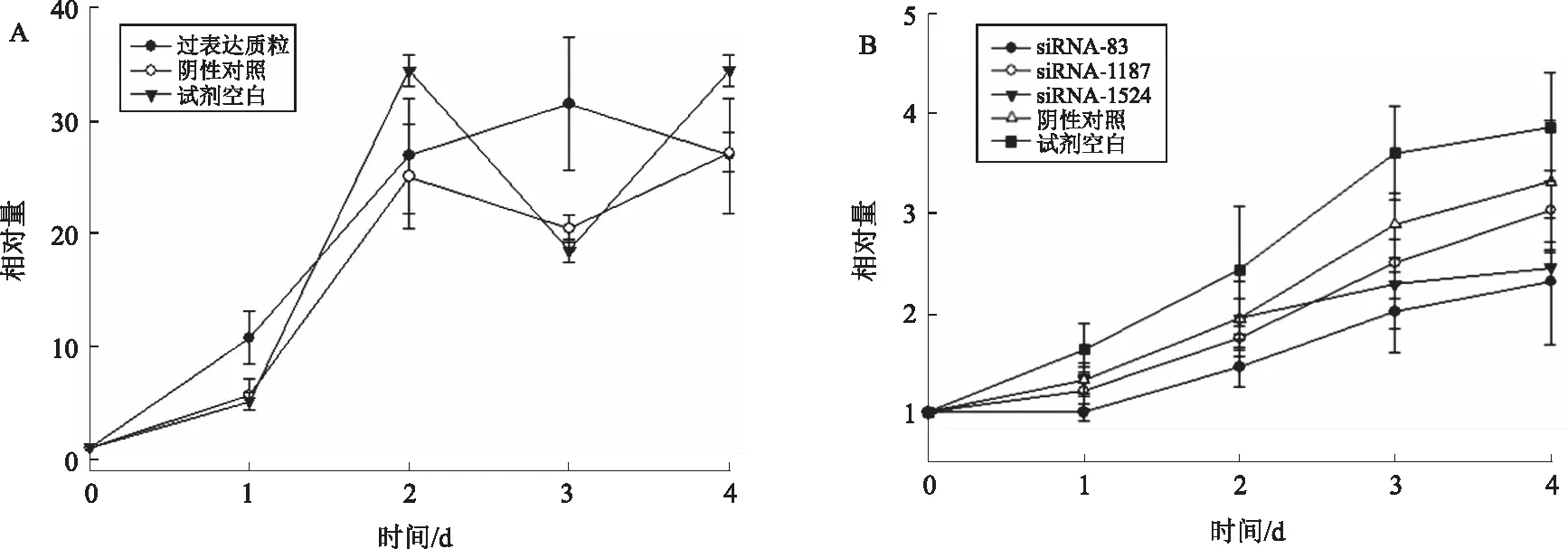
图5 Panc-1细胞HOTAIR过表达(A)和敲低(B)对细胞增殖的影响Fig 5 The effect of overexpression (A) and knockdown (B) of HOTAIR on proliferation in Panc-1
2.3 HOTAIR对人胰腺癌细胞AsPC-1和Panc-1迁移的影响
2.3.1 AsPC-1细胞:Transwell结果表明,相比阴性对照组,过表达HOTAIR组细胞迁移能力增强。siRNA-1187转染的细胞迁移能力明显下降,而siRNA-83和siRNA-1524变化相对阴性对照组不明显(见图6)。
2.3.2 Panc-1细胞:Transwell结果表明,相比阴性对照组,过表达HOTAIR组细胞迁移能力增强。敲低效率较高的siRNA-83和siRNA-1187转染的细胞迁移能力明显下降,而siRNA-1524变化相对阴性对照组不明显(见图7)。
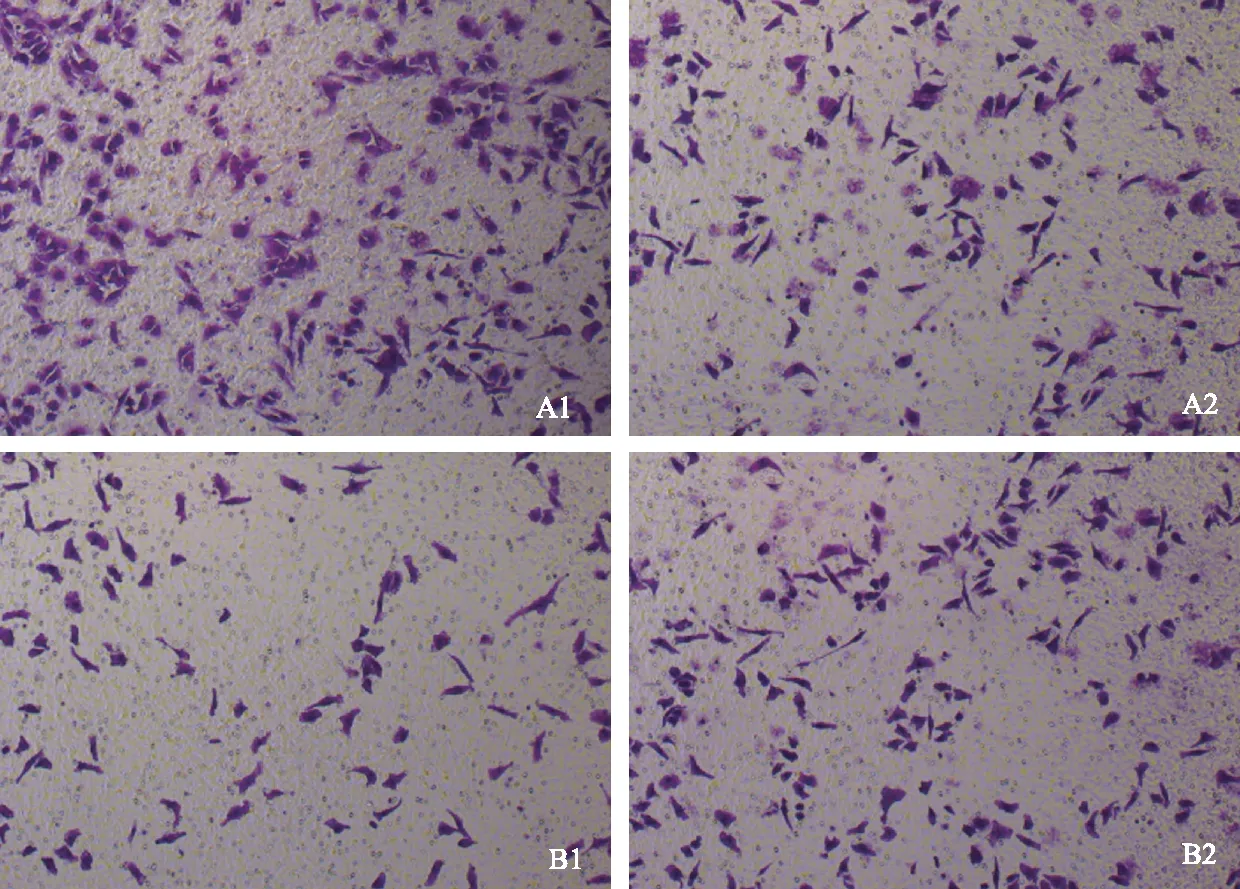
注:A1为HOTAIR过表达组,A2为A1的阴性对照组,B1为siRNA-1187组,B2为B1的阴性对照组,图片均放大100倍。

注:A1为HOTAIR过表达组,A2为A1的阴性对照组,B1为siRNA-83组,B2为B1的阴性对照组,图片均放大100倍。
3 讨论
胰腺癌是常见的恶性肿瘤之一,恶性程度高,转移出现早,早期诊断困难,晚期治疗困难,预后较差。目前胰腺癌的治疗仍以手术切除联合术后化疗为主,虽然患者术后中位生存期延长,但生存质量并未得到显著提高。因此,深入研究胰腺癌发生发展机制和靶向治疗尤为重要。
lncRNA是一类转录本长度超过200 nt的不具有蛋白质编码功能的RNA分子总称。近年来研究[7-11]表明,lncRNA与肝癌、食管癌、结肠癌、乳腺癌等多种恶性肿瘤的发生、发展相关,HOTAIR高表达可能增加了肿瘤细胞的增殖、侵袭和转移能力。此外,HOTAIR高表达常常提示肿瘤患者不良的预后。
近年来,有关lncRNA在胰腺癌发生、发展中的作用得到了越来越多的关注,为临床上胰腺癌的早期诊断、治疗和预后提供了新的方向。Kim等[12]研究发现,HOTAIR在胰腺癌组织中表达水平显著上调,与胰腺癌周围淋巴结转移及远处浸润密切相关,并且高表达水平的HOTAIR常预示着较短的生存期。但关于HOTAIR在胰腺癌中作用的报道仍然较少,研究尚处于起步阶段。
HOTAIR由Rinn等[13]于2007年首次发现并描述,是第一个被发现以反式转录干预基因表达的lncRNA。HOTAIR仅存在于哺乳动物中,由2 185个核苷酸组成,位于染色体12q13.13的HOXC11与HOXC12之间,包括6个外显子[14]。
HOTAIR有分子骨架的作用,具有特异性双向结合能力,能同时结合两种不同的组蛋白修饰复合体,并可能起到协调两者功能的作用。其5′端与多梳抑制复合体2(polycomb repressive complex 2,PRC2)的核心组成部分之一EZH2结合,可使组蛋白H3第27位的赖氨酸三甲基化(H3K27me3),介导PRC2至特定位点来沉默HOXD基因座及相关抑癌基因如HOXD10、JAM2、PCDH的转录从而促进肿瘤的转移复发;而3′端与赖氨酸特异性组蛋白去甲基化酶复合体(LSD1/CoREST/REST)结合,可使组蛋白H3第4位的赖氨酸去甲基化(H3K4deme)[15],调控靶基因转录活性,在染色体层面调控目的基因活性[16]。进一步研究发现,HOTAIR可以通过PRC2依赖性和PRC2非依赖性两种途径来介导下游基因表达调控,但HOTAIR发挥调控作用的机制仍不完全清楚。
本研究体外培养胰腺癌细胞,通过调控HOTAIR在胰腺癌细胞中的表达水平,对其增殖、迁移能力进行分析。本研究发现,在HOTAIR过量表达实验中,HOTAIR过量表达可增强Panc-1细胞增殖能力,但对AsPC-1细胞增殖无影响,我们分析可能与HOTAIR在AsPC-1细胞本身呈高表达状态相关,进一步上调HOTAIR在AsPC-1的表达水平,其促进胰腺癌细胞增殖的作用和效果可能不显著;同时,过表达的HOTAIR可以同时增强AsPC-1细胞、Panc-1细胞的迁移能力。在HOTAIR敲低实验中,通过下调HOTAIR在胰腺癌细胞的表达水平,可以显著抑制AsPC-1细胞、Panc-1细胞的增殖和迁移能力,这与前人研究结果相吻合,提示HOTAIR可能促进了胰腺癌的发展,HOTAIR高表达可能与预后不良相关[12]。
综上所述,本研究表明,HOTAIR高表达可以增强胰腺癌细胞的增殖和迁移能力,下调HOTAIR表达会抑制胰腺癌细胞的增殖和迁移能力,但由于人胰腺癌细胞种类较多,本研究只对AsPC-1和Panc-1两株胰腺癌细胞进行了研究,将来的研究可能涉及更多不同种类的胰腺癌细胞系,研究结果可能与本研究有所差异。此外,本研究仅是体外实验,研究结果尚需要进一步体内实验和临床试验的证实。

