芦荟大黄素‑铝螯合物的合成表征及抗氧化活性研究△
韩冬月,姚妮,王楚茵,方芳,关君
北京中医药大学 中药学院,北京 102488
许多慢性疾病,如阿尔茨海默病、糖尿病、帕金森病等都与人体氧化应激密切相关[1‑5],自由基和活性氧(reactive oxygen species,ROS)的过量生成或抗氧化防御系统能力下降是引起人体氧化应激的主要因素[6‑7]。天然抗氧化剂因其能够清除人体代谢所产生的自由基或ROS,且具有一定的药用价值而受到越来越多的关注。但是,由于单一成分的天然抗氧化剂大多活性较弱,而且当其处于高剂量或是缺少协同物时往往表现出助氧化活性甚至产生毒性[8],因此人们开始重视抗氧化协同作用的研究[9]。根据“中药有效化学成分的配位化学学说”,某些中药活性成分可与金属离子配位,或产生原本不具备的新活性,或产生协同作用,或降低不良反应,或解除过量的金属离子导致的中毒状态[10‑11]。这种具有配位能力的中药活性成分称为“配体类中药”。具有抗氧化活性的“配体类中药”与金属离子配位后可以影响其自身的抗氧化活性,如金雀异黄酮和山柰酚与Cu2+配位后抗氧化活性增强[12];大黄素与Mg2+配位后抗氧化活性增强[13];平贝母多糖与Fe3+配位后抗氧化活性增强[14]等,这为寻找具有协同作用的抗氧化剂提供了重要的研究思路。
芦荟大黄素(aloe‑emodin,AE),化学名为1,8‑二羟基‑3‑羟甲基蒽醌,属蒽醌类成分,在中药大黄、芦荟、决明子中多有分布,具有抗氧化、抗肿瘤、抗衰老、抗炎、保护神经、调节免疫等药理作用[15‑19]。在分子结构方面,由于AE 具有2 个酚羟基,因此具备对超氧阴离子自由基及羟自由基的强清除作用[20]。AE 具有邻近的1,8 位羟基和9 位羰基,以及完整的大π 键共轭体系,因此具备与金属离子螯合配位的能力,可以作为“配体类中药”使用。基于上述2 个结构特点,AE 可能成为一种具有抗氧化活性的“配体类中药”。目前,AE 类配合物的研究大多关注于Fe3+、Fe2+、Cu2+、Mg2+等内源性金属离子[21‑22],对外源性金属离子Al3+却少有报道。而Al3+是一种强神经毒素[23],能够促进氧化应激中ROS 和自由基的生成[24‑25],导致神经元的氧化损伤,与阿尔茨海默病、糖尿病等多种氧化应激性疾病的发生发展密切相关[26‑30]。因此,基于“中药有效化学成分的配位化学学说”,本研究假设AE 可通过与Al3+螯合配位,一方面降低Al3+的毒性以抑制自由基的产生,另一方面新形成的螯合物也很可能具有一定清除自由基的能力,从而发挥协同抗氧化作用,进而起到有效治疗氧化应激性疾病的作用。
为验证假设,本研究首次合成并表征芦荟大黄素‑铝(AE‑Al)螯合物,通过体外抗氧化实验探讨其对1,1‑二苯基‑2‑三硝基苯肼(1,1‑dipheny1‑2‑picryl‑hydrazyl,DPPH)自由基、超氧阴离子自由基、羟自由基的清除能力,从而对其协同抗氧化作用进行评价,以期为“配体类中药”治疗氧化应激性疾病提供思路,为天然抗氧化剂的研究提供借鉴。
1 材料
DF‑101S 型集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);YP10002 型电子天平(上海佑科仪器仪表有限公司);FE20 型pH 计[梅特勒‑托利多仪器(上海)有限公司];DZF‑6020 型真空干燥机(北京星德仪器设备有限公司);Sorvall ST 8R 型高速冷冻离心机、Nicolet iS10 型红外光谱仪(美国赛默飞公司);TU‑1901 型双光束紫外‑可见分光光度计(北京普析通用仪器有限责任公司);700M型核磁共振波谱仪(德国布鲁克公司)。
AE(纯度≥95%,上海源叶生物科技有限公司);无水氯化铝[九鼎化学(上海)科技有限公司];溴化钾(KBr,上海阿拉丁生化科技股份有限公司);氘代二甲基亚砜(DMSO‑D6,比利时Acros公司);水杨酸[福晨(天津)化学试剂有限公司];无水硫酸亚铁(FeSO4)、邻苯三酚、三羟甲基氨基甲烷(Tris)均购自罗恩试剂公司;氨水、无水甲醇、盐酸(HCl)、乙醚、过氧化氢(H2O2)均购自天津市大茂化学试剂厂。
2 方法与结果
2.1 螯合物的合成
精密称定AE 0.243 g(0.9 mmol)溶于适量无水甲醇中,40 ℃电磁加热搅拌溶解,待大部分AE溶解,将用适量无水甲醇溶解的0.3 mmol AlCl3逐滴加入AE 的无水甲醇中,混合搅拌15 min 后用氨水甲醇溶液(1∶1)调节pH为7.35~7.45,此时溶液变浑浊,呈红棕色,继续40 ℃电磁加热搅拌8 h后静置24 h,得螯合物沉淀,将沉淀用无水甲醇离心洗涤5 次后再用乙醚离心洗涤5 次(3000 r·min-1离心5 min,离心半径为7 cm),40 ℃真空干燥72 h,得红棕色粉末状固体。
2.2 螯合物的表征
2.2.1 紫外‑可见分光光谱分析 用无水甲醇溶解AE 及AE‑Al 螯合物至2×10-5mol·L-1,在波长200~600 nm进行扫描。AE及AE‑Al螯合物紫外数据见表1、图1,AE 在225、254、286、428 nm 处有强吸收带。225 nm 处为苯环的共轭体系谱带,254、286 nm 处为醌样结构形成的吸收带,428 nm 处为醌羰基吸收带。AE‑Al螯合物的紫外光谱图与AE 相比,吸收峰的形状没有太大变化,但吸收峰在225 nm处发生1 nm的轻微红移,在428 nm处发生2 nm的红移,且吸收峰的强度增大。428 nm 处为AE 醌羰基形成的吸收带,螯合物在此处发生红移说明醌羰基参与了配位成键,且形成螯合物的同时没有破坏蒽醌环的骨架[21]。峰位移动的原因可能为形成螯合物后,分子中电子的离域程度增大,致使电子跃迁时所需能量降低,吸收峰红移。螯合物在237、514 nm 处出现新的紫外吸收带,推测是由于铝配位成键形成的吸收带。
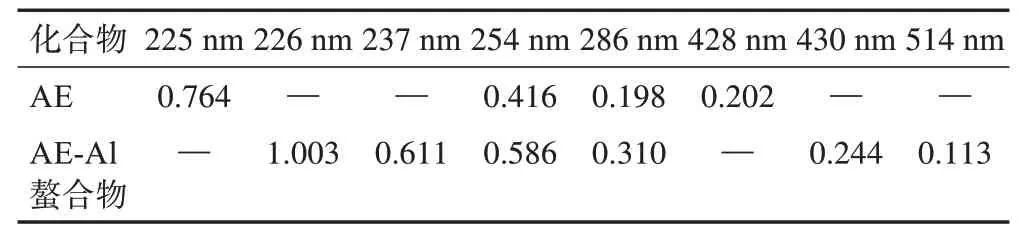
表1 AE及AE-Al螯合物的溶液吸光度
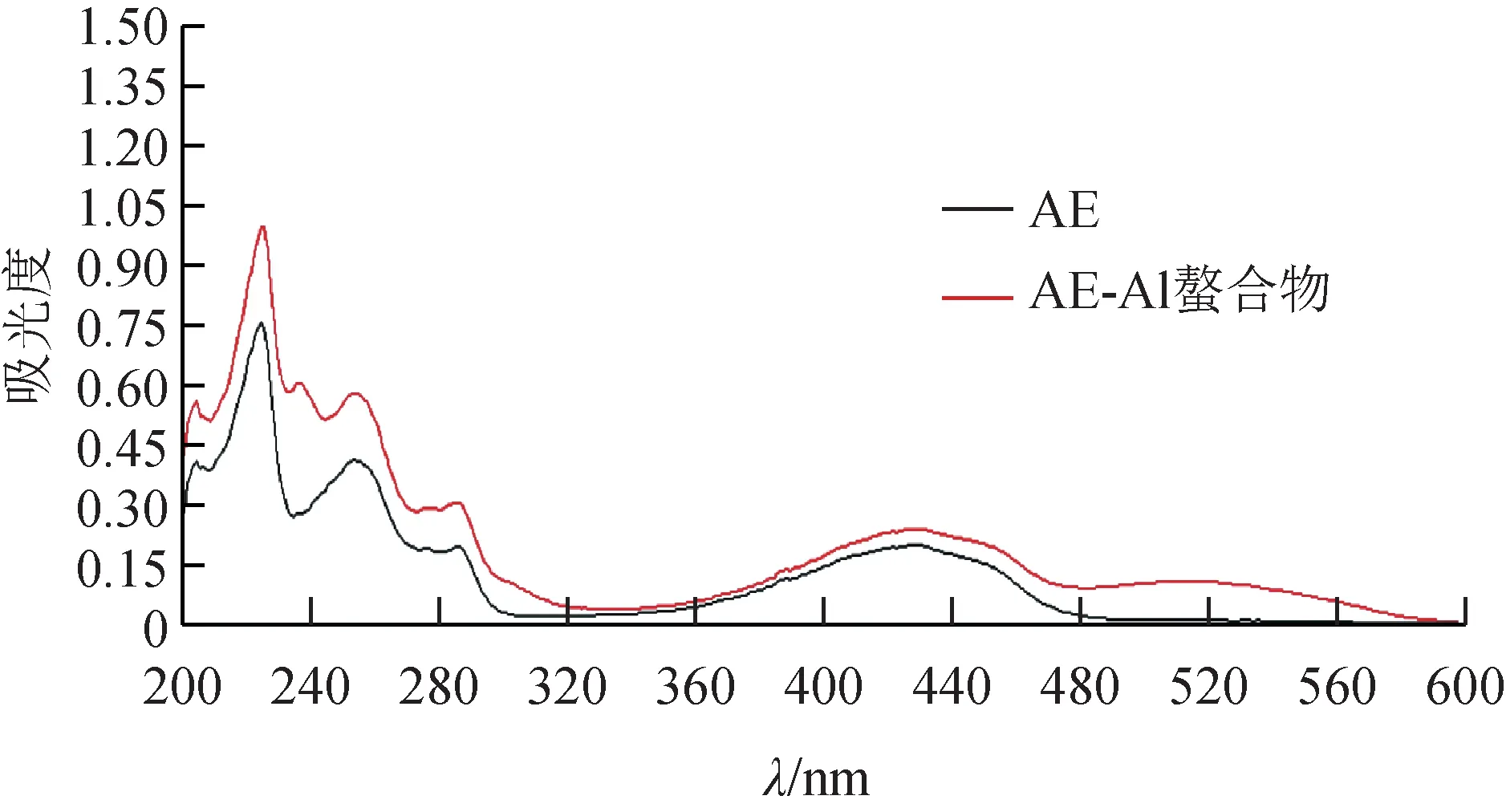
图1 AE及AE-Al螯合物紫外-可见光谱图
2.2.2 红外光谱分析 采用固体KBr 压片法,在400~4000 cm-1对AE 及AE‑Al 螯合物进行红外光谱扫描。AE 及AE‑Al螯合物主要红外特征峰有明显差异,具体数据见表2、图2。3300~3500 cm-1为羟基的特征伸缩振动峰,AE 及AE‑Al螯合物在此区域均有宽而强的羟基伸缩振动峰,在1200~1300 cm-1区域内均有酚羟基的C‑O 伸缩振动峰,由此可见,在螯合物中有酚羟基的存在。C=O 伸缩振动峰在AE中位于1 675.31、1 628.07 cm-1,当形成螯合物后,移至低波1 667.59、1 617.41 cm-1处,说明AE 中醌羰基的O 与金属离子配位,从而引起羰基成键电子云密度偏离几何中心,移向O 原子。分子中C‑O 的振动频率也向低波处移动,分析其可能为羰基发生螯合后引起相应的变化。Al 元素质量较大且配位键较弱,因此配位键的伸缩振动峰一般出现在低频区,本实验中,Al‑O的伸缩振动峰出现在593.28 cm-1处。
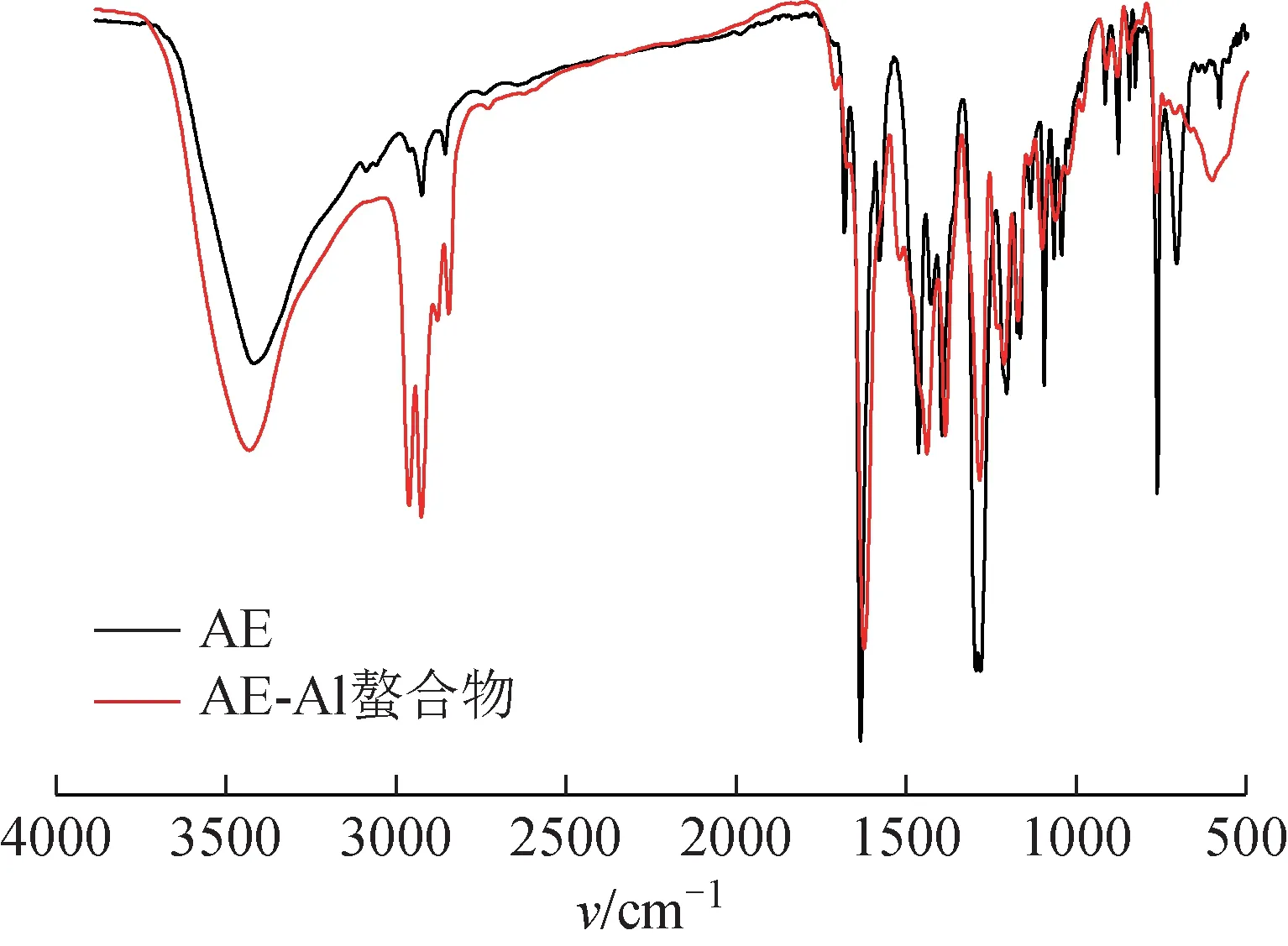
图2 AE及AE-Al螯合物红外光谱图

表2 芦荟大黄素及其螯合物主要特征峰振动频率 cm-1
2.2.3 核磁共振氢谱(1H‑NMR)及核磁共振碳谱(13C‑NMR)分析 为了进一步探讨AE 与Al3+的配位情况,本实验以DMSO‑D6 为溶剂,在700 Hz 下测定AE 及AE‑Al 螯合物的1H‑NMR 谱图,167 Hz 下测定AE及AE‑Al螯合物的13C‑NMR谱图。
由AE 及AE‑Al 螯合物的1H‑NMR 数据(表3)可知,AE 的C‑1、C‑8 位酚羟基峰化学位移为δ11.89、11.83;而相比AE,AE‑Al 螯合物失去1个酚羟基质子峰,仅在δ11.96 出现一弱峰,说明AE 的1 个酚羟基失去质子与Al3+形成螯合物。AE 的C‑1、C‑8位酚羟基所处空间结构相似,均可与C‑9位羰基形成分子内氢键,而C‑3 位羟甲基的给电子效应使得C‑8位酚羟基更易解离,由此推测,AE的C‑8位氧原子通过C‑9位氧原子与Al3+形成螯合物。由于Al3+的吸电子效应,使得C‑1 位‑OH 的电子云密度降低,移向低场,化学位移升高。
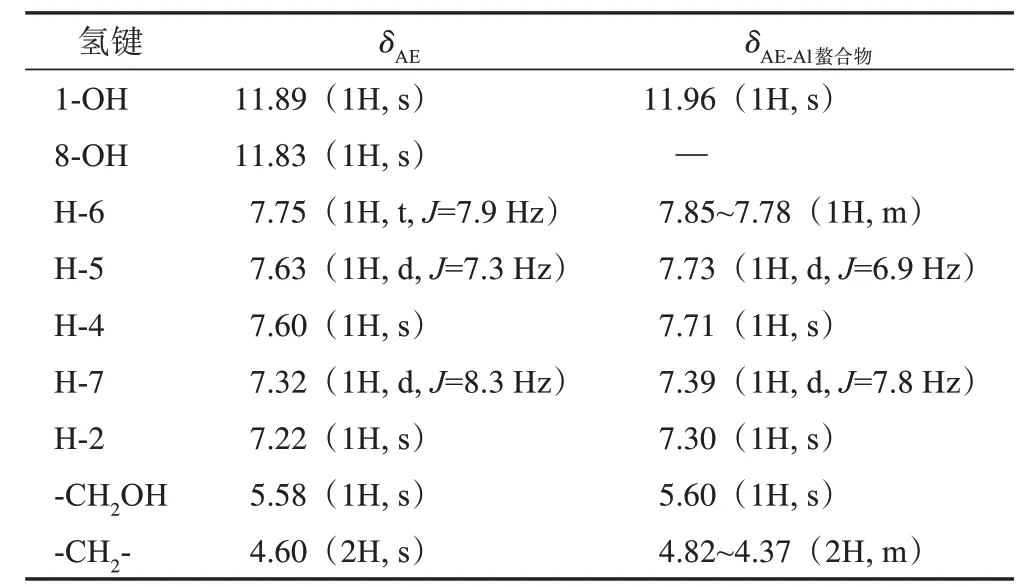
表3 AE及AE-Al螯合物的1H-NMR信息(700 MHz,DMSO)
由AE 及AE‑Al 螯合物的13C‑NMR 数据(表4)可知,两者13C‑NMR 谱变化不大,仅化学位移发生微小增加,说明未有新环境的C生成。由于Al3+的吸电子效应,使得电子云密度降低,移向低场,使得化学位移升高;配位后形成的六元环结构,使螯合物的共轭体系增加,共轭效应增大,去屏蔽作用增强,移向低场,化学位移值增大。
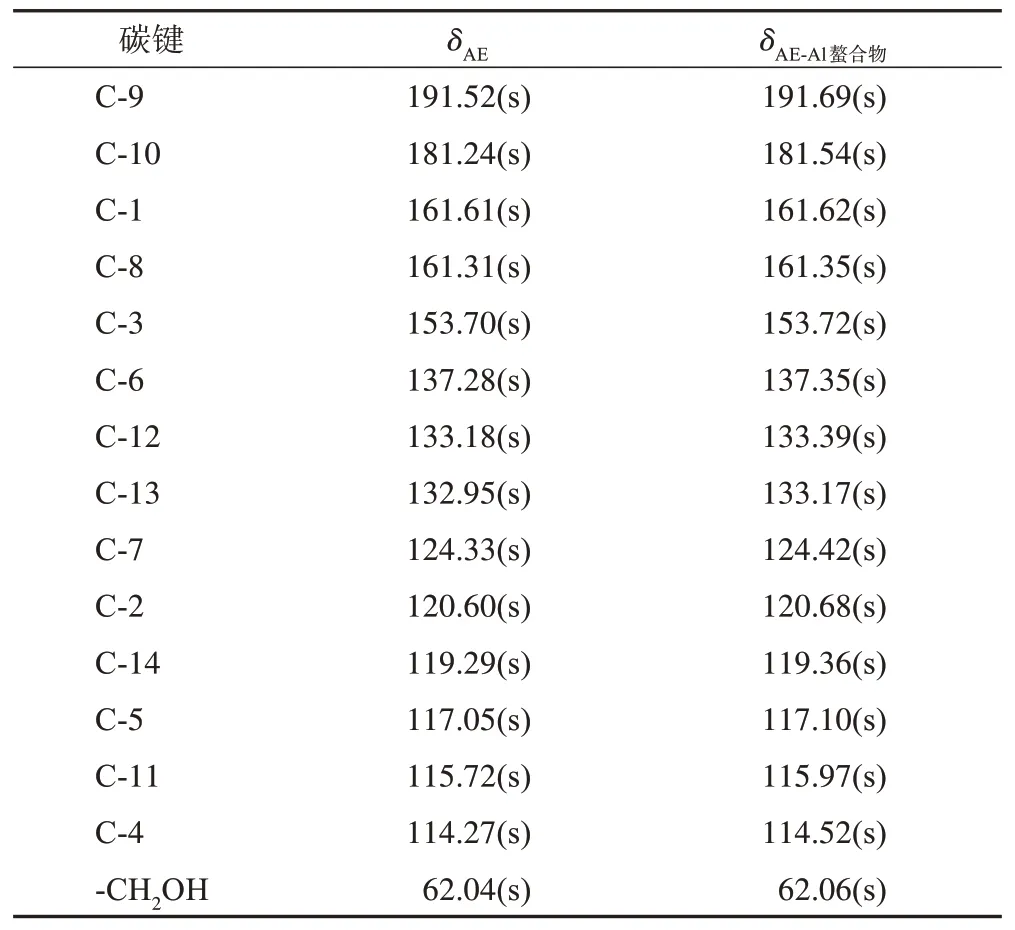
表4 AE及AE-Al螯合物的13C-NMR信息(167 MHz,DMSO)
2.2.4 配位比的测定 采用等摩尔连续变化法(又称Job 法)测定螯合物的配位比。保持AE 与Al3+的浓度之和为2.4×10-4mol·L-1,并连续改变AE 与Al3+浓度的比值,混合后于40 ℃水浴反应90 min后,在514 nm 处测定吸光度(A),以A为纵坐标(Y),AE 的摩尔分数(xR)为横坐标(X)作图(图3)。根据两边线性部分的延线相交点所对应的xR,即可求出配位比例。线性回归方程为Y=0.192 4X-0.002 8(r=0.997 2),Y=-0.421 7X+0.419 3(r=0.997 7),通过计算可得配位比为AE∶Al3+=2∶1。

图3 Job法测定AE-Al螯合物配位比
2.2.5 螯合物的结构 根据紫外‑可见分光光谱、红外光谱、1H‑NMR、13C‑NMR、Job 法结果,推测AE 通过C‑8 位羟基氧和C‑9 位羰基氧与Al3+双齿配位,配位比为2∶1,见图4。

图4 芦荟大黄素-铝螯合物可能的结构式
2.3 抗氧化活性
2.3.1 对DPPH 自由基的清除作用 取不同质量浓度的AE 及AE‑Al 螯合物的无水甲醇(2.5、5.0、10.0、20.0、40.0 mg·L-1)各2 mL 于试管中,加入25 mg·L-1DPPH‑无水甲醇溶液2 mL,室温避光反应30 min,于516.5 nm 处测定A[31],以无水甲醇代替DPPH‑无水甲醇溶液,测定A,以蒸馏水代替样品测定A。每个样品平行测定3 次,按公式(1)计算DPPH自由基的清除率。
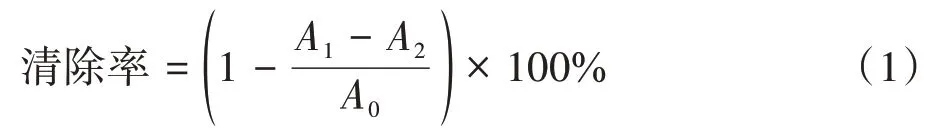
式中A1代表样品吸光度,A2代表阴性对照吸光度,A0代表空白对照吸光度。
结果如图5 所示,AE 及AE‑Al 螯合物均具有清除DPPH 自由基的能力,且清除率随浓度增加而增大,具有浓度依赖性。在实验浓度范围内,螯合物清除DPPH 自由基的能力强于同浓度AE 配体,但总体清除率不高,均低于30%。
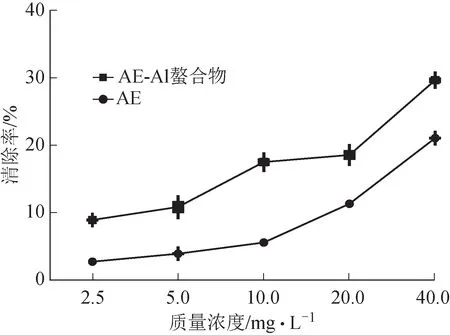
图5 AE及AE-Al螯合物对DPPH自由基的清除能力(,n=3)
2.3.2 对超氧阴离子自由基的清除作用 采用邻苯三酚自氧化法进行测定。取Tris‑HCl 溶液(50 mmol·L-1,pH=8.2)4.5 mL 于试管中,25 ℃水浴反应20 min,加入不同质量浓度的AE 及AE‑Al螯合物的无水甲醇(2.5、5.0、10.0、20.0、40.0 mg·L-1)1 mL,加入25 ℃预热的3 mmol·L-1邻苯三酚溶液0.5 mL 于试管中,混合均匀,25 ℃水浴精确反应5 min,加入8 mol·L-1盐酸溶液终止反应,于319.5 nm 处测定A[32],以蒸馏水代替邻苯三酚溶液,测定A,以蒸馏水代替样品测定A。每个样品平行测定3 次,按公式(1)计算超氧阴离子自由基的清除率。
结果如图6 所示,AE 及AE‑Al 螯合物均具有清除超氧阴离子自由基的能力,且清除率随浓度增加而增大,具有浓度依赖性。在实验浓度范围内,螯合物清除超氧阴离子自由基的能力强于同浓度AE配体。
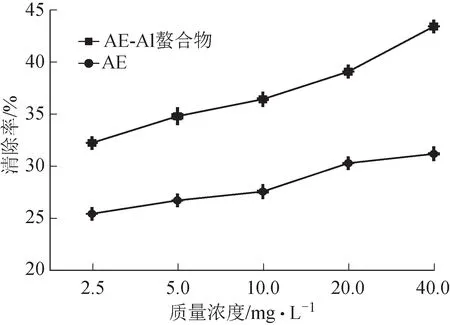
图6 AE及AE-Al螯合物对超氧阴离子自由基的清除能力(,n=3)
2.3.3 对羟自由基的清除作用 采用水杨酸法进行测定。取不同质量浓度的AE 及AE‑Al螯合物的无水甲醇(2.5、5.0、10.0、20.0、40.0 mg·L-1)1 mL,加入6 mmol·L-1FeSO4溶液、6 mmol·L-1水杨酸溶液、6 mmol·L-1H2O2溶液各1 mL,37 ℃水浴反应1 h,于510 nm 处测定A[33],以蒸馏水代替H2O2溶液测定A,以蒸馏水代替样品测定A。每个样品平行测定3次,按公式(1)计算羟自由基的清除率。
结果如图7 所示,AE 及AE‑Al 螯合物均具有清除羟基自由基的能力,且清除率较高,清除率随浓度变化不大。在实验浓度范围内,螯合物清除羟基自由基的能力强于AE配体。

图7 AE及AE-Al螯合物对羟基自由基的清除能力(,n=3)
3 讨论
本研究在甲醇体系下,以AE 为配体,Al3+为形成体,首次合成了AE‑Al 螯合物,应用紫外‑可见分光光谱、红外光谱、1H‑NMR、13C‑NMR 及Job 法对其结构进行表征,并考察螯合物的抗氧化活性。结果表明,AE通过C‑8位羟基氧和C‑9位羰基氧与Al3+螯合配位,配位比为2∶1,且在本实验条件下,螯合物清除DPPH 自由基、超氧阴离子自由基、羟自由基的能力均强于AE 配体,初步证实了AE 与Al3+产生了协同抗氧化作用。本研究结果一方面证实了AE‑Al 螯合物的可存在性,且由于螯合物易代谢出体外从而认为可以降低Al3+的毒性以抑制自由基的产生,另一方面新形成的螯合物也具有一定清除自由基的能力,进而验证了前文所提出的假设,为“配体类中药”治疗氧化应激性疾病提供了研究思路。
值得一提的是,研究组在阿尔茨海默病与金属离子关系的研究中,发现体内异常代谢的Al3+等金属离子与阿尔茨海默病多种发病机制密切相关,如Al3+可促进β‑淀粉样蛋白(β‑amyloid protein,Aβ)的生成与聚集、Tau蛋白聚集与异常磷酸化、自由基损伤等。阿尔茨海默病属中医“痴呆”“络病”范畴。“毒损脑络”病机假说是现代中医对痴呆病因病机的解释,认为“内生毒邪”是脏腑功能和气血运行失常使体内的生理或病理产物因不能及时排出,蕴积过多而生成[34]。因此,基于对中医“毒损脑络”理论及阿尔茨海默病病机的认识,研究组将过量的自由基、异常磷酸化的Tau 蛋白及Aβ,归为“内生毒邪”范畴,而异常代谢的Al3+等金属离子是诱导“内生毒邪”产生的“外邪”,进而提出了“配体类中药”——大黄蒽醌类单体治疗阿尔茨海默病的作用机制假说:一方面大黄蒽醌类单体通过配位“金属离子外邪”以消除“内生毒邪”,另一方面大黄蒽醌单体与“金属离子外邪”形成的配合物也可以除去自由基这种“内生毒邪”[35]。本研究结果证实了AE‑Al 螯合物的可存在性及清除自由基的能力,在一定程度上验证了此假说,为研发其他“配体类中药”提供借鉴。

