cMyc抑制剂10058-F4诱导白血病THP1细胞凋亡和DNA损伤的机制
魏宇靖 潘婕 柯波 符环 万才水 丁伟荣 程洪波
1江西省人民医院血液内科(南昌330006);2江西省血液肿瘤细胞生物学重点实验室(南昌330006)
急性髓系白血病(acute myeloid leukemia,AML)是一种常见的恶性血液肿瘤,主要表现为骨髓中髓系原始细胞恶性增生,导致骨破坏、骨髓造血衰竭和多个器官组织损伤。AML 好发于老年人,中位发病年龄为68 岁[1],60 岁以上的老年患者预后较差,只有2.4%的患者能达到诊断后10年的无病存活。AML 复发和耐药仍不可避免,具有高度的异质性,在过去的许多年里,随着新药的问世以及新型治疗策略的发展,AML 的治疗也取得一定的进步。尽管异基因造血干细胞移植认为是至今AML 治愈的唯一途径,但是仍可能出现复发。因此,新的治疗策略和新药的研发仍亟待问世。
原癌基因Myc(cMyc)是一种转录激活因子,其与MAX 转录因子结合形成异二聚体,与E-box DNA 结合区域结合调控靶基因的转录翻译,参与细胞周期、凋亡和细胞转化等细胞进程[2-3]。大约20%的肿瘤与cMyc 的表达相关,其在恶性血液肿瘤的发生发展过程中有着重要的作用[3]。10058-F4 是一种靶向cMyc 蛋白的小分子抑制剂,可以抑制肿瘤细胞增殖并促进细胞凋亡,体外实验证实对多种肿瘤细胞具有增殖抑制及促凋亡作用。有研究结果表示,cMyc 蛋白的上调表达通过调节K562 细胞上的NKG2D 配体的表达,促进逃避NK细胞介导的免疫应答[4]。cMyc 通过结合PD-L1 基因启动子,调控肿瘤细胞中细胞程序性死亡-配体1(PD-L1)基因的表达,并且两者在食道鳞状细胞癌中的表达水平具有相关性[5]。有文献报道cMyc抑制剂10058-F4 可以通过调控多种信号途径促进白血病细胞凋亡,但仍未完全阐明其作用机制。因此,本研究通过cMyc 抑制剂10058-F4 处理急性单核细胞白血病THP1 细胞,荧光探针染色分析细胞凋亡和线粒体膜电位变化,Western blot 检测与DNA 损伤和细胞凋亡相关蛋白表达,探讨其对细胞凋亡的诱导作用和分子机制。
1 材料与方法
1.1 实验材料 人急性单核细胞白血病THP1 细胞株购于南京凯基公司,cMyc 抑制剂10058-F4 购于上海源叶公司;胎牛血清购于Gibco 公司,RPMI-1640 培养基、青链霉素购于北京索莱宝公司;细胞培养板和培养瓶购于无锡耐思特公司;Cell Counting Kit-8(CCK-8)细胞计数试剂盒购于上海AbMole公司;JC-1 荧光染料购于上海翊圣公司;细胞周期检测试剂盒购于南京凯基公司;Calcein∕PI 检测试剂盒购于上海碧云天公司。兔抗人甘油醛-3-磷酸脱氢酶(GAPDH)、Bcl2 相关X 蛋白(BAX)、成熟型半胱氨酸天冬氨酸蛋白酶-3(Cleaved-Caspase-3)、磷酸化毛细血管扩张性共济失调症突变蛋白(pATM)和磷酸化组蛋白H2A.X(γH2AX)一抗和羊抗兔标记辣根过氧化物酶(HRP)二抗购于美国abcam 公司。Western 一抗稀释液和封闭液购于上海碧云天公司;超敏ECL 化学发光试剂盒购于上海碧云天公司;倒置荧光显微镜购于德国徕卡公司;酶标仪购于美国赛默飞公司;CO2细胞恒温培养箱购于日本三洋公司;垂直电泳槽和半干转膜仪购于美国BioRad 公司;流式细胞仪购于美国BD公司。
1.2 实验方法
1.2.1 细胞系及细胞培养 人急性单核细胞白血病THP1 细胞用含10%胎牛血清的RPMI-1640 培养液悬浮培养,用新鲜培养液悬浮细胞后铺种于96孔或者12 孔细胞培养板。
1.2.2 细胞生长抑制检测 THP1 细胞用培养液悬浮并计数,将细胞密度调整至1 × 106细胞∕mL,加入终浓度为1、5、10、50、100 μmol∕L 的cMyc 抑制剂10058-F4,对照组加入等体积二甲基亚砜(DMSO),取100 μL 铺种于96 孔板,继续培养12 h和24 h 后每孔加入CCK-8 试剂,孵育2 h 后检测450 nm 处的吸光度(OD450),比较不同浓度cMyc抑制剂10058-F4 对THP1 细胞的抑制率,每组设置3 个复孔。
1.2.3 Calcein/PI 荧光染色分析细胞凋亡 按照上述方法悬浮细胞,分别加入不同浓度的cMyc 抑制剂10058-F4(1、5、10、50、100 μmol∕L),并取2 mL接种于12 孔细胞培养板中,继续培养24 h 后,收集细胞并用PBS 缓冲液清洗,加入Calcein∕PI 检测工作液,37 ℃避光孵育30 min,荧光显微镜下观察并拍照。
1.2.4 细胞周期检测 按照上述方法悬浮并铺种细胞,继续培养24 h 后,收集细胞并用PBS 缓冲液清洗,缓慢加入预冷的70%乙醇后固定细胞24 h,用PBS 缓冲液清洗后按照说明书要求加入RNase(50 μg∕mL),37 ℃水浴30 min,PBS 清洗后400 μL PI(50 μg∕mL),4 ℃避光染色30 min,流式细胞仪上机检测。
1.2.5 JC-1 细胞线粒体膜电位检测 按照上述方法悬浮并铺种细胞,继续培养24 h 后,收集并清洗细胞。并用0.5 mL 新鲜培养基悬浮细胞,加入0.5 mL JC-1 染色工作液,混匀后37 ℃避光孵育20 min,用JC-1 染色缓冲液清洗细胞2 次,用适量缓冲液重悬细胞,荧光显微镜下观察并拍照。
1.2.6 Western blot检测 按照上述方法悬浮并铺种细胞,继续培养24 h 后,收集细胞并加入RAPI细胞裂解液(含有蛋白酶抑制剂和磷酸酶抑制剂),冰上裂解2 h 后用BCA 法定量样品的蛋白浓度。每孔道取20 μg 的样品上样进行聚丙烯酰胺凝胶电泳,并转印至聚偏二氟乙烯(PVDF)膜上,于封闭液中室温封闭2 h;4 ℃一抗孵育过夜,PBST 漂洗4 次,每次7 min;用二抗室温孵育2 h,PBST 漂洗4 次;用配置好的化学发光反应液孵育PVDF 膜,化学发光成像系统中显影拍照,用Image J 图像分析软件分析目的蛋白条带与内参条带光密度比值,得出目的蛋白的相对表达量。
1.3 统计学方法 数据采用GraphPad Prism 7 软件进行统计分析,实验结果以均数±标准差表示,多组比较采用单因素方差分析,两组间的差异比较采用非配对t检验,以P<0.05 表示差异有统计学意义。
2 结果
2.1 cMyc抑制剂10058-F4抑制THP1细胞增殖 采用CCK-8 方法对THP1 细胞增殖进行检测,检测结果显示不同浓度cMyc 抑制剂10058-F4(1、5、10、50、100 μmol∕L)处理THP1 细胞12 h 和24 h 后,均对THP1 细胞增殖产生明显的抑制作用,该抑制作用随着cMyc 抑制剂10058-F4 浓度增加抑制效应也随之增强,cMyc 抑制剂10058-F4 处理THP1 细胞24 h 后的抑制作用明显高于12 h 组,差异有统计学意义(P<0.05),见图1。
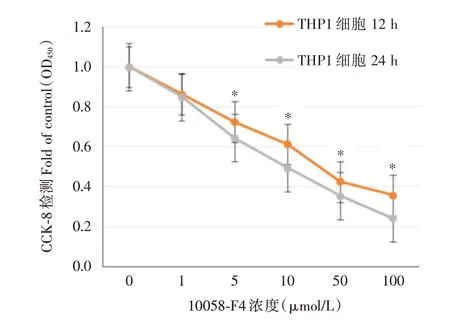
图1 cMyc 抑制剂10058-F4 不同浓度和作用时间对THP1细胞生长抑制率的影响Fig.1 The effects of cMyc inhibitor 10058-F4 with different concentrations and time on growth inhibition rate of THP1 cells
2.2 cMyc抑制剂10058-F4诱导THP1细胞凋亡 Calcein∕PI 荧光染色结果显示,cMyc 抑制剂10058-F4 处理处理后,PI 阳性细胞随着药物浓度的增高而增加。Calcein 染色代表细胞活力,染色结果显示低浓度(1 μmol∕L 和5 μmol∕L)组中Calcein 荧光强度与对照组差异无统计学意义,高浓度组(10、50、100 μmol∕L)中Calcein 荧光强度明显减弱低。结果提示cMyc 抑制剂10058-F4 可降低细胞活力,诱导THP1 细胞的凋亡,见图2。

图2 cMyc 抑制剂10058-F4 诱导THP1 细胞凋亡Fig.2 The cMyc inhibitor 10058-F4 induces apoptosis of THP1 cells
2.3 cMyc 抑制剂10058-F4 诱导THP1 细胞中线粒体膜电位下降 THP1 细胞经不同浓度cMyc 抑制剂10058-F4 处理24 h 后,经过线粒体膜电位荧光探针(JC-1)的加载,通过荧光显微镜观察荧光的变化,反映细胞线粒体膜电位的变化,结果显示不同浓度的cMyc 抑制剂10058-F4 处理THP1 细胞后红素荧光逐渐减弱,绿色荧光增强,平均荧光强度(MFI)比值逐渐降低,提示线粒体膜电位出现下降,差异有统计学意义(P<0.05),见图3。结果表明cMyc 抑制剂10058-F4 诱导THP1 细胞凋亡可能是通过降低线粒体膜电位所介导。
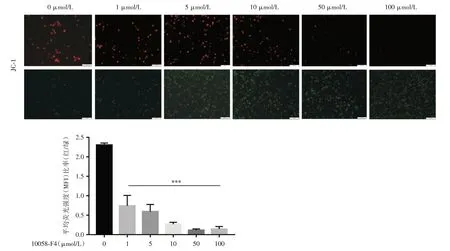
图3 cMyc 抑制剂10058-F4 诱导THP1 细胞线粒体膜电位下降Fig.3 The cMyc inhibitor 10058-F4 induced a decrease in mitochondrial membrane potential in THP1 cells
2.4 cMyc 抑制 剂10058-F4 诱导THP1 细胞G2/M细胞周期阻滞 THP1 细胞经不同浓度cMyc 抑制剂10058-F4 处理24 h 后,流式细胞仪分析细胞周期。结果显示不同浓度的cMyc 抑制剂10058-F4处理THP1 细胞后,S 期细胞比例均明显高于对照组,G1 期细胞细胞比例低于对照组,G2∕M 期细胞比例随着药物浓度逐渐上升,与对照组相比差异有统计学意义(P<0.05),提示10058-F4对THP1 细胞可能具有DNA 损伤诱导作用,见图4。
2.5 cMyc 抑制剂F410058 诱导THP1 细胞凋亡和DNA 损伤相关蛋白的表达 THP1 细胞经cMyc 抑制剂10058-F4 处理24 h 后,Western blot 检测细胞中相关蛋白表达水平。结果显示不同浓度的cMyc抑制剂10058-F4 处理后,促凋亡蛋白Bax 和Cleaved-Caspase-3 的表达水平明显高于对照组,参与DNA损伤应答蛋白γH2AX 和pATM 的表达水平也明显高于对照组,并随着药物浓度逐渐上调,与对照组相比差异有统计学意义(P<0.05),如图5。结果提示cMyc 抑制剂10058-F4 可能诱导THP1 细胞DNA 损伤,激活P53 相关信号途径促进细胞凋亡。
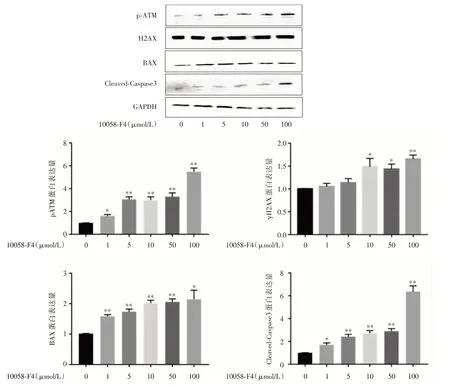
图5 cMyc 抑制剂10058-F4 对THP1 细胞凋亡和DNA 损伤相关蛋白表达的影响Fig.5 Effects of the cMyc inhibitor 10058-F4 on the protein expression associated with apoptosis and DNA damage in THP1 cells
3 讨论
AML 是一种目前尚未能治愈的恶性血液肿瘤,AML 的显著特征为疾病的克隆性进展。虽然化疗和造血干细胞移植为代表的治疗策略能提高缓解率,但仍会出现复发以及药物耐受,特别是老年患者由于存在基础疾病,治疗反应性差,需要进行个体化治疗[6]。cMyc 作为原癌基因,在多种肿瘤和血液肿瘤中高表达或者存在突变,其作为转录因子与Max 形成异二聚体,并与靶基因启动子区的特异的E-box DNA 序列结合[7]。小分子化合物可以通过抑制cMyc-MAX 复合物的形成,降低cMyc 的转录活性并导致其靶基因表达受阻,从而影响细胞周期和细胞凋亡[8]。Myc 可以促进壁龛中的造血干细胞进入增殖祖细胞状态,cMyc 蛋白的表达将介导细胞周期快速进入G1 期,其后表达下调,从而参与细胞周期调控[9]。cMyc 受核因子κB(NF-κB)信号途径调控,IκB 激酶(IKK)复合物中IKKα 和IKKβ 与cMyc 结合,并通过催化其S67 和S71 磷酸化位点增强其稳定性,转录翻译抗凋亡蛋白发挥其抗凋亡作用[10]。cMyc 作为Flt3-ITD 信号的下游靶标,Flt3-ITD 通过Wnt 信号途径调控cMyc,而且Flt3-ITD 还可以抑制Myc 拮抗物Mxi-1 从而增强Myc 活性,高三尖杉酯碱联合奎扎替尼可以通过抑制FLT3-AKT-cMyc 信号途径增强FLT3-ITD 急性髓系白血病细胞体外治疗效果[11-12]。多肽类抑制剂OmoMYC 可以抑制三种MYC 蛋白与启动子的结合能力,发挥抗肿瘤作用明显且副作用少,并且以及进入临床试验阶段。APTO-253 抑制剂通过抑制MYC 基因的表达水平,用于复发∕难治性AML 和骨髓异常综合征的治疗,也进入了I 期临床试验阶段[13-14]。
THP1 细胞来源于急性单核细胞白血病患者,其属于AML 中一种亚型,携带CSNK2A1-DDX39B融合基因[15]。本研究应用CCK-8 和细胞凋亡实验,分析cMyc 抑制剂10058-F4 对THP1 细胞的生长抑制及细胞凋亡的诱导作用。实验结果显示,1 ~100 μmol∕L 浓度的cMyc 抑制剂F410058 呈浓度依赖性地抑制THP1 细胞增殖;荧光探针染色实验结果显示1 ~100 μmol∕L 的cMyc 抑制剂10058-F4处理组细胞中Calcein 荧光强度逐渐降低,活性细胞数也明显降低,PI 阳性细胞数比例明显高于对照组,提示cMyc 抑制剂10058-F4 对THP1 细胞具有明显的细胞毒性和细胞凋亡诱导作用。cMyc 抑制剂10058-F4 可以诱导细胞凋亡,但是其作用机制仍未阐明,本研究通过JC-1 荧光探针加载细胞,荧光显微镜分析THP1 细胞线粒体膜电位水平变化,实验结果显示cMyc 抑制剂10058-F4 处理后红色荧光逐渐减弱,绿色荧光逐渐增强,提示线粒体膜电位随着药物浓度增加而逐渐下降。cMyc 抑制剂10058-F4 可以诱导卵巢癌细胞中FOXO 家族基因mRNA 水平的表达,从而上调下游与细胞凋亡相关蛋白的表达,例如PUMA,Bim,和FasL 等[16]。本研究的Western blot 实验结果也显示BAX 的表达水平随着药物浓度的增加而增强,并且细胞凋亡执行蛋白Cleaved-Caspase3 的表达水平也是表达逐渐增强。
经10058-F4 处理后的THP1 细胞经过流式细胞仪分析细胞周期,结果显示处理后出现G2 期细胞比例随着药物浓度逐渐升高,提示10058-F4 可诱导THP1 细胞的G2∕M 细胞周期阻滞,并可能具有DNA 损伤诱导作用。也有研究[17]表明,下调骨肉瘤细胞cMyc 的表达可以抑制细胞增殖,并通过cMyc∕p21∕CDC2 信 号 途 径 诱 导G2∕M 细 胞 周 期阻滞,增强细胞对化疗的敏感性。还有研究显示CircECE1 与cMyc 相互作用以抑制E3 泛素连接酶斑点型锌指结构蛋白(speckle-type POZ)介导的cMyc 泛素化和降解,从而抑制硫氧还蛋白结合蛋白(TXNIP)转录,并激活Warburg 效应,参与糖代谢调节[18]。本研究通过Western blot 实验分析发现10058-F4 处理可以上调ATM 和H2AX 蛋白磷酸化水平,提示10058-F4 可诱导DNA 损伤和相关蛋白的活化。有研究[19]指出,cMyc 过表达将促进S 期时象细胞启动DNA 复制过程,并加剧DNA 基因组的不稳定性,促进H2AX 的磷酸化水平,可能导致肿瘤的发生。Myc 可以通过产生活性氧簇以及异常的DNA 复制诱导DNA 损伤,联合抑制PI3K 相关的DNA 损伤应答激酶和mTORC1 可诱导Myc 驱动的B 细胞淋巴瘤细胞凋亡[20]。但是至今未见到关于10058-F4 诱导DNA 损伤应答及作用机制的文献报道。
综上所述,cMyc 抑制剂F410058 对单核细胞白血病THP1 细胞的增殖具有抑制作用,并诱导细胞凋亡,可能是通过诱导线粒体凋亡途径所介导。同时,cMyc 抑制剂F410058 还具有诱导DNA损伤的作用,也是其诱导细胞凋亡的主要机制之一。cMyc 抑制剂F410058 的抗白血病作用机制的研究为AML 的临床治疗提供理论基础,可能成为AML 患者潜在的治疗选择。

