亚抑制浓度庆大霉素通过抑制ATP的产生降低大肠杆菌丛动能力的机制
祝晓娟 龙永珍 陈晓玲 张莹 彭青 周树勤,4
1喀什地区第一人民医院麻醉科(新疆喀什844000);2南方医科大学珠江医院再生医学研究所(广州510280);3广州市红十字会医院儿科(广州510220);4南方医科大学珠江医院麻醉科(广州510280)
大肠杆菌是引发临床感染最为常见的致病菌之一[1]。运动性是大肠杆菌致病力或侵袭力的表型之一,大肠杆菌运动性对细菌向宿主细胞移动很重要[2-3]。运动性与大肠杆菌的迁移、扩散、定植及免疫逃逸均有关[4-5]。有研究表明运动性强的大肠杆菌在自发性细菌性腹膜炎中比其他菌株致病力更强[6]。
细菌的运动方式主要包括丛动(swarming)、游动(swimming)及蹭行(twiching)[7]。游动是指水环境下细菌细胞的个体无规则游动,是鞭毛介导的直线游动和翻腾运动交替进行的运动形式[7]。丛动是在半固体培养基表面细菌群体由接种点向周围扩散的运动。丛动和游动这两种运动都有鞭毛介导;但它们的区别在于:(1)丛动是细菌群体性运动,而游动是细胞个体行为;(2)丛动的细胞会在代谢、形态及某些蛋白表达等方面发生显著分化,即表面诱导分化现象,如鞭毛密度增加、菌体增长,毒力蛋白分泌增加等特性变化[8-9]。蹭行是指某些细菌依靠Ⅳ型菌毛驱动的颤抖现象[10]。
笔者前期研 究 发 现:1∕2~1∕8 最低抑菌 浓 度(MIC)的氨基糖苷类药物庆大霉素预处理大肠杆菌ATCC25922 1 h 后,大肠杆菌的丛动性显著降低。转录组测序结果显示,参与三羧酸循环(TCA)的8 个基因表达均下调[11]。由于TCA 循环提供细菌生命活动所需的能量(ATP),细菌丛动性受细菌能量供应的调控[9,12]。庆大霉素抑制丛动与ATP 产生减少、细菌运动所需能量不足的关系尚未明确。本研究将首先验证亚抑制浓度庆大霉素对大肠杆菌丛动性的抑制作用,以及庆大霉素对TCA 相关基因的表达水平的影响,测定ATP 水平,进而观察补充ATP 后是否能够逆转庆大霉素对大肠杆菌丛动性的抑制作用。本研究在一定程度上阐明了亚抑制浓度的庆大霉素抑制大肠杆菌丛动性的分子作用机制,可为庆大霉素在临床治疗大肠杆菌相关感染提供更多的理论基础及科学依据。
1 材料与方法
1.1 菌株及主要试剂 大肠杆菌ATCC25922,MH肉汤(Muller-Hinton Broth,上海励瑞生物科技有限公司);MH 琼脂(上海励瑞生物科技有限公司);庆大霉素(上海生物工程有限公司);牛肉粉、琼脂、胰蛋白胨、酵母粉购自英国OXOID 公司,葡萄糖、氯化钠、腺苷-5-三磷酸二钠盐(ATP)购自Sigma-Aldrich 公司。
1.2 方法
1.2.1 庆大霉素预处理对大肠杆菌丛动性的抑制作用 配制丛动琼脂培养板,使琼脂培养基中含胰蛋白胨0.8%,酵母提取物0.4%,氯化钠0.8%,琼脂0.5%,葡萄糖0.5%。121 ℃高压灭菌20 min,待其冷却至50 ℃左右,倒入已灭菌的干燥平板中,冷却备用。在MH 平板上挑取单克隆大肠杆菌过夜培养,用新鲜MH 肉汤稀释菌液OD600至0.3,加入庆大霉素至终浓度为1∕2 最低抑菌浓度(MIC),该组细菌作为处理组,不加庆大霉素的菌液作为对照组,置于37 ℃孵育1 h。各取1 mL菌液转移到2 mL EP 管中,室温10 000 r∕min 离心3 min,去上清,用MH 肉汤洗涤3 次并重悬,用紫外分光光度仪测定OD600,稀释菌悬液至OD600为0.2。处理组和对照组稀释菌悬液各取2 μL 接种于丛动琼脂平板,在37 ℃下孵育12 h,观察结果并测量直径,此实验重复3 次。
1.2.2 Real-time PCR 测定相关基因的表达水平 参考文献见表1,设计合成目的基因丙酮酸脱氢酶辅酶编码基因poxB 和aceE,Ⅱ型柠檬酸合成酶基因gltA,琥珀酸脱氢酶亚基编码基因sdhD 和sdhC,苹果酸辅酶A 连接酶beta 亚基编码基因sucC,延胡索酸水合酶Ⅰ级编码基因fumA,异柠檬酸脱氢酶编码基因icd 及管家基因GAPDH 的引物。取1∕2MIC 的庆大霉素诱导后的菌液1.5 mL,先加2 倍体积的细菌RNA 保护液(RNA Protect Bacteria Reagent,Qiagen)混匀,室温静置5 min 后,离心,去上清,获得菌体沉淀。按RNeasy Mini Kit 说明书提取细菌RNA,Nanodrop 测定RNA 浓度。PrimeScript RT reagent Kit with gDNA Eraser 试剂盒(RR047A,Takara)进行逆转录,获得cDNA 模板,采用SYBR Premix Ex TaqTMⅡ试剂盒(RR820A,Takara),EcoTMRealTime PCR system 进行real-time PCR,反应条件为:预变性95 ℃30 s,变性95 ℃5 s,退火60 ℃30 s,共40 个循环。实验重复3 次,采用ΔΔCt 相对定量法分析目的基因在庆大霉素处理组及对照组的表达变化情况。

表1 Real-time PCR 的引物序列Tab.1 Primer sequence of Real-time PCR
1.2.3 细菌胞内ATP 水平测定 采用ATP 检测试剂盒ATP Detection Assay Kit-luminescence(Cayman chemical)测定庆大霉素对细菌ATP 产生的影响,过夜培养的细菌用新鲜MH 肉汤稀释菌液OD600至0.5,加入庆大霉素至终浓度为1∕2 MIC 浓度,设置为处理组,不加庆大霉素的菌液作为对照组,37 ℃孵育1 h 后,将菌液取出,离心,冰浴条件下超声破碎细菌3 min,每次超声3 s 间隔3 s;12 000×g离心15 min,取上清放4 ℃备用。按试剂盒说明书配置制定标准曲线,酶标仪读取庆大霉素处理组及对照组细菌裂解液的发光值,根据标准曲线计算各样本中的ATP 浓度,每组样本测试3 次。
1.2.4 补充ATP 对庆大霉素预处理大肠杆菌丛动性的逆转作用 配置丛动琼脂培养板,琼脂培养基经121 ℃高压灭菌20 min,待其冷却至50 ℃左右,分别加入腺苷-5-三磷酸二钠盐(ATP)使其终浓度为0.9、2.7、4.5 mmol∕L,混匀后倒入已灭菌的干燥平板中,冷却备用。大肠杆菌过夜培养菌液稀释后,分别设置庆大霉素预处理和对照组,处理方法同前。处理结束后,各取1 mL 菌液转移到2 mL EP管中,室温10 000 r∕min离心3 min,去上清,用MH 肉汤洗涤3 次并重悬,用紫外分光光度仪测定OD600,稀释菌悬液至OD600为0.2。处理组和对照组稀释菌悬液各取2 μL 接种于丛动琼脂平板,在37 ℃下孵育12 h,观察结果并测量直径,实验重复3 次。
1.3 统计学方法 各组数据以均数±标准差表示,采用Graphpad Prism 5 软件,t检验法进行组间差异比较。P<0.05 为差异有统计学意义。
2 结果
2.1 庆大霉素对大肠杆菌丛动性的抑制作用 大肠杆菌ATCC25922 经亚抑制浓度庆大霉素预处理后,细菌的丛动性明显减弱,细菌运动直径为(25±2)mm,较对照组运动直径(18.00 ± 2.00)mm 明显减少(图1)。该结果证实亚抑制浓度的庆大霉素可抑制大肠杆菌的丛动能力。
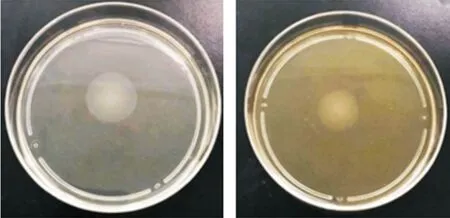
图1 亚抑制浓度庆大霉素对细菌丛动性的抑制作用Fig.1 Inhibitory effect of subconcentration gentamicin on bacterial motility
2.2 亚抑制浓度庆大霉素下调大肠杆菌TCA相关基因表达 Real-time PCR 结果显示,与对照组比较,经亚抑制浓度庆大霉素处理后,处理组大肠杆菌ATCC25922 的TCA 相关基因,poxB、aceE、gltA、sdhD、sdhC、sucC、fumA 及icd 基因表达均有不同程度的下调,下调倍数在0.35 ~0.60之间(图2)。
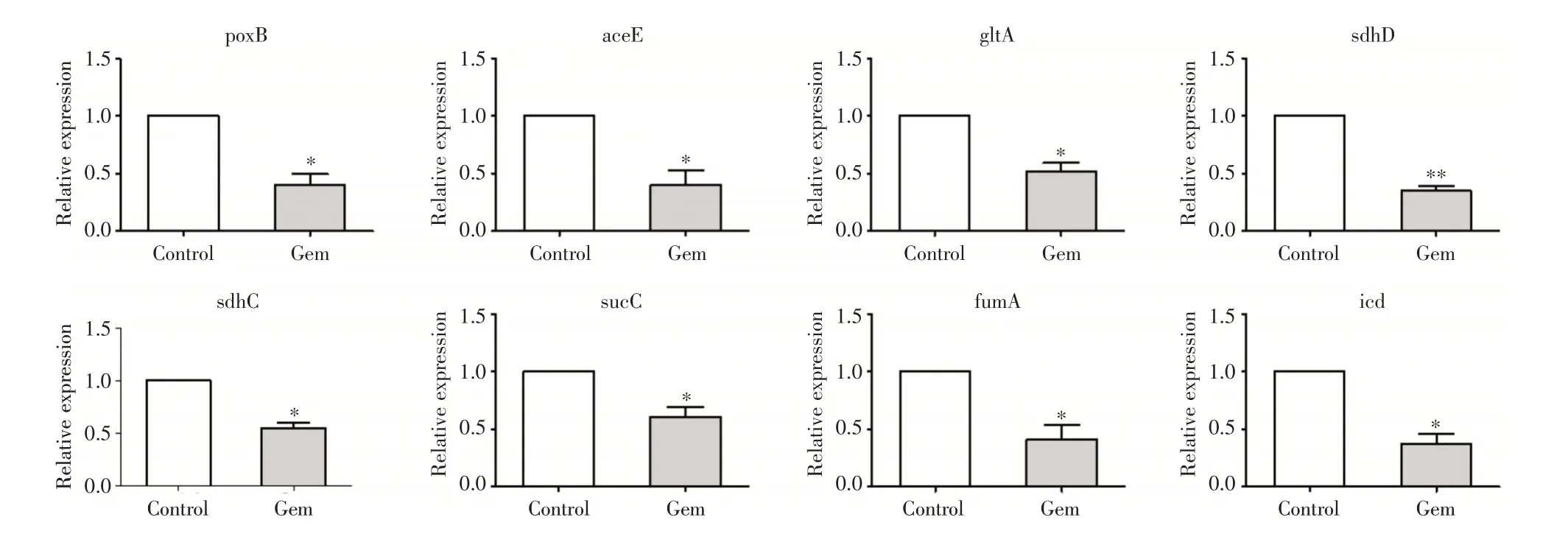
图2 Real-time PCR 检测大肠杆菌ATCC25922 的TCA 相关基因表达水平Fig.2 Real time PCR was used to detect the expression level of TCA related genes in Escherichia coli ATCC25922
2.3 亚抑制浓度的庆大霉素抑制细菌ATP 的产生 结果显示,对照组细菌胞内ATP浓度为(24.2±3.45)fm,而1∕2MIC 庆大霉素处理的细菌胞内ATP水平下降至(11.5 ± 1.98)fm,差异有统计学意义(P<0.05),提示亚抑制浓度庆大霉素对大肠杆菌ATP 合成具有抑制作用。
2.4 补充ATP 可逆转庆大霉素对大肠杆菌丛动性的抑制作用 在培养板添加0.9、2.7、4.5 mmol∕L ATP后,细菌被庆大霉素抑制的丛动能力可被显著逆转,细菌在所有添加ATP 的平板中,丛动能力均较对照组和预处理庆大霉素抑制组显著增强(图3)。但对比不同组间的运动直径,结果显示,在被庆大霉素预处理后,大肠杆菌在含0.9、2.7 mmol∕L ATP平板中的丛动能力无差异,而随着ATP 浓度增加至4.5 mmol∕L,细菌丛动性并没有继续增强,反而有所下降,提示胞外环境中过量的ATP 有可能会抑制大肠杆菌的丛动性。见表2。

图3 补充ATP 逆转庆大霉素对大肠杆菌丛动性的抑制作用Fig.3 ATP supplementation reverses the inhibitory effect of gentamicin on the plexus of Escherichia coli
表2 不同处理组的细菌运动直径测量结果Tab.2 Measurement results of bacterial movement diameter in different treatment groups ±s
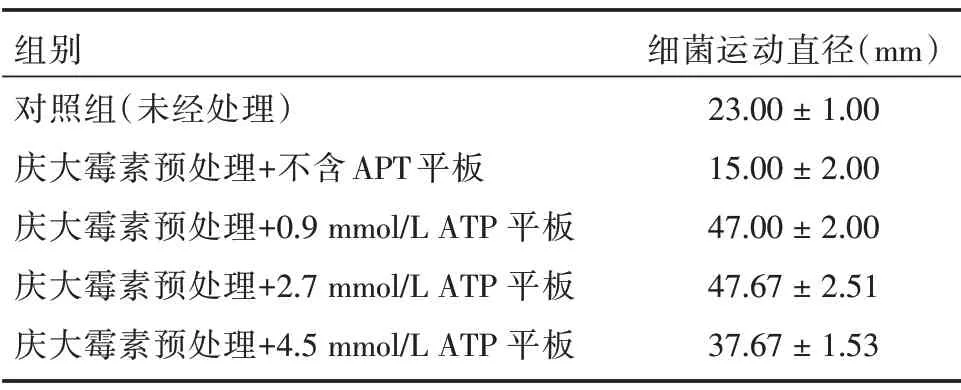
表2 不同处理组的细菌运动直径测量结果Tab.2 Measurement results of bacterial movement diameter in different treatment groups ±s
组别对照组(未经处理)庆大霉素预处理+不含APT 平板庆大霉素预处理+0.9 mmol∕L ATP 平板庆大霉素预处理+2.7 mmol∕L ATP 平板庆大霉素预处理+4.5 mmol∕L ATP 平板细菌运动直径(mm)23.00±1.00 15.00±2.00 47.00±2.00 47.67±2.51 37.67±1.53
3 讨论
庆大霉素是一种氨基糖苷类抗生素[15]。庆大霉素虽然有其毒副作用,但作为对革兰阴性杆菌和革兰阳性球菌效果较好的抗生素之一,且具有较好的抗生素后效应(PAE),因此临床应用仍然较广[16-17]。
本研究结果显示,经不同亚抑制浓度(1∕8 ~1∕2 MIC)庆大霉素预处理1 h 后,撤去庆大霉素后,大肠杆菌的丛动性仍然受到一定的抑制,且抑制作用随着庆大霉素预处理浓度增加而增加,这一效应也应属于庆大霉素的PAE 效应的一种,这种特殊的PAE 作用对于临床治疗大肠杆菌感染具有其自身优势。Real-time PCR 进一步发现,经1∕2 MIC 庆大霉素处理后,大肠杆菌ATCC 25923 的TCA 相关基因,包括丙酮酸脱氢酶辅酶编码基因poxB 和aceE、Ⅱ型柠檬酸合成酶基因gltA、琥珀酸脱氢酶亚基编码基因sdhD 和sdhC、苹果酸辅酶A连接酶beta 亚基编码基因sucC、延胡索酸水合酶Ⅰ级编码基因fumA 以及异柠檬酸脱氢酶编码基因icd 均下调。有研究发现,大肠杆菌琥珀酸脱氢酶亚基编码基因sdhA、sdhB 及sdhC 突变株的丛动性较野生株明显降低,但其更深入的分子机制仍不清楚[18]。本研究结果发现,细菌经亚抑制浓度的庆大霉素处理后,ATP 产生明显降低。细菌丛动性是一种群体性的运动,该行为需要细菌能量的供应[19],有研究发现,从基因表达谱的特点来看,细菌发生丛动时存在异质性,位于细菌丛动中心的细菌更像提供营养的菌群,而位于边缘位置的细胞更倾向于表达参与能量代谢的基因,包括电子传递链的成分和ATP 的产生[20-21]。说明细菌丛动性的运动方式跟能量代谢息息相关。据此,结合本研究结果,亚抑制浓度的庆大霉素对大肠杆菌丛动性的抑制作用,可能与其抑制TCA 和进一步抑制ATP 产生有关。
研究表明,在培养环境中补充ATP,细菌是可以将胞外的ATP 摄入到细菌内部并进行充分利用的[13]。为了进一步验证ATP 产生减少是否是导致大肠杆菌丛动性降低的原因,在丛动培养基中添加了不同浓度的ATP,结果发现,经庆大霉素预处理后,再接种于含不同浓度ATP丛动培养基的大肠杆菌,其丛动性均较对照组和庆大霉素预处理组的丛动性明显增强,提示亚抑制浓度庆大霉素是通过抑制ATP 的产生调控大肠杆菌的丛动能力。但不同ATP 浓度组间存在结果差异,大肠杆菌在含0.9、2.7 mol∕L ATP 平板中的运动直径相似,而随着ATP 浓度增加至4.5 mol∕L,细菌丛动性并没有继续增强,反而较前两组有所下降,提示胞外环境中过量的ATP反而会抑制大肠杆菌的丛动性。
本研究探讨了亚抑制浓度的庆大霉素对大肠杆菌丛动性的抑制作用相关机制,结果发现,亚抑制浓度的庆大霉素可能通过抑制TCA 相关基因的表达,限制了细菌ATP 的产生,从而导致细菌丛动性下降。该研究结果为进一步揭示庆大霉素的PAE 发生机制提供了新的理论依据。

