短链脂肪酸平衡在脓毒症治疗中的研究进展
代仔怡 武卫东 梁继芳 闫新明
山西医科大学第三医院(山西白求恩医院,山西医学科学院,同济山西医院)(太原030032)
脓毒症被定义为因感染引起的宿主反应失调,可导致危及生命的器官功能障碍,是全世界导致死亡和危重病的主要原因之一[1]。脓毒症发生时,缺氧损伤、肠上皮屏障功能受损、抗生素及血管升压药的使用导致肠道粪杆菌属等有益菌属减少,而梭杆菌属、变形菌属等致病菌过度增殖成肠道优势菌属[2-3]。短链脂肪酸(short chain fatty acids,SCFA)是肠道有益菌群消化膳食纤维或淀粉产生的代谢产物,通过抑制组蛋白去乙酰化酶(histone deacetylases,HDACs)、激活G 蛋白偶联受体(G-protein-coupled receptors,GPCRs),以及激活芳香烃受体(aryl hydrocarbon receptor,AhR)三种机制调节免疫细胞趋化性并释放抑炎因子,维持抗炎-促炎平衡。脓毒症患者肠道菌群失调导致SCFA 减少、抗炎作用减弱及肠上皮屏障功能损伤,继而进一步加重免疫失调及肠道屏障损伤,同时诱发致病菌的增殖及移位。因此,早期纠正脓毒症患者SCFA 失调是改善脓毒症预后的重要治疗手段。本文将对SCFA 在脓毒症中的作用机制及治疗方法的研究进展作一综述。
1 SCFA 抑制组蛋白去乙酰化酶
SCFA 主要包括乙酸、丙酸、丁酸三种类型。其通过抑制HDAC 调节蛋白质翻译后修饰,使免疫细胞分泌促炎因子减少、抑炎因子增加,从而维持免疫稳态。HDAC 抑制(HDACi)导致核因子NF-κB 失活,继而引起小肠固有层巨噬细胞编码NOS2、IL-6、IL-12 等促炎因子的基因表达减少[4]。另外,丁酸盐SCFA 通过HDACi 增强巨噬细胞组蛋白H3 赖氨酸乙酰化,继而在IL-6 和IL-12 编码基因启动子区域招募Mi-2β,组成Mi-2∕NuRD 阻遏复合物,从而抑制结肠巨噬细胞产生IL-6 和IL-12[5]。OHNO 及YANG 等[5-6]研究发现HDACi 增强核糖体蛋白S6 磷酸化及Foxp3 基因启动子和增强子区域的组蛋白乙酰化,进而诱导调节性T 细胞(Treg)分化并分泌IL-10。调节性B 细胞(Bregs)是免疫抑制性B 淋巴细胞,能够分泌免疫调节细胞因子[7]。HDACi 通过激活p38 MAPK 信号通路并抑制Jun N 端激酶(JNK)磷酸化来诱导B10 细胞分化[8]。B10 细胞是Bregs 的主要亚群,抑制辅助性T 淋巴细胞Th1 和Th17 扩增或通过IL-10 促进Treg 分化和激活TGF-β 信号,从而维持免疫稳态和免疫耐受[8](图1)。
2 SCFA 激活G 蛋白偶联受体通路
2.1 调节T 细胞和树突状细胞 SCFA 激活细胞膜上不同的GPCRs 即GPR41、GPR43、GPR109a 及其他GPCR 受体,以激活控制免疫的信号级联[9]。YANG 等[6]研究发现丁酸盐通过GPR41 激活mTOR及STAT3 信号通路进而促进CD4+T 淋巴细胞产生IL-22。IL-22 通过诱导肠上皮细胞产生抗菌肽、黏蛋白和其他有益作用来促进肠道屏障功能。另外,激活GPR109a 可以抑制树突状细胞产生IL-23,减少肠道炎症[10](图1)。
2.2 激活炎性小体 炎性小体是一种由受体蛋白ALRs 和NLRs、接头蛋白ASC、效应蛋白caspase 三部分组成的多蛋白细胞复合体,通过刺激促炎细胞因子的蛋白水解成熟和细胞焦亡来防御多种病原体感染[11-12]。KELLEY 及ZHAO 等[13]研究发现SCFA与肠上皮GPR43、GPR109a受体结合致细胞膜超极化和钙离子外流增加后激活NLRP3炎性小体。激活的NLRP3 炎性小体分泌IL-18 激活mTOR 及STAT3 信号通路,继而促进再生胰岛衍生蛋白Ⅲ
(regenerating islet-derived protein Ⅲgamma,RegⅢγ)和β-防御素等抗菌肽(antimicrobial peptides,AMP)分泌。抗菌肽能够调节肠道稳态,减少生物失调[14]。脓毒症患者炎症反应失调时,IL-18 分泌增多刺激mTOR 及STAT3 信号通路分泌AMP,AMP 产量的增加在正反馈环的基础上重新刺激mTOR 及STAT3,进而影响细胞增殖。另外,XIAO等[15]研究发现mTOR、STAT3 和ERK1∕2 信号通路介导IL-33促进肠上皮RegⅢγ表达并抑制肠道细菌定植,但是PALMIERI 等[16]报道了IL-33 的致病性。目前关于IL-33 调节肠道稳态的作用仍存在争议,这也许是探索肠道稳态机制的研究方向(图1)。
3 SCFA 激活芳香烃受体
AhR 是一种转录调节因子,其激活后参与结肠干细胞的增殖、上皮屏障功能和多种免疫细胞群的调节,包括上皮内RORγt+固有淋巴样细胞-3(ILC3)、γδT细胞、Th17∕22细胞、Treg和抗原提呈细胞[17]。之前的研究认为丁酸通过其HDACi 特性增强AhR 依赖基因表达的能力[18]。最近MARINELLI等[19]研究首次发现丁酸盐SCFA 作为AhR 直接配体,结合后促使AhR 移位到ILC3 细胞核与芳香烃受体核转位子蛋白(ARNT)结合形成异二聚体,异二聚体与异源生物反应元件(XRE)结合促进ILC3分泌IL-22。这种激活作用不依赖于GPCRs 且与HDACi 作用无关(图1)。
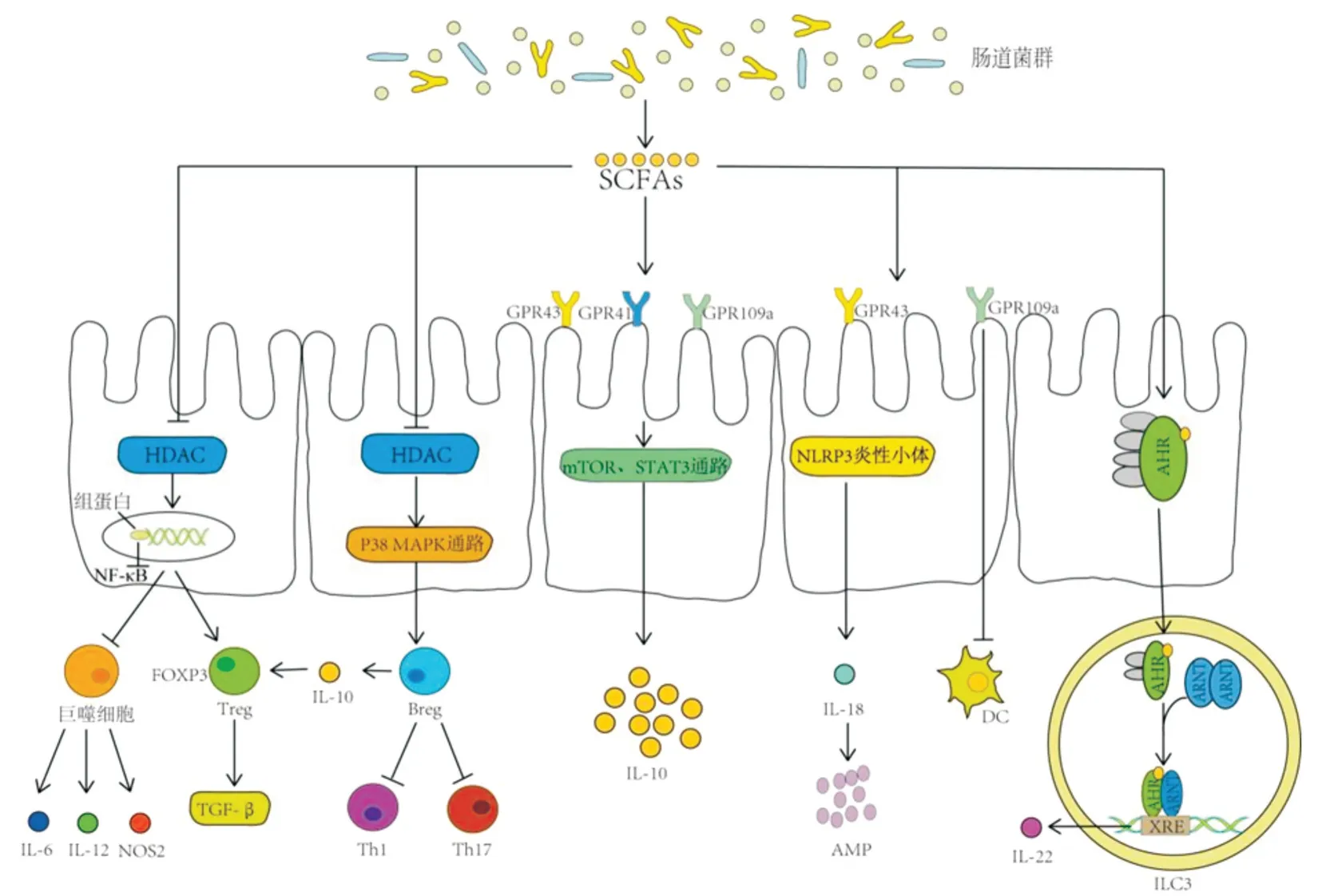
图1 短链脂肪酸调节肠道稳态机制Fig.1 Short chain fatty acids modulate immune homeostasis mechanisms
4 SCFA 对脓毒症的防治
4.1 SCFA 制剂 肠道作为驱动和维持多种脏器功能的动力器官,在脓毒症病理生理中起着关键作用。抑制细胞因子瀑布性释放对于脓毒症治疗至关重要。OKUMURA 及FU 等[20-21]实验表明静脉注射丁酸钠(NAB)抑制NF-κB 活化并恢复紧密连接蛋白claudin-1 和ZO-1 表达水平以此阻断细胞因子风暴恶性循环、改善肠道屏障功能并提高存活率。谢献政等[22]研究表明丙酸钠(SP)通过提高脓毒症大鼠结肠组织中紧密连接蛋白的表达,抑制NLRP3炎性小体的激活来减少结肠损伤。近年来,膳食SCFA 成为治疗致病性胃肠道感染的替代疗法。YAP 等[23]设计了一款以乙酰化和丁酰化的高直链淀粉(HAMS)为基础的特殊饮食,可以促进结肠中乙酸盐和丁酸盐产生,进而减少促炎因子IL-21、增加结肠Treg 细胞数量、增加连接标记表达及血清IL-22 水平来改善肠道稳态。另外,HAMS不仅可以作为短链脂肪酸的载体,还可能通过包裹病原体并阻止其附着至黏膜屏障来发挥作用。
4.2 粪菌移植 粪菌移植(fecal microbiota transplantation,FMT)是近年来新兴的肠道菌群靶向疗法。它是将筛选出的健康人粪便经过处理后移植到患者体内,重建患者肠道菌群以恢复其功能。2016年,WEI 等[24]报道了2 例因卒中入院的患者出现感染性休克、多器官功能障碍综合征(MODS)及水样腹泻的病例,给予FMT 治疗后患者病情明显好转。2017年,WURM 等[25]报道3 例因使用类固醇及抗生素致全身炎症反应综合征(SIRS)和大量持续性腹泻的患者,其中1 例停用抗生素后好转,另1 例因脓毒症及MODS 死亡。第3 例在SIRS和腹泻发生72 d 后进行FMT 治疗,症状迅速缓解最终达到临床和组织学完全恢复。2020年,KIM等[26]实验发现FMT 恢复脓毒症小鼠菌群多样性、增加丁酸盐SCFA 降低结肠通透性来维持肠道屏障功能、并使干扰素调节因子3 及NF-κB 信号通路恢复到稳态水平,在全身系统水平上驱动免疫应答,从而增强外周器官中的病原菌清除率并防止发展为致死性感染。2021年,ASSIMAKOPOULOS 等[27]实验表明FMT 对肠屏障功能障碍的整体预防作用可以使脓毒症病死率降低50%。综上所述,FMT 可能是脓毒症成功的治疗方法。FMT 最佳给药途径仍不清楚,目前常用途径分为上消化道和下消化道。上消化道途径包括口服胶囊和经导管给药。该途径通常更快、更便宜、耐受性好,但是通常因使用较少粪便菌群导致移植失败。下消化道途径包括灌肠和结肠镜检查。灌肠操作方便、价格便宜但是粪便菌群常不能扩散至目标肠段导致疗效不佳。结肠镜优势在于可以准确地将菌群送至目标肠段,但是重症患者可能无法耐受该操作。因此相较于上述途径,新兴的口服胶囊给药因无创、方便、高效性成为更优选择[28]。由于报道过因FMT 导致感染传播的事例且供受体选择、使用剂量和长期安全性均未达成共识,在使用FMT 时必须严格筛选。但是粪菌移植作为新型治疗方法,对改善脓毒症预后仍有无限潜力。
4.3 益生菌及益生元 益生菌是一种有益于宿主的活性微生物,益生元是可选择性的促进肠道有益菌的代谢和生长的物质[29]。关于益生菌、益生元及合生元在脓毒症治疗中的作用,目前尚未达成共识。BASSETTI 等[30]认为三种药物可以预防感染、改善脓毒症预后。陈娇等[31-32]研究也证明益生菌及益生元可以增加有益菌比例、SCFA 产生增多、清除病原菌从而保护肝功能及降低脓毒症患者呼吸机相关性肺炎。SUEZ 等[33]研究表明抗生素暴露后益生菌显著延迟粪便和肠道黏膜微生物组重建,对脓毒症患者恢复无明显作用。不同的研究结论可能是由于益生菌的种类不同导致。因此,由于对益生菌的种类及剂量的最佳选择缺乏共识,益生菌的使用受到限制。
5 总结与展望
在脓毒症背景下,肠道菌群失调导致SCFA 产生减少,促进组蛋白去乙酰化、抑制GPCR 及AhR激活,诱导免疫失调及肠上皮屏障损伤,进一步加重脓毒症炎症反应导致免疫失调恶性循环。因此,恢复脓毒症患者SCFA 正常水平可能是防止脓毒症病情恶化及改善预后的有效方法。目前临床纠正肠道SCFA 含量的方法主要是各种SCFA 制剂、益生元、益生菌及粪菌移植。国内外关于益生菌、益生元疗效尚未达成共识,因此其在临床上使用受到限制。SCFA 制剂特点是针对性补充SCFA,劣势在于作用单一、只能补充SCFA。而FMT是重新建立脓毒症患者肠道菌群,相较于SCFA 制剂作用更为全面。然而,FMT 作为一种新疗法,缺乏长期的安全性试验并且在脓毒症中的作用及疗效和安全性尚未完全明确。因此需要更多临床试验明确FMT 的疗效及安全性。目前还未有实验比较SCFA 制剂及粪菌移植的疗效,临床上是否能通过检测脓毒症患者粪便菌群组成来选择单一疗法或者联合使用SCFA 制剂及粪菌移植值得探究。未来希望更加深入的研究SCFA 与脓毒症相互作用机制,开发出更高效、安全、副作用少的基于微生物组的治疗方法,以改善脓毒症患者预后。

